A miastenia gravis (MG) é uma doença neuromuscular autoimune caracterizada por fraqueza e fatigabilidade dos músculos esqueléticos causada por disfunção/destruição dos receptores de acetilcolina na junção neuromuscular. A miastenia gravis apresenta-se com fadiga, ptose, diplopia Diplopia A visual symptom in which a single object is perceived by the visual cortex as two objects rather than one. Disorders associated with this condition include refractive errors; strabismus; oculomotor nerve diseases; trochlear nerve diseases; abducens nerve diseases; and diseases of the brain stem and occipital lobe. Myasthenia Gravis, disfagia, dificuldades respiratórias e fraqueza progressiva nos membros, levando à dificuldade de movimentos. O diagnóstico é estabelecido com base na apresentação clínica, deteção de anticorpos e estudos eletrofisiológicos. O tratamento visa aumentar a atividade da acetilcolina na junção neuromuscular e supressão de anticorpos. Essa doença pode estar associada a timomas e hiperplasia do timo, sendo às vezes indicada a timectomia. A miastenia gravis pode progredir para uma crise colinérgica com risco de vida com insuficiência respiratória, mas isso pode ser evitado com o tratamento adequado. O prognóstico é geralmente bom com o tratamento, e alguns doentes podem atingir uma remissão a longo prazo.
Last updated: Sep 30, 2025
A miastenia gravis (MG) é uma doença autoimune crónica na qual os anticorpos atacam o complexo do receptor Receptor Receptors are proteins located either on the surface of or within a cell that can bind to signaling molecules known as ligands (e.g., hormones) and cause some type of response within the cell. Receptors de acetilcolina (AChR) na junção neuromuscular.
Existem 2 formas clínicas principais de MG:
Além disso, existem formas mais MAIS Androgen Insensitivity Syndrome raras de MG que afetam principalmente a população pediátrica:
A miastenia gravis também pode ser classificada com base no perfil sorológico dos anticorpos presentes:
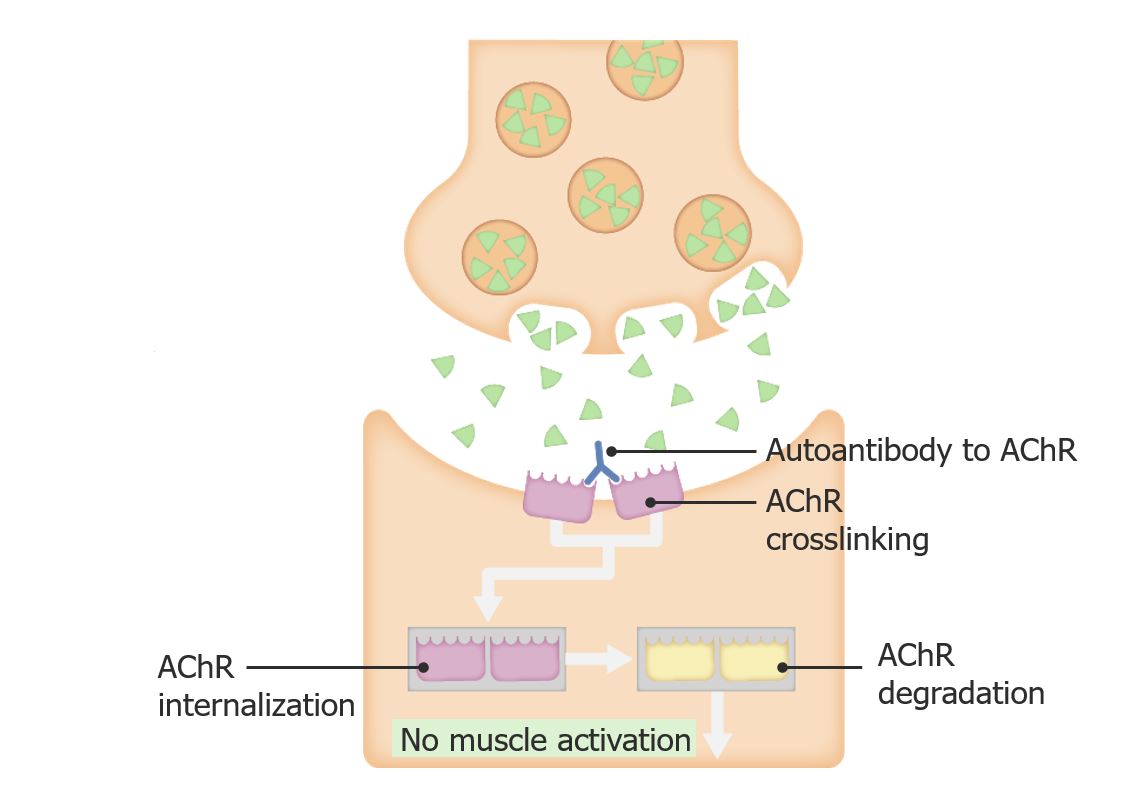
Fisiopatologia da miastenia gravis
Imagem por Lecturio.
Ptose em doente com miastenia gravis
Imagem: “Myasthenia Gravis” por Posey & Spiller. Licença: Public DomainA ressonância magnética ou tomografia computadorizada do tórax é realizada para descartar a possibilidade de um timoma.
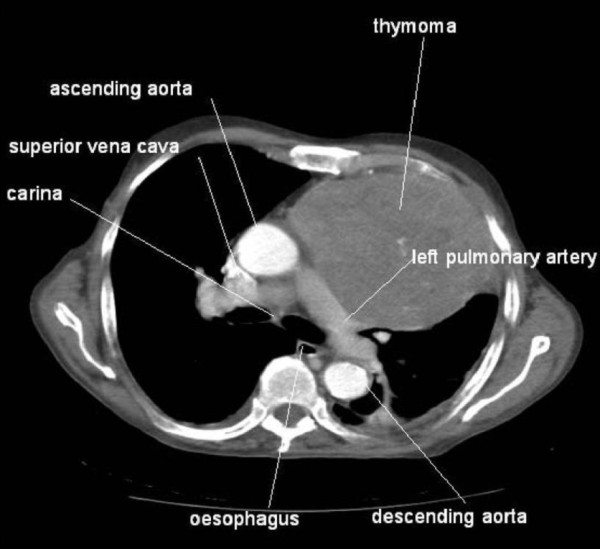
Tomografia computadorizada mostrando um grande timoma
Imagem: “Association between thymoma and persistent hypothermia: a case report” por Johns RH, Reinhardt AK. Licença: CC BY 2.0Inibidores da acetilcolinesterase:
Drogas imunossupressoras crónicas: