Los adenomas hipofisarios, también llamados tumores neuroendocrinos hipofisarios o PitNET en la clasificación de la OMS de 2022, son tumores que se desarrollan en el lóbulo anterior de la hipófisis. Si bien la OMS los reclasificó como tumores neuroendocrinos en 2022, el término "adenoma" sigue utilizándose ampliamente en la práctica clínica. Se clasifican por su tamaño (en micro o macroadenomas) y por su capacidad de secretar hormonas. Los adenomas no funcionales o no secretores no segregan hormonas, pero pueden comprimir el tejido hipofisario circundante provocando un hipopituitarismo. Los adenomas secretorios producen diversas hormonas en función del tipo de célula del que se originan, lo que provoca un hiperpituitarismo.
Last updated: Dec 15, 2025
Patología general
Clasificación por tamaño
Clasificación según la producción de hormonas
| Hormona | Tipo de célula | Órgano diana | Función | Aumento | Disminución |
|---|---|---|---|---|---|
| ACTH | Corticotropas | Corteza suprarrenal | Estimular las hormonas adrenocorticales |
|
Enfermedad de Addison |
| Hormona del crecimiento | Somatotropas | Hígado y tejido adiposo | Estimula la síntesis de proteínas y el crecimiento general |
|
Enanismo |
| Prolactina | Lactotropas | Glándulas mamarias | Secreción de leche, desarrollo de las mamas femeninas | Hiperprolactinemia | |
| Hormona estimulante de la tiroides | Tirotropicas | Glándula tiroidea | Estimula la síntesis y la secreción de hormonas tiroideas | Hipertiroidismo | Hipotiroidismo |
| Hormona luteinizante | Gonadotropas | Ovarios y testículos | Estimula la testosterona, la ovulación, el cuerpo lúteo, el estrógeno y la progesterona |
|
|
| Hormona foliculoestimulante | Gonadotropas | Ovarios y testículos | Maduración del esperma, crecimiento de los LOS Neisseria folículos en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum los LOS Neisseria ovarios | Disgenesia gonadal | Hipogonadismo |
| Hormonas estimulantes de los LOS Neisseria melanocitos γ | Corticotropas | Melanocitos, células endoteliales, monocitos y queratinocitos | Aumenta la síntesis de melanina en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum los LOS Neisseria melanocitos | Melasma Melasma Melasma is a benign skin condition characterized by hyperpigmentation of sun-exposed regions due to excess melanin production and deposition. The condition mainly affects women during their reproductive years, particularly those with darker skin tones. Melasma, lentigo solar e hiperpigmentación postinflamatoria |
Microadenomas (< 10 mm)
Macroadenomas (> 10 mm)
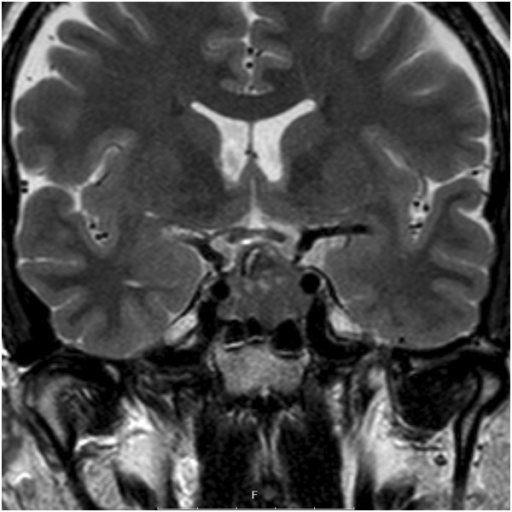
RM con corte coronal con contraste de la silla turca, que muestra un adenoma hipofisario. No hay invasión detectable del seno cavernoso.
Imagen: “Coronal T2-weighted magnetic resonance imaging of the sella, showing a pituitary adenoma” by Department of Clinical Sciences, Lund University, Lund S-221 85, Sweden. Licencia: CC BY 4.0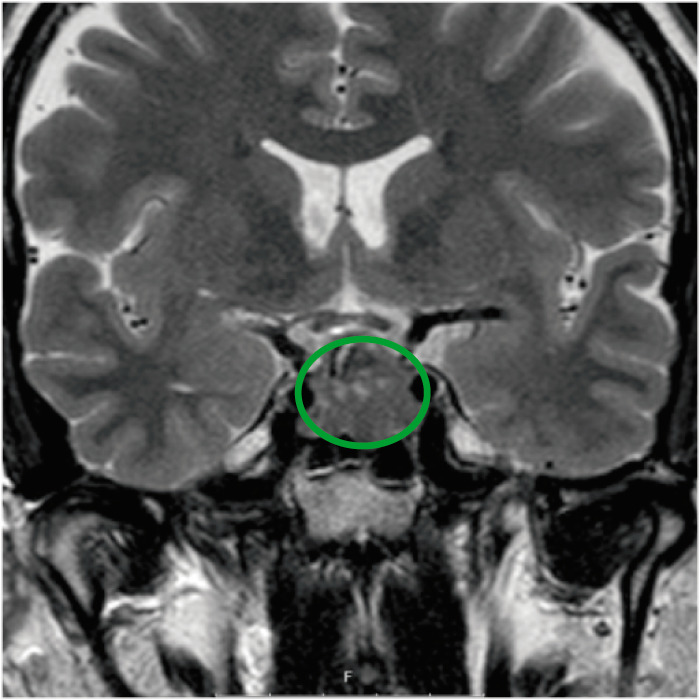
RM con corte coronal con contraste de la silla turca, que muestra un adenoma hipofisario. No hay invasión detectable del seno cavernoso.
Image: “Coronal T2-weighted magnetic resonance imaging of the sella, showing a pituitary adenoma” by Department of Clinical Sciences, Lund University, Lund S-221 85, Sweden. Licencia: CC BY 4.0, editado por Lecturio.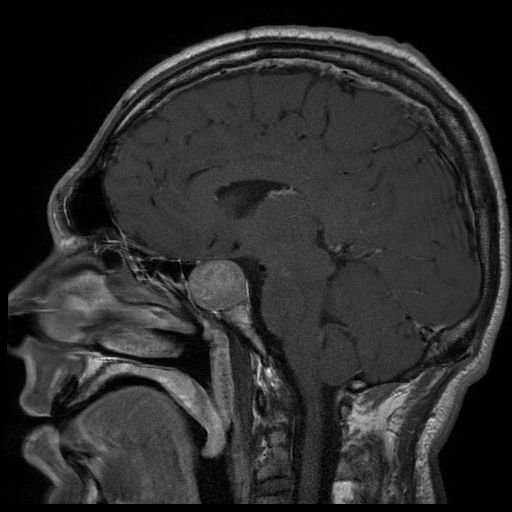
La RM de un paciente que presenta acromegalia muestra un gran adenoma hipofisario.
Image: “Tumeur hypophysaire” by Elgee. License: CC BY 3.0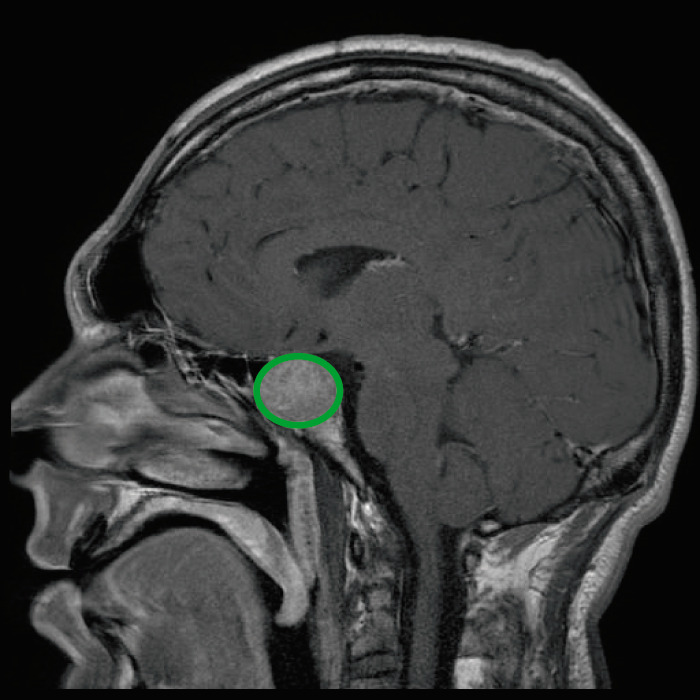
La RM de un paciente que presenta acromegalia muestra un gran adenoma hipofisario.
Image: “Tumeur hypophysaire” by Elgee. License: CC BY 3.0, edited by Lecturio.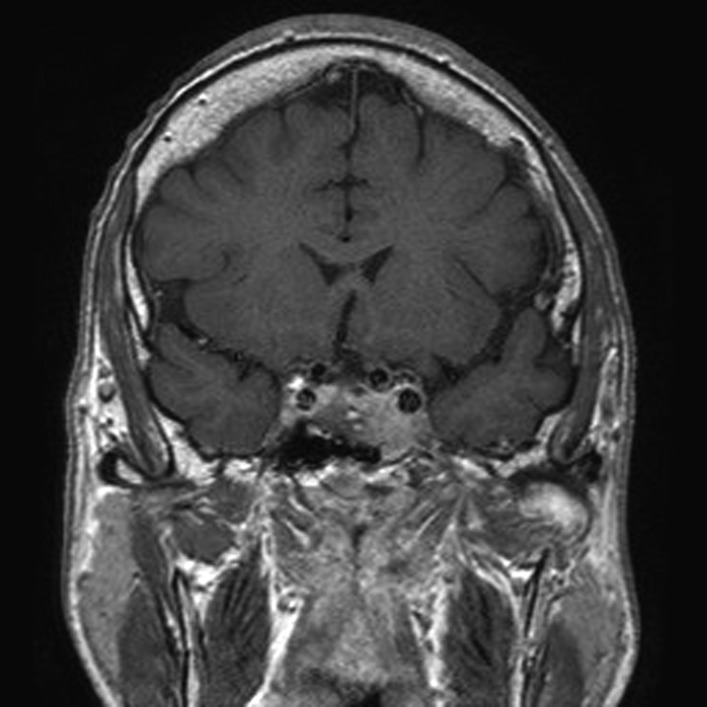
RM con contraste de la hipófisis que muestra un tumor hipofisario con invasión del seno cavernoso.
Image: “Before pasireotide therapy. MRI scan of pituitary – coronal view” by Rajesh Rajendran et al. License: CC BY 3.0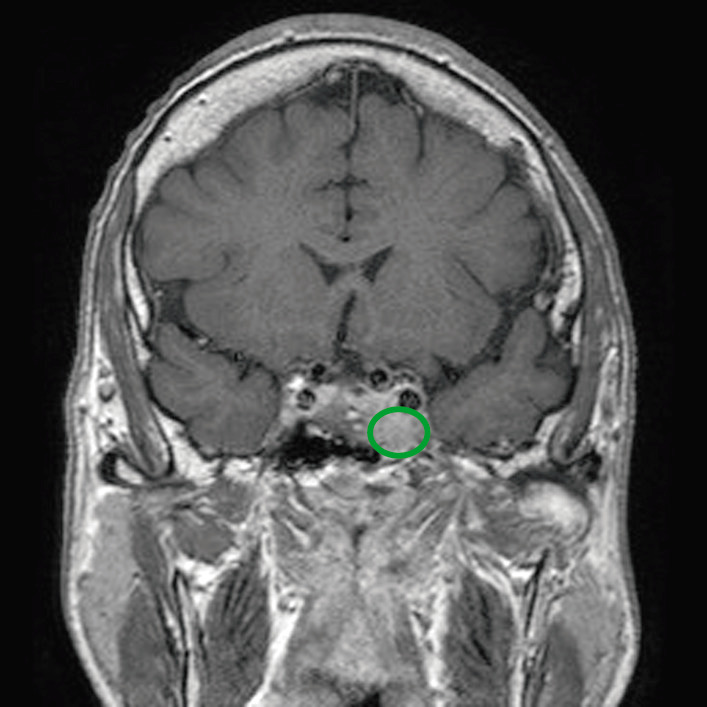
RM con contraste de la hipófisis que muestra un tumor hipofisario con invasión del seno cavernoso.
Image: “Before pasireotide therapy. MRI scan of pituitary – coronal view” by Rajesh Rajendran et al. License: CC BY 3.0, edited by Lecturio.
Las estrategias de tratamiento dependen del tipo y del tamaño de las células tumorales.
Terapia medica
Resección quirúrgica
La adenomectomía transesfenoidal (extirpación del adenoma) o la hipofisectomía completa/parcial (extirpación de la glándula hipófisis) se utilizan cuando falla el tratamiento médico. La adenectomía transesfenoidal endoscópica es ahora el abordaje quirúrgico preferido, con una extirpación completa del adenoma lograda en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum el 20-75% de los LOS Neisseria casos, dependiendo de la experiencia del cirujano y el volumen del centro.
Pronóstico