Os adenomas hipofisários são tumores que se desenvolvem no lobo anterior da hipófise. Estes são classificados pelo tamanho (micro ou macroadenomas) e pela capacidade de secreção de hormonas. Os adenomas não funcionantes ou não secretores não secretam hormonas, mas podem comprimir o tecido hipofisário adjacente, causando hipopituitarismo. Os adenomas secretores produzem várias hormonas, dependendo do tipo de célula a partir da qual tiveram origem, levando ao hiperpituitarismo.
Última atualização: Jun 22, 2025
Patologia geral
Classificação por tamanho
Classificação por produção hormonal
| Hormona | Tipo de célula | Órgão alvo | Função | Aumento | Diminuição |
|---|---|---|---|---|---|
| ACTH | Corticotrófica | Córtex suprarrenal | Estimulação de hormonas adrenocorticais |
|
Doença de Addison |
| Hormona do crescimento | Somatotrófica | Fígado e tecido adiposo | Estimulação da síntese de proteínas e do crescimento geral |
|
Nanismo |
| Prolactina | Lactotrófica | Glândulas mamárias | Secreção de leite, desenvolvimento mamário feminino | Hiperprolactinemia | |
| Hormona estimulante da tiróide | Tirotrófica | Glândula da tiróide | Estimulação da síntese e secreção das hormonas tiroideias | Hipertiroidismo | Hipotiroidismo |
| Hormona luteinizante | Gonadotrófica | Ovários e testículos | Estimulação da testosterona, ovulação, corpo lúteo, estrogénio e progesterona |
|
|
| Hormona folículo-estimulante | Gonadotrófica | Ovários e testículos | Maturação de espermatozóides, crescimento de folículos nos ovários | Disgenesia gonadal | Hipogonadismo |
| Hormona estimuladora de melanócitos-γ | Corticotrófica | Melanócitos, células endoteliais, monócitos e queratinócitos | Aumento da síntese de melanina nos melanócitos | Melasma, lentigo solar e hiperpigmentação pós-inflamatória |
Microadenomas (< 10 mm)
Macroadenomas (> 10 mm)
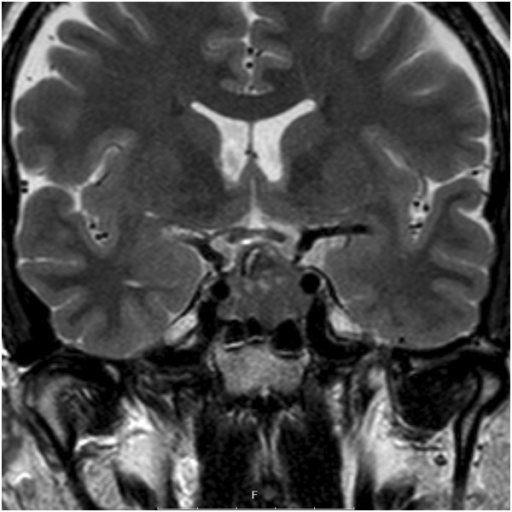
RM coronal com contraste da sela, a revelar um adenoma hipofisário. Não se deteta invasão do seio cavernoso.
Imagem: “Coronal T2-weighted magnetic resonance imaging of the sella, showing a pituitary adenoma” por Department of Clinical Sciences, Lund University, Lund S-221 85, Sweden. Licença: CC BY 4.0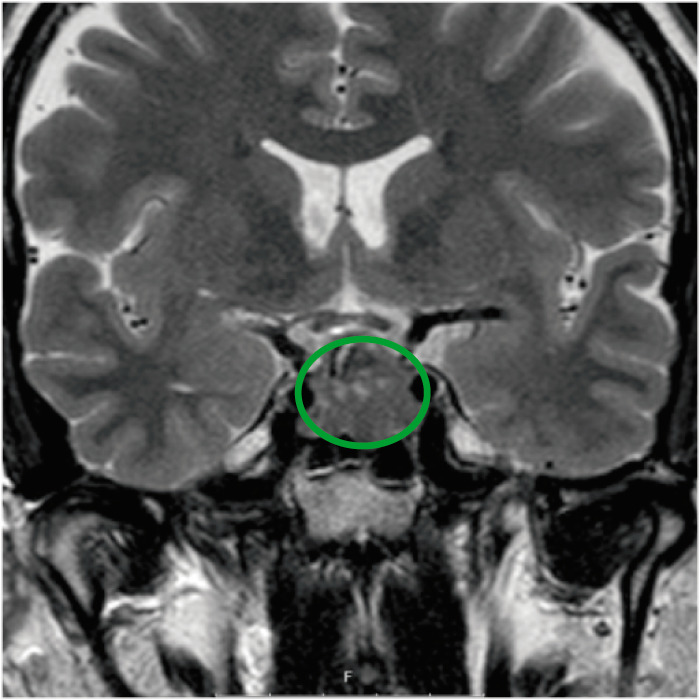
RM coronal com contraste da sela, a revelar um adenoma hipofisário. Não se deteta invasão do seio cavernoso.
Imagem: “Coronal T2-weighted magnetic resonance imaging of the sella, showing a pituitary adenoma” por Department of Clinical Sciences, Lund University, Lund S-221 85, Sweden. Licença: CC BY 4.0, editado por Lecturio.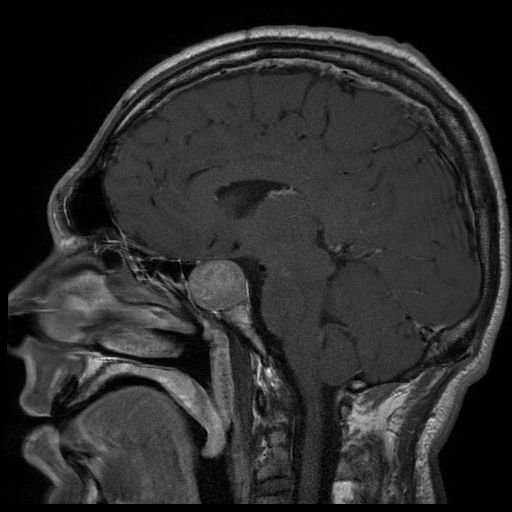
RM de paciente com acromegalia a revelar um adenoma hipofisário extenso.
Imagem: “Tumeur hypophysaire” por Elgee. Licença: CC BY 3.0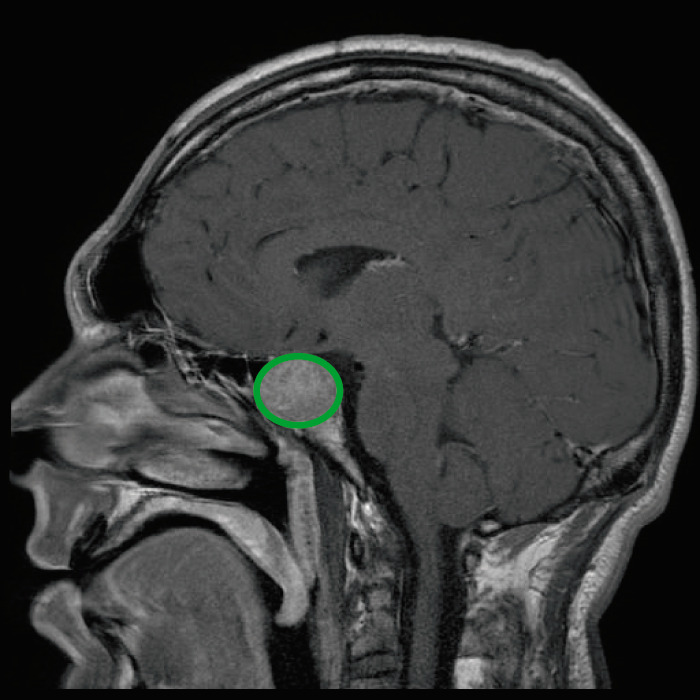
RM de paciente com acromegalia a revelar um adenoma hipofisário extenso.
Imagem: “Tumeur hypophysaire” por Elgee. Licença: CC BY 3.0, editado por Lecturio.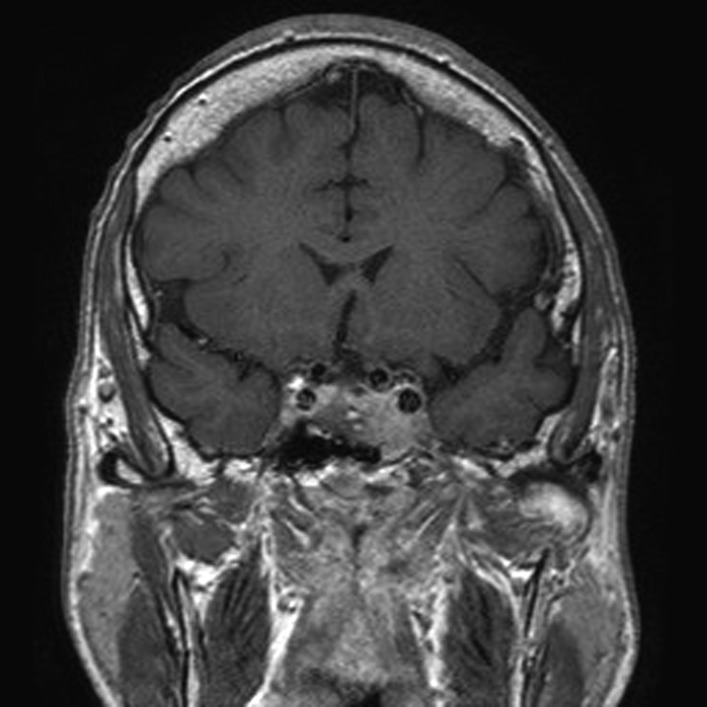
RM com contraste da hipófise a revelar tumor hipofisário com invasão do seio cavernoso.
Imagem: “Before pasireotide therapy. MRI scan of pituitary – coronal view” por Rajesh Rajendran et al. Licença: CC BY 3.0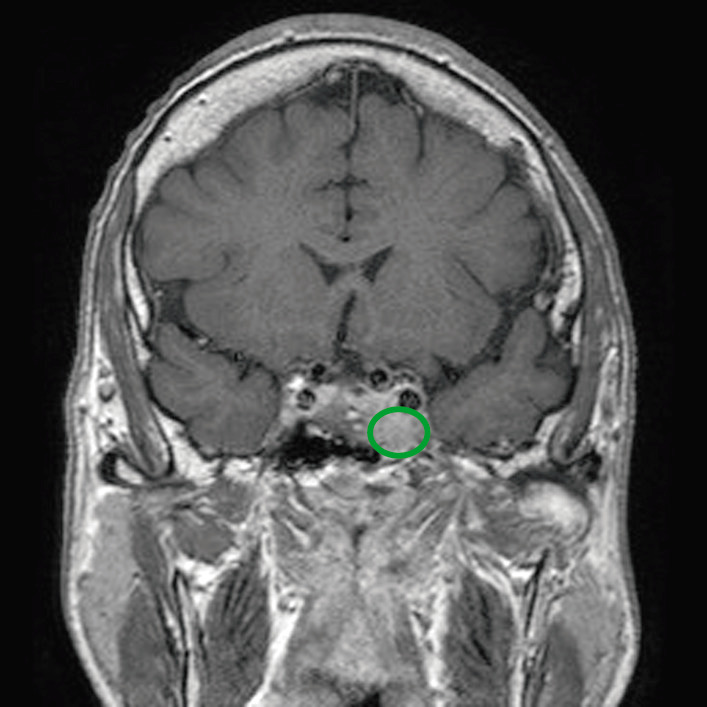
RM com contraste da hipófise a revelar tumor hipofisário com invasão do seio cavernoso.
Imagme: “Before pasireotide therapy. MRI scan of pituitary – coronal view” por Rajesh Rajendran et al. Licença: CC BY 3.0, editado por Lecturio.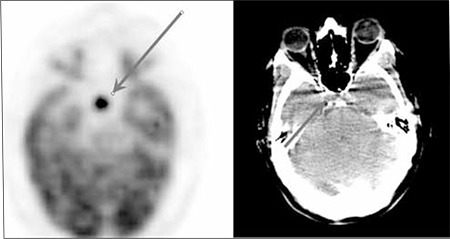
PET-FDG e imagem de TC axial de paciente assintomático a revelar foco de intenso hipermetabolismo na região selar, sugestivo de adenoma hipofisário não secretor.
Imagem: “FDG PET and CT axial image” por Sifa University, Nuclear Medicine, Izmir, Turkey. Licença: CC BY 2.5As estratégias terapêuticas dependem do tamanho e tipo de célula tumoral.
Tratamento médico
Resseção cirúrgica
A adenectomia transesfenoidal (remoção do adenoma) ou a hipofisectomia completa/parcial (remoção da glândula pituitária) são utilizadas quando o tratamento médico falha.