O cancro da mama caracteriza-se pela transformação maligna das células epiteliais da mama. Esta patologia é a forma mais comum de cancro e a segunda causa mais comum de morte relacionada com o cancro nas mulheres. Os fatores genéticos, a idade e a influência hormonal e ambiental contribuem para a progressão da doença. O tipo histológico mais comum é o carcinoma ductal invasivo, que corresponde a > 75% de todos os cancros da mama. A mamografia de rastreio é recomendada para a deteção precoce da doença. O diagnóstico é por biópsia de agulha grossa, e os fatores biológicos são determinados por testes imuno-histoquímicos. A cirurgia, tratamento sistémico (quimioterapia, terapêutica biológica, terapêutica endócrina) e radioterapia (RT) fazem parte do tratamento da doença num estadio inicial e localmente avançado. No cancro da mama metastático, utiliza-se o tratamento sistémico como medida paliativa.
Última atualização: Jul 25, 2022
Fatores de risco não modificáveis:
Fatores de risco modificáveis:
Mnemónicas:
“BReast-CAncer 1 and 2” (Cancro da mama 1 e 2) = Os genes mutados são o BRCA1 e BRCA2.
Não invasivos:
Invasivo:
Outras formas clínicas:
Com base na expressão de:
Tipos moleculares:
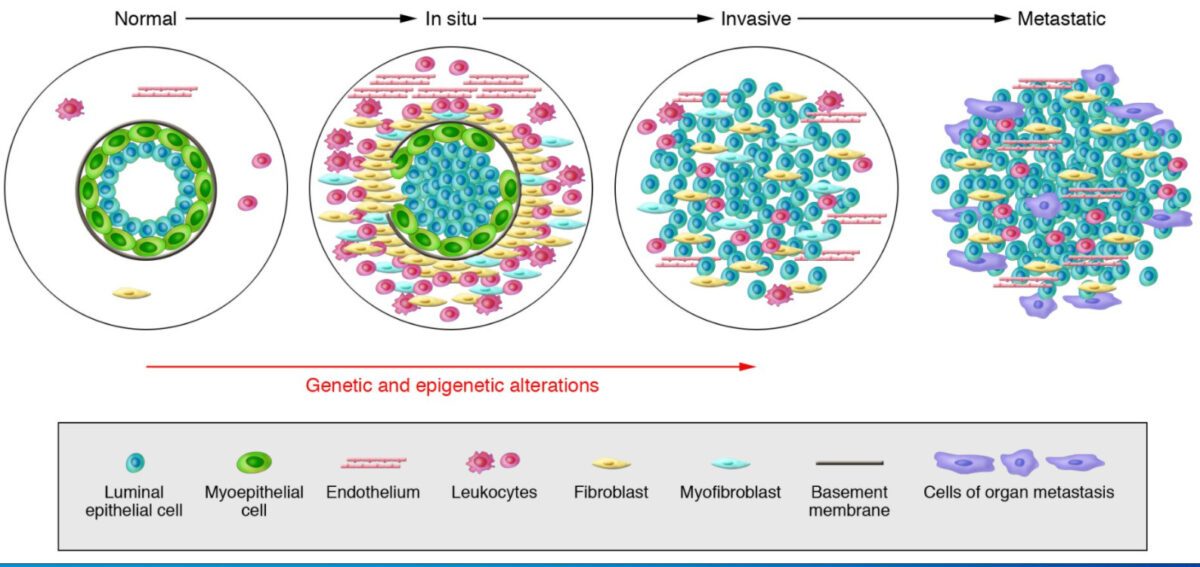
Modelo de progressão do tumor da mama
Da esquerda para a direita: Os ductos mamários normais são compostos pela membrana basal e uma camada de células epiteliais luminais e células mio-epiteliais. O estroma inclui vários leucócitos, fibroblastos, miofibroblastos e células endoteliais. Carcinomas in situ: As células mio-epiteliais sofrem alterações epigenéticas e fenotípicas e o seu número diminui, potencialmente devido à degradação da membrana basal. Os fibroblastos do estroma, miofibroblastos, linfócitos e células endoteliais aumentam. Nos carcinomas invasivos, há perda de células mio-epiteliais e da membrana basal, permitindo que as células tumorais invadam os tecidos circundantes. As células tumorais migram para órgãos distantes, causando eventualmente metástases.
Em regiões com rastreio do cancro da mama estabelecido: A maioria dos casos de cancro é diagnosticada com uma mamografia anormal.
Sintomas:
Sinais:
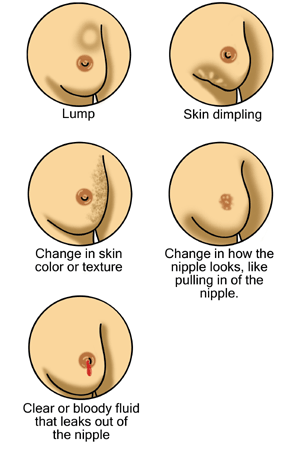
Sinais possíveis de cancro da mama
Da esquerda para a direita, de cima para baixo: nódulo/massa na mama, pele em casca de laranja, alteração da cor/textura da pele, alterações do mamilo incluindo a retração (mamilo “para dentro”) e secreção mamilar
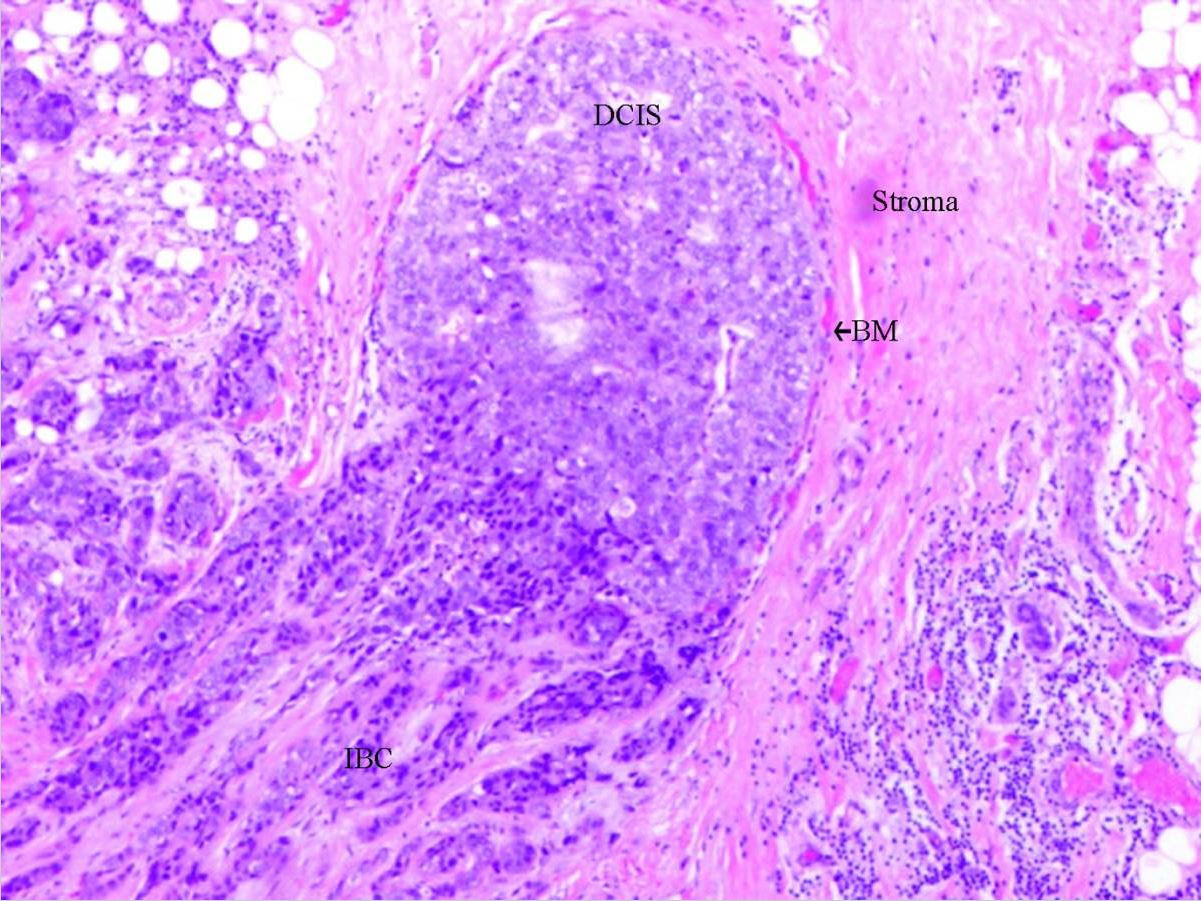
Carcinoma ductal in situ : CDIS com invasão
Abreviaturas utilizadas:
DCIS: carcinoma ductal in situ
BM: membrana basal
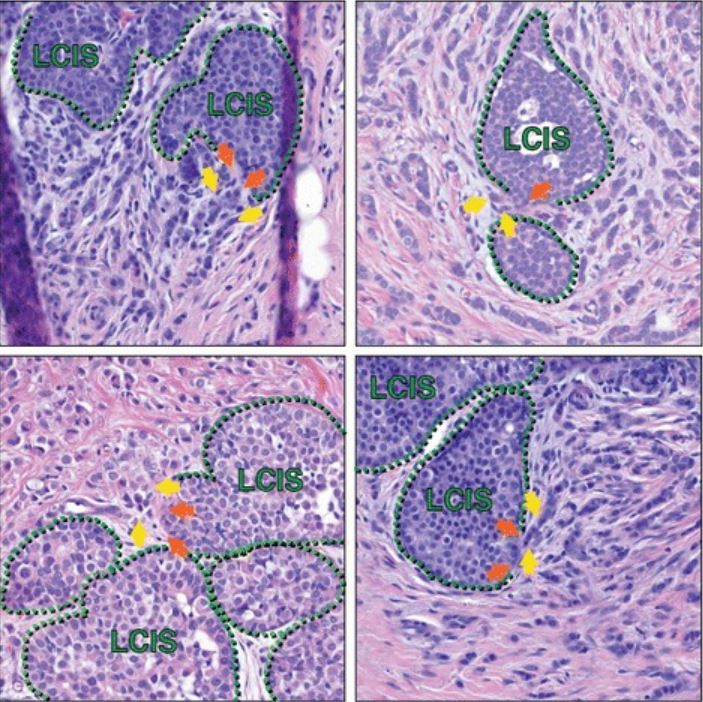
Carcinoma lobular in situ em associação com carcinoma lobular invasivo (CLI).
Secções histológicas de vários doentes captam áreas de CLIS que parecem ter rutura focal da camada mioepitelial adjacente ao CLI, sugerindo uma possível progressão de CLIS para CLI em tais transições. As linhas a tracejado verdes marcam a camada mioepitelial; as setas laranja são possíveis focos de rutura mioepitelial; as setas amarelas destacam as células invasivas. Além das células marcadas com setas amarelas, estão presentes células CLI adicionais em cada imagem por todo o estroma, circundando as áreas do CLIS.
| CDIS | CLIS | |
|---|---|---|
| Apresentação clínica | Unifocal | Multifocal |
| Padrões |
|
Sólido |
| Calcificação | Sim/não | Normalmente não |
| Risco de cancro da mama invasivo | Mais elevado | Mais baixo |
| Localização do cancro | Mama ipsilateral | Ipsilateral ou contralateral |
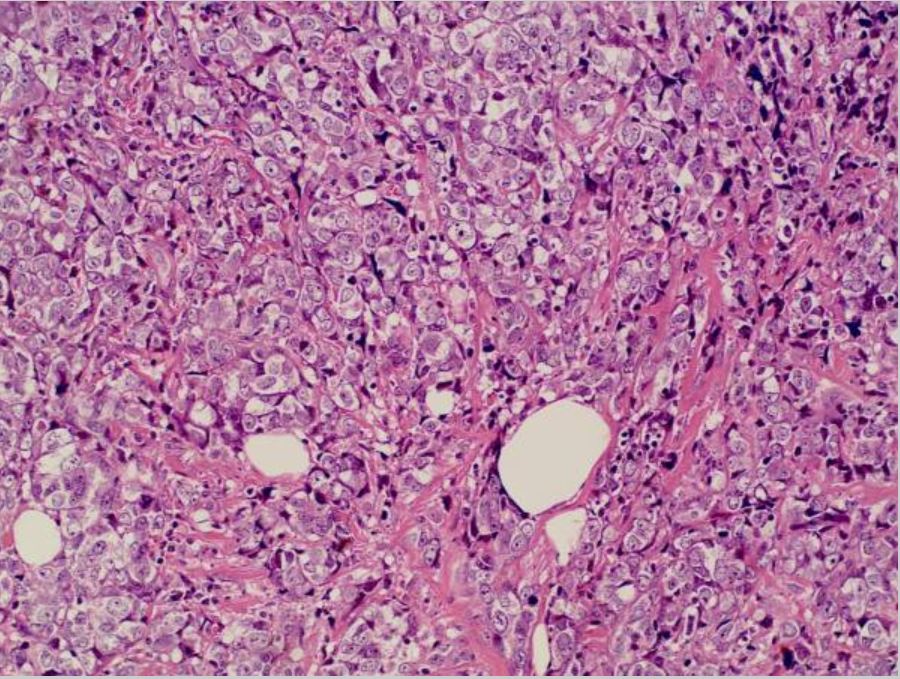
Cancro da mama: carcinoma ductal invasivo na mama esquerda
Imagem : “Invasive ductal breast cancer metastatic to the sigmoid colon” pelo Zhou XC, Zhou H, Ye YH, Zhang XF, Jiang Y. Licença: CC BY 2.0.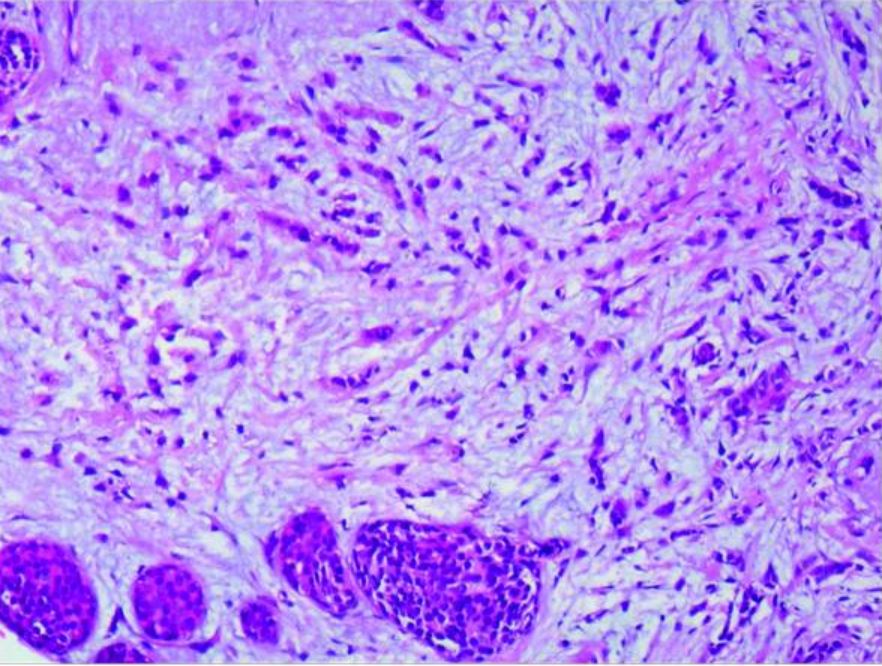
Carcinoma lobular: carcinoma lobular invasivo da mama direita e CLIS (amplificado 20×10)
Imagem : “Case report of small bowel obstruction caused by small intestinal metastasis of bilateral breast cancer” pelo Lv L, Zhao Y, Liu H, Peng Z. Licença: CC BY 3.0.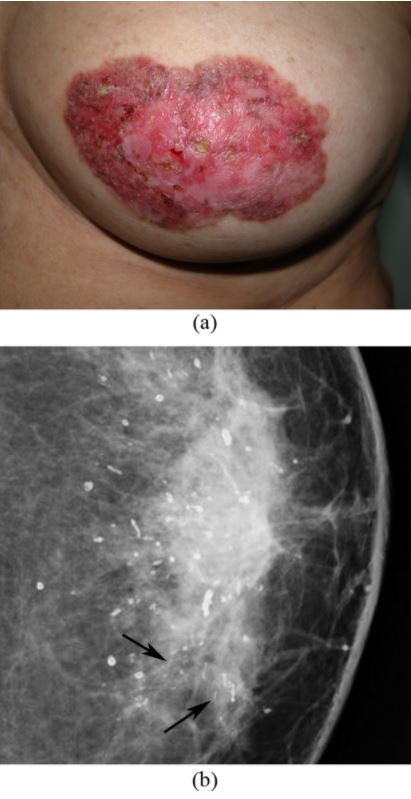
Doença de Paget da mama: alterações areolares do mamilo esquerdo
(a) Esta fotografia da mama esquerda mostra um espessamento da pele, vermelhidão, eritema, erosão do mamilo e descamação em redor da área mamilo-areolar.
(b) Na mamografia observam-se calcificações dispersas em forma de bastonetes e grupos de microcalcificações pleomórficas, finas e lineares no quadrante interno (setas). Uma mastectomia simples revelou a presença de CDIS e calcificações secretoras na mama e doença de Paget do mamilo.
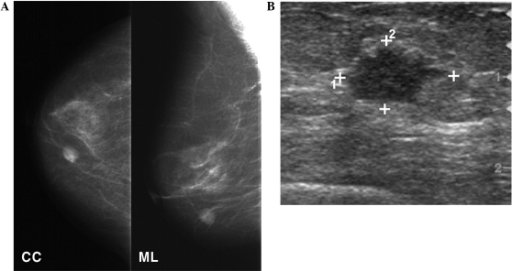
Mamografia e ecografia da mama
A: A mamografia mostra uma massa arredondada de alta densidade no quadrante inferior interno da mama direita.
B: A ecografia de follow-up mostra uma massa hipoecoica de 1,3 cm de formato irregular na mama.
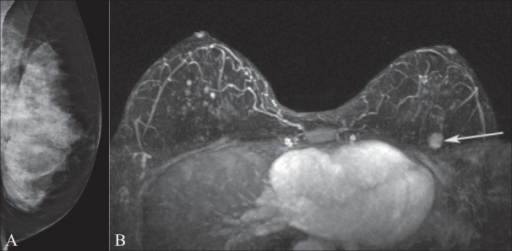
Mamografia e ressonância magnética da mama
A imagem A mostra uma mamografia da mama esquerda numa doente portadora da mutação do gene BRCA1. Observe o tecido mamário extremamente denso.
A imagem de RM B mostra uma massa com realce (seta) na parte superior da mama esquerda, que estava oculta na mamografia.
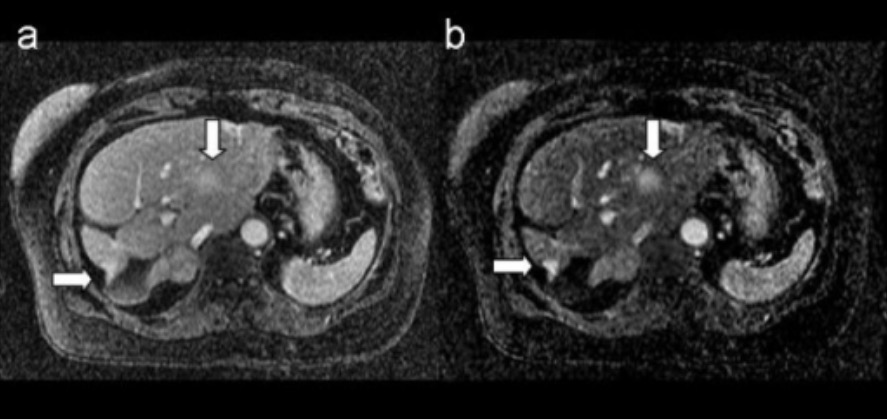
RM de metástase mamária: nas imagens observam-se lesões mamárias metastáticas no fígado
A. Imagem 3D após-contraste ponderada em T1
B. imagem 3D de subtração correspondente
As setas indicam as lesões metastáticas.
| Estádio do tumor | Descrição |
|---|---|
| Tx | Não é possível avaliar a presença de um tumor primário |
| T0 | Sem evidência de tumor primário |
| Tis |
|
| T1 | Maior dimensão do tumor ≤ 20 mm |
| T2 | Maior dimensão do tumor > 20 mm, mas ≤ 50 mm |
| T3 | Maior dimensão do tumor > 50 mm |
| T4 | Tumor de qualquer tamanho, com extensão direta para a parede torácica e/ou pele (úlceras ou nódulos macroscópicos) |
| Estádio ganglionar | Descrição |
|---|---|
| cNX | Os GL regionais não podem ser avaliados. |
| cN0 | Sem metástases nos GL regionais |
| cN1 | Metastização para GL axilares móveis ipsilaterais de nível I, II |
| cN2 |
|
| cN3 |
|
| Metastização | Descrição |
|---|---|
| M0 | Sem evidência de metastização à distância (clínica ou radiográfica) |
| M1 | Metástase detetável |
| Estádio | Subestádios | Tumor | Gânglios | Metastização |
|---|---|---|---|---|
| 0 | Tis | N0 | M0 | |
| I |
|
T0-T1 | N1 | M0 |
| II |
|
T0-T3 | N0-N1 | M0 |
| III |
|
T0-T3 | N1-N2 | M0 |
| IV | Qualquer T | Qualquer N | M1 |
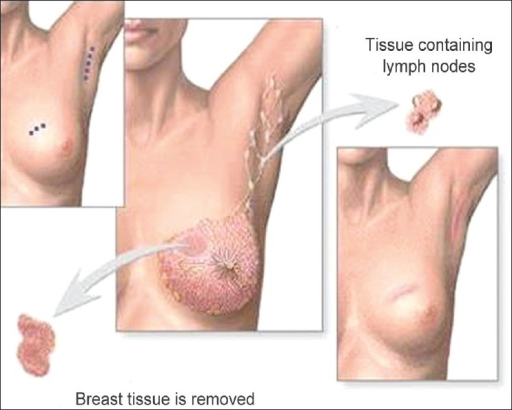
Cirurgia conservadora de mama (tumorectomia): excisão do tumor até as margens serem negativas e avaliação dos gânslios axilares
Imagem : “Phantom breast syndrome” pelo the Indian Journal of Palliative Care. Licença: CC BY 2.0.