O pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance do sangue é rigorosamente regulado na faixa de 7.35 –7.45 para garantir funções fisiológicas adequadas. São formadas grandes quantidades de ácido a cada dia por processos normais (respiração aeróbica/anaeróbica e ingestão alimentar), e estes são eficientemente controlados e eliminados por tampões no sangue, no sistema respiratório e no sistema renal. Quando estes sistemas reguladores são perturbados, ocorrem distúrbios do equilíbrio ácido-base, incluindo acidose respiratória, alcalose respiratória, acidose metabólica e alcalose metabólica.
Last updated: Dec 15, 2025
O pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance é a medida quantitativa da acidez ou basicidade de uma solução.
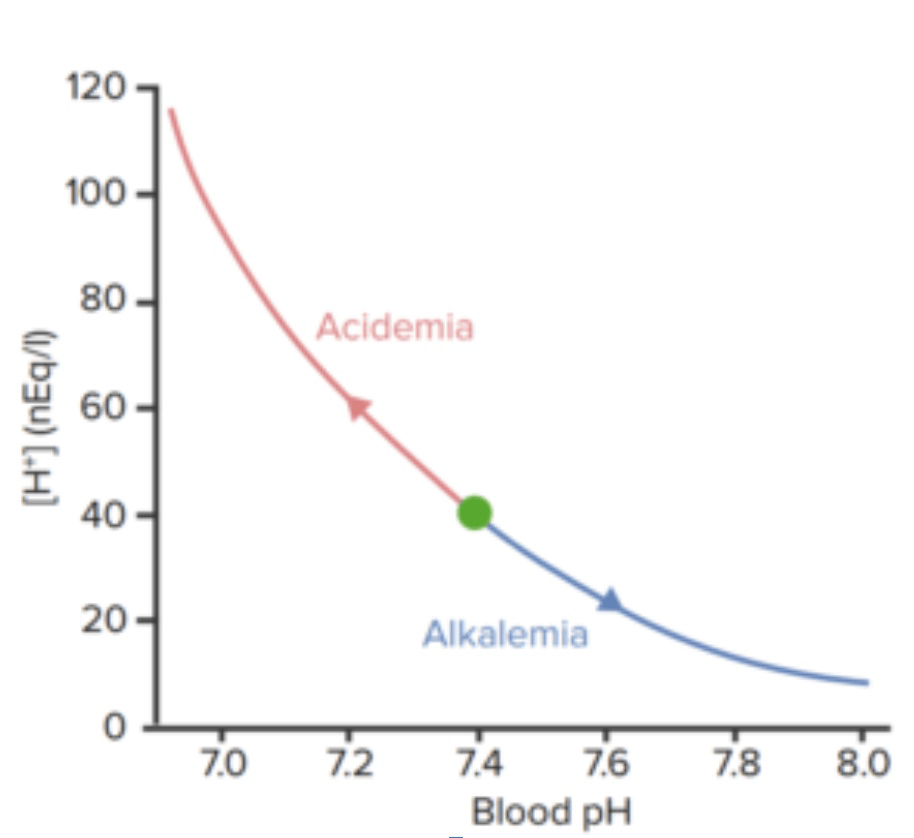
Relação entre o pH do sangue e a concentração de iões de hidrogénio
Imagem por Lecturio.| Compartimento | pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance |
|---|---|
| Secreções gástricas (sob condições de acidez máxima) | 0.7 |
| Lisossoma | 5.5 |
| Grânulo de cromafina | 5.5 |
| H 2O neutro a 37°C | 6.81 |
| Citosol de uma célula típica | 6,0–7,4 |
| Líquido cefalorraquidiano | 7.3 |
| Plasma Plasma The residual portion of blood that is left after removal of blood cells by centrifugation without prior blood coagulation. Transfusion Products sanguíneo arterial | 7.35–7.45 |
| Matriz interna mitocondrial | 7.5 |
| Secreções pancreáticas | 8.1 |
As concentrações relativas de ácidos e bases Bases Usually a hydroxide of lithium, sodium, potassium, rubidium or cesium, but also the carbonates of these metals, ammonia, and the amines. Acid-Base Balance no sangue determinam o seu pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance. Os tampões fornecem uma solução de curto prazo para distúrbios neste equilíbrio antes que os pulmões e os rins possam atuar definitivamente para restaurar o equilíbrio.
Os ácidos são compostos que podem doar protões (H +) ou aceitar eletrões.
As bases Bases Usually a hydroxide of lithium, sodium, potassium, rubidium or cesium, but also the carbonates of these metals, ammonia, and the amines. Acid-Base Balance são compostos que podem aceitar protões (H +) ou doar eletrões.
Tampões são substâncias que consomem ou libertam iões de hidrogénio (H+ ) para estabilizar o pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance.
| Gasimetria normal | Gasimetria com acidose | Gasimetria com alcalose | |
|---|---|---|---|
| HCO3– | 24 mEq/L | 26 mEq/L | 22 mEq/L |
| PaCO2 | 40 mm Hg | 60 mm Hg | 20 mm Hg |
| pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance | 7.40 | 7.26 | 7.66 |
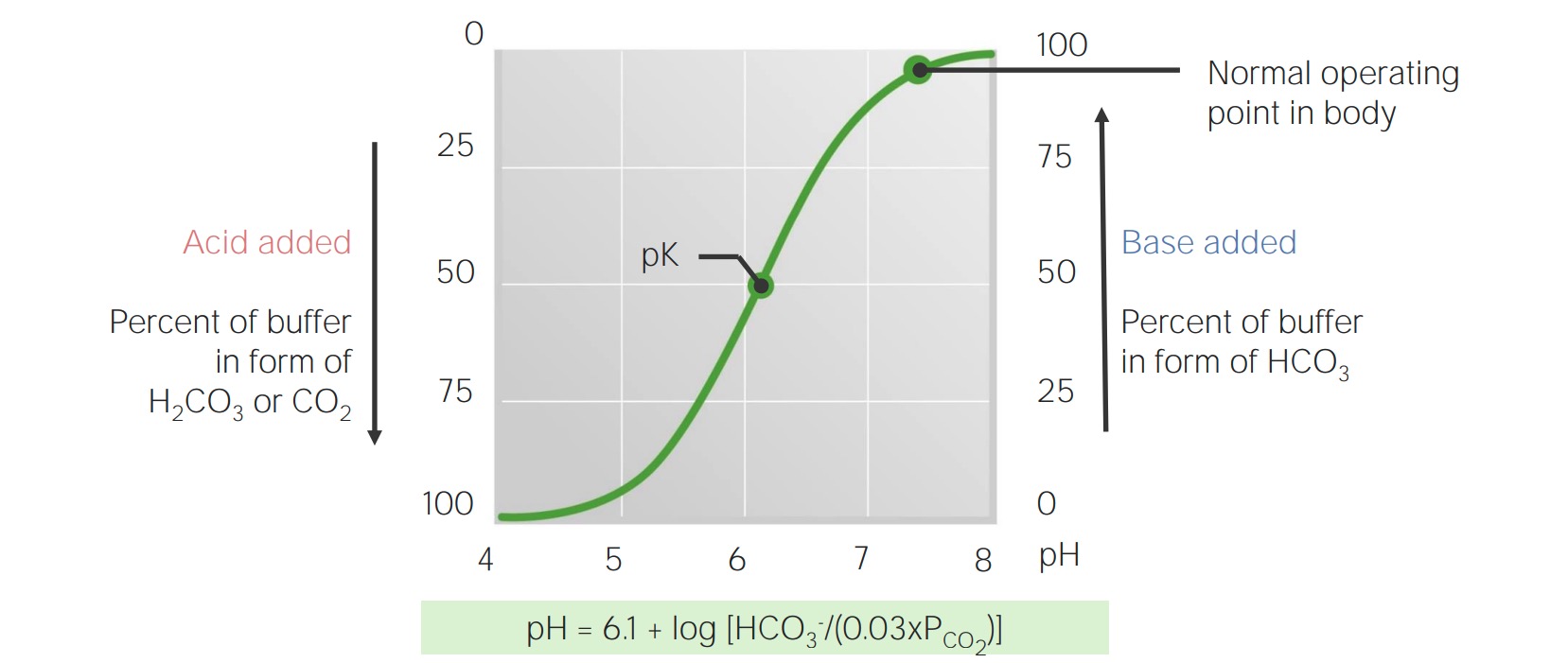
Curva de titulação de bicarbonato no sangue
Imagem por Lecturio.O corpo produz aproximadamente 15.000 mmol de ácidos voláteis e 70 mmol de ácidos não voláteis diariamente. Os pulmões e os rins trabalham em conjunto para eliminar esta carga ácida diária, o que impede que a capacidade de tamponamento do sangue esteja sobrecarregada, permitindo assim manter um pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance normal.
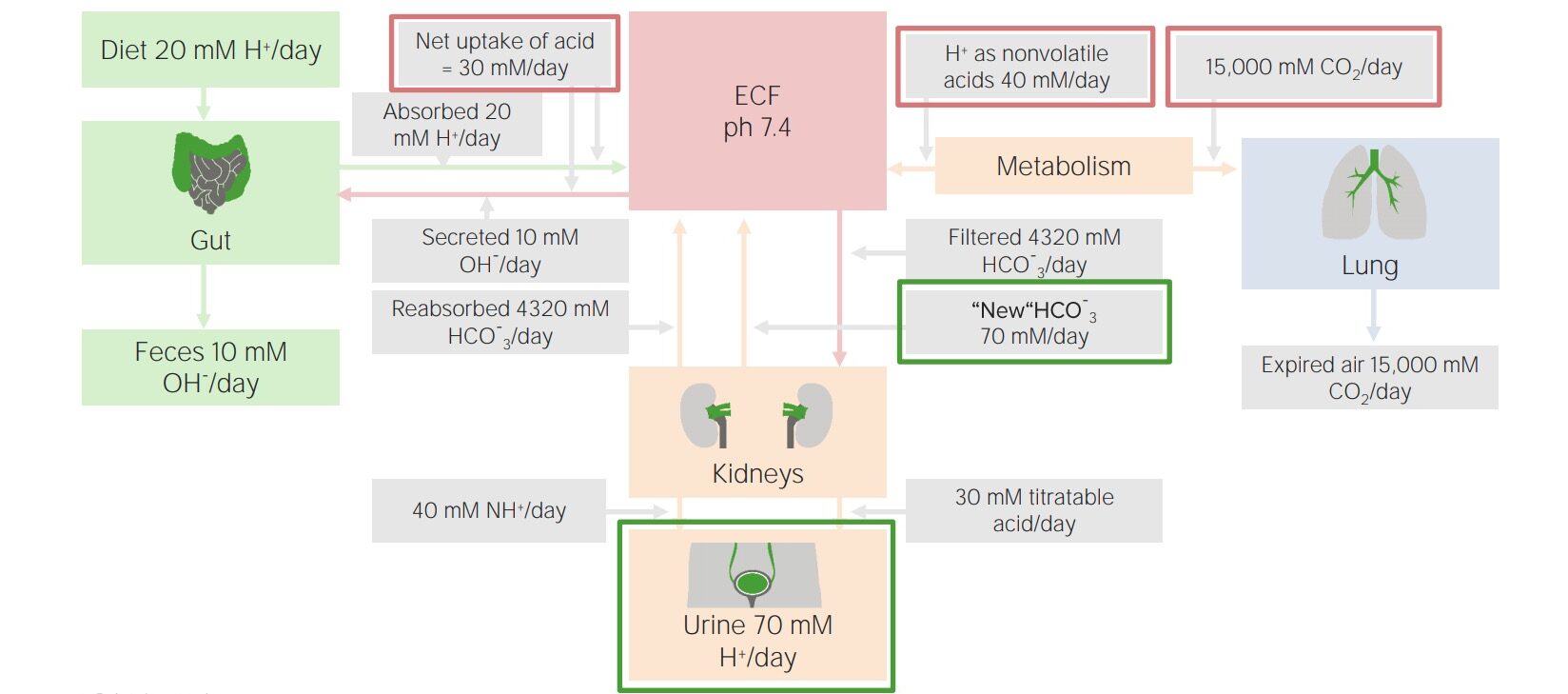
Fatores envolvidos no equilíbrio ácido-base diário
Imagem por Lecturio.Os rins são os principais responsáveis pela eliminação dos ácidos fixos (não voláteis), aproximadamente 70 mmol por dia. Evitam a excreção de bicarbonato e também combinam a excreção de ácido com a nova geração de bicarbonato para que o sistema tampão de bicarbonato esteja sempre disponível em plena capacidade.
O bicarbonato é filtrado livremente no glomérulo e 100% é então reabsorvido (80% no túbulo proximal) pelo seguinte processo:
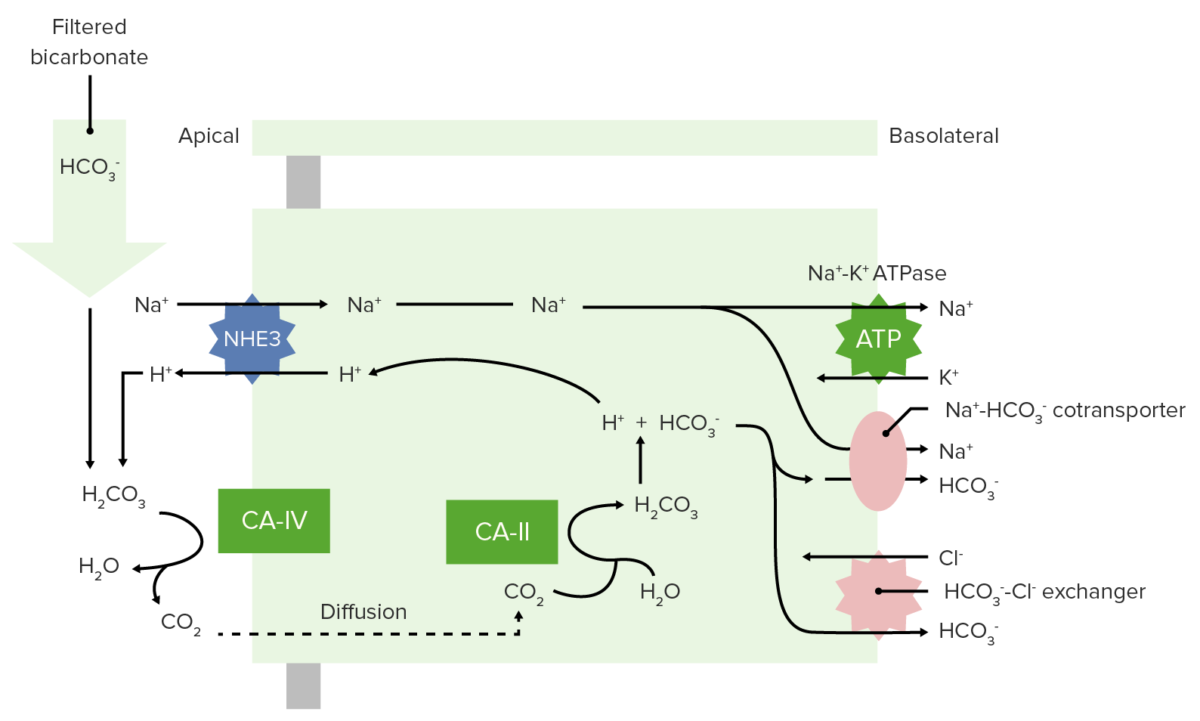
Reabsorção de bicarbonato no túbulo proximal
CA-IV: anidrase carbónica IV
CA-II: anidrase carbónica II
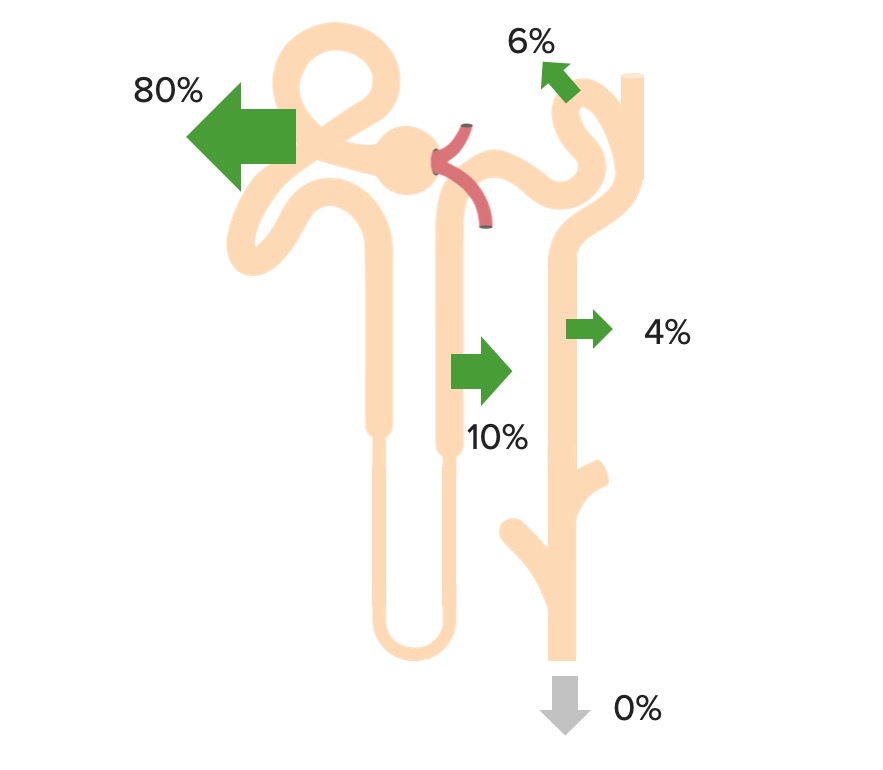
Reabsorção renal de HCO 3–
Imagem por Lecturio.NH3 é capaz de ajudar a excretar ácidos fixos.
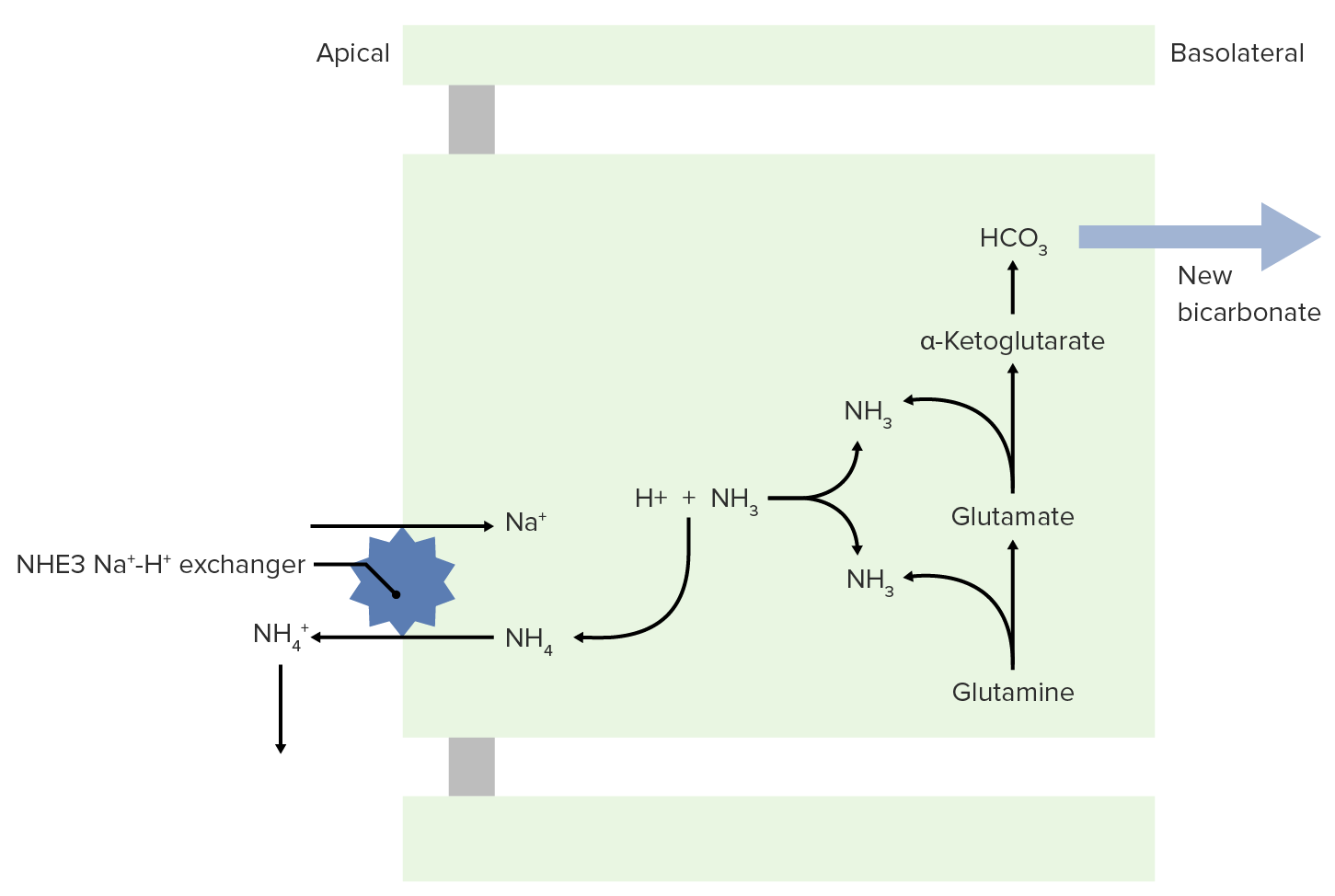
Transporte de NH 3 e NH 4+ para o lúmen para excreção
Imagem por Lecturio.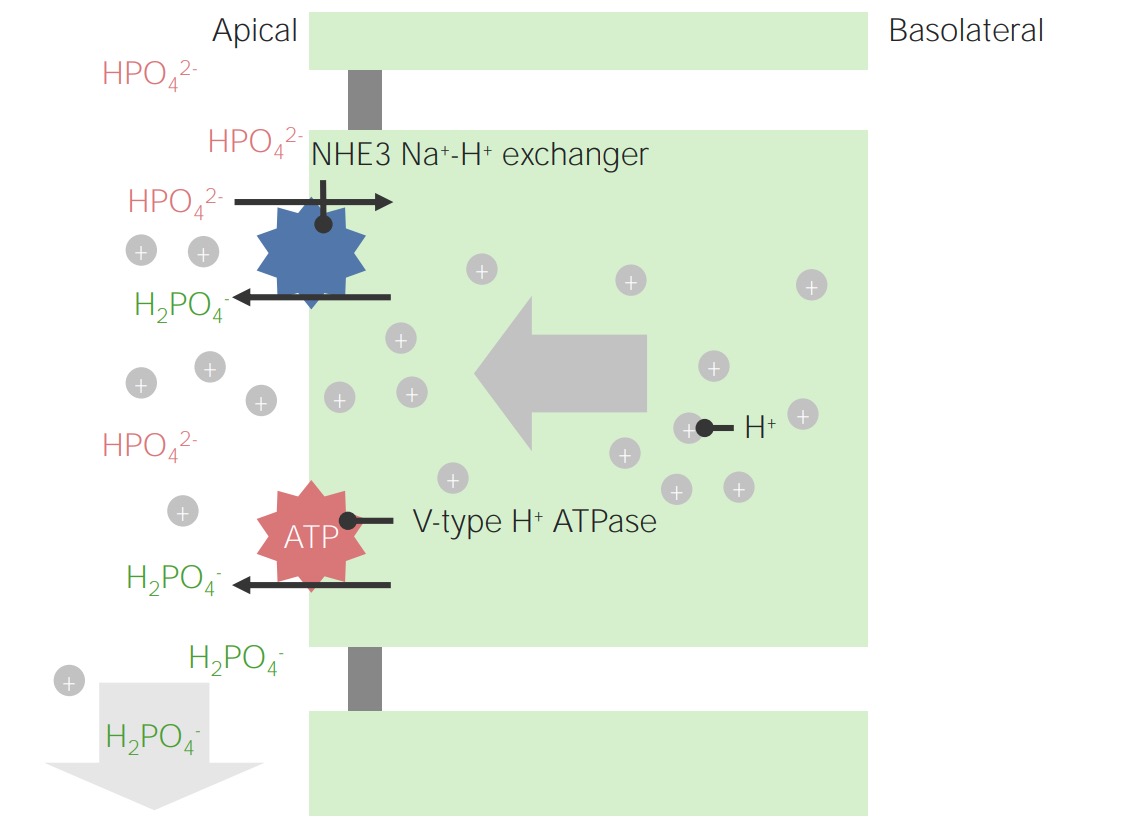
Exemplo de fosfato como um ácido titulável:
Observar que os iões H + intracelulares têm originem na dissociação de H 2 CO 3 . Este é também o mecanismo de regeneração do HCO 3– .
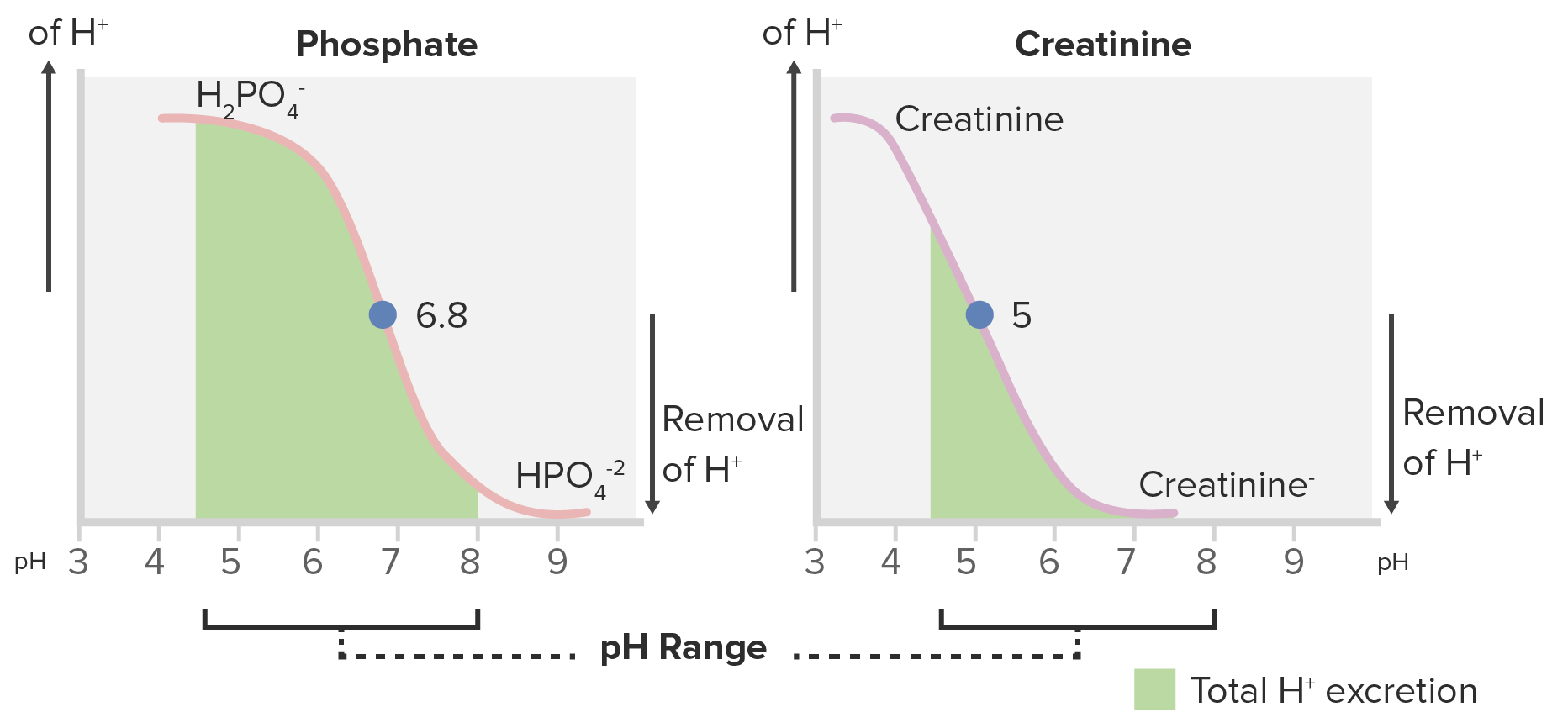
Curvas de titulação para fosfato e creatinina:
O fosfato é um ácido titulável melhor devido à sua maior área sob a curva dentro da faixa do pH normal da urina (4.5-8).
Quando um processo de doença supera a capacidade normal de regular Regular Insulin o pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance, ocorrem os principais distúrbios ácido-base listados abaixo. Também ocorrem mecanismos compensatórios, que ajudam a compensar a mudança no pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance.