Advertisement
Advertisement
Advertisement
Advertisement
El pH de la sangre está estrictamente regulado dentro del rango de 7,35–7,45 para garantizar funciones fisiológicas adecuadas. Cada día se generan grandes cantidades de ácido a través de procesos normales (respiración aeróbica/anaeróbica e ingesta dietética), y estos se manejan y eliminan de manera eficiente mediante amortiguadores en la sangre, el sistema respiratorio y el sistema renal. Cuando estos sistemas reguladores se alteran, se producen trastornos del equilibrio ácido-base, que incluyen acidosis respiratoria, alcalosis respiratoria, acidosis metabólica y alcalosis metabólica.
Última actualización: Ene 17, 2024
Advertisement
Advertisement
Advertisement
Advertisement
Advertisement
Advertisement
Advertisement
Advertisement
El pH es la medida cuantitativa de la acidez o basicidad de una solución.
| Compartimiento | pH |
|---|---|
| Secreciones gástricas (en condiciones de máxima acidez) | 0,7 |
| Lisosoma | 5,5 |
| Gránulos de cromafina | 5,5 |
| Neutro H2O a 37 ° C | 6,81 |
| Citosol de una célula típica | 6,0–7,4 |
| LCR | 7,3 |
| Plasma sanguíneo arterial | 7,35–7,45 |
| Matriz interna mitocondrial | 7,5 |
| Secreciones pancreáticas | 8,1 |
Las concentraciones relativas de ácidos y bases en la sangre determinan su pH. Los amortiguadores proporcionan una solución a corto plazo para las alteraciones de este equilibrio antes de que los pulmones y los riñones puedan actuar definitivamente para restablecer el equilibrio.
Los ácidos son compuestos que pueden donar protones (H+) o aceptar electrones.
Las bases son compuestos que pueden aceptar protones (H+) o donar electrones.
Los amortiguadores son sustancias que consumen o liberan iones de hidrógeno (H+) para estabilizar el pH.
| Gasometría arterial normal | Gasometría arterial ácida | Gasometría arterial alcalótica | |
|---|---|---|---|
| HCO 3– | 24 mEq/L | 26 mEq/L | 22 mEq/L |
| PaCO 2 | 40 mm Hg | 60 mm Hg | 20 mm Hg |
| pH | 7,40 | 7,26 | 7,66 |
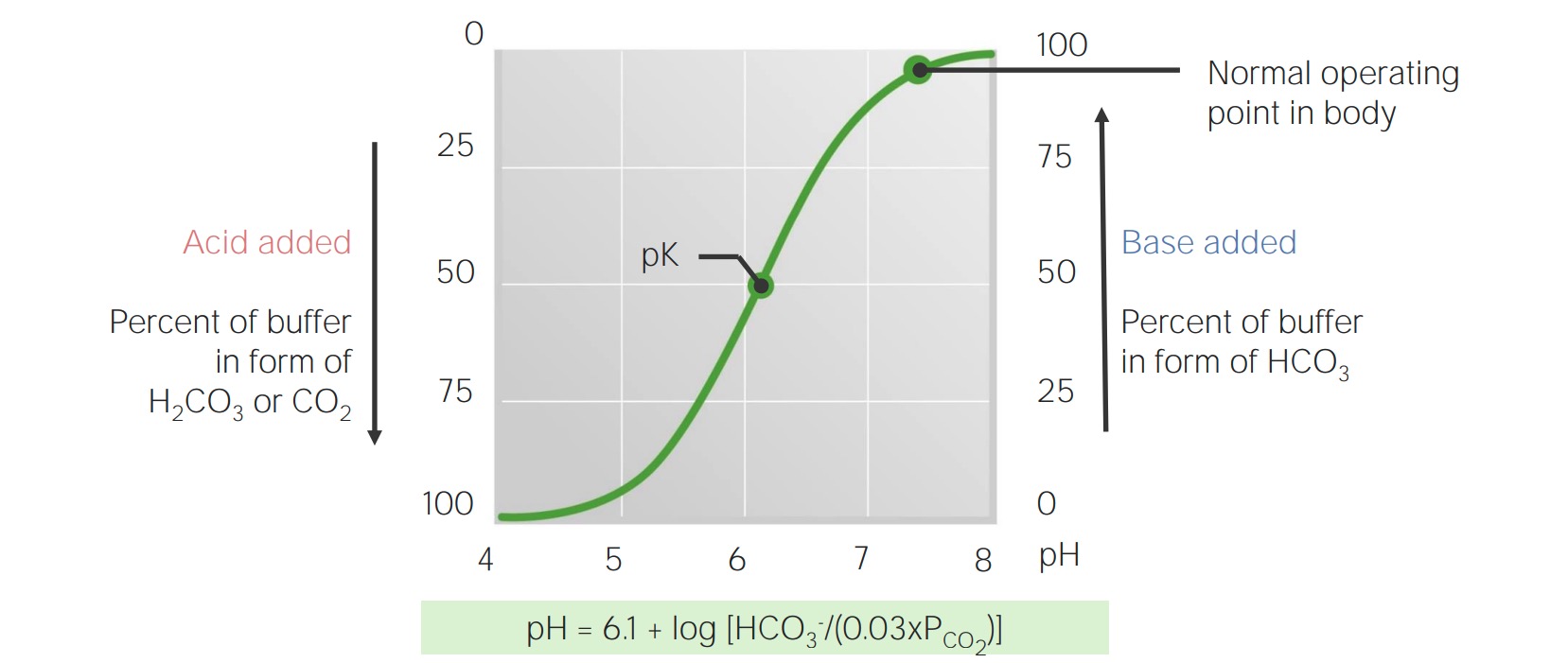
Curva de valoración del bicarbonato en sangre
Imagen por Lecturio.El cuerpo produce aproximadamente 15 000 mmol de ácidos volátiles y 70 mmol de ácidos no volátiles al día. Los pulmones y los riñones trabajan en conjunto para eliminar esta carga ácida diaria, lo que evita que la capacidad amortiguadora de la sangre se sobrepase y le permite mantener un pH normal.
Los riñones son los principales responsables de la eliminación de los ácidos fijos (no volátiles), aproximadamente 70 mmol al día. Previenen la excreción de bicarbonato y también combinan la excreción de ácido con la nueva generación de bicarbonato para que el sistema tampón de bicarbonato esté siempre disponible a plena capacidad.
El bicarbonato se filtra libremente en el glomérulo y luego se reabsorbe el 100% (80% en el túbulo proximal) a través del siguiente proceso:
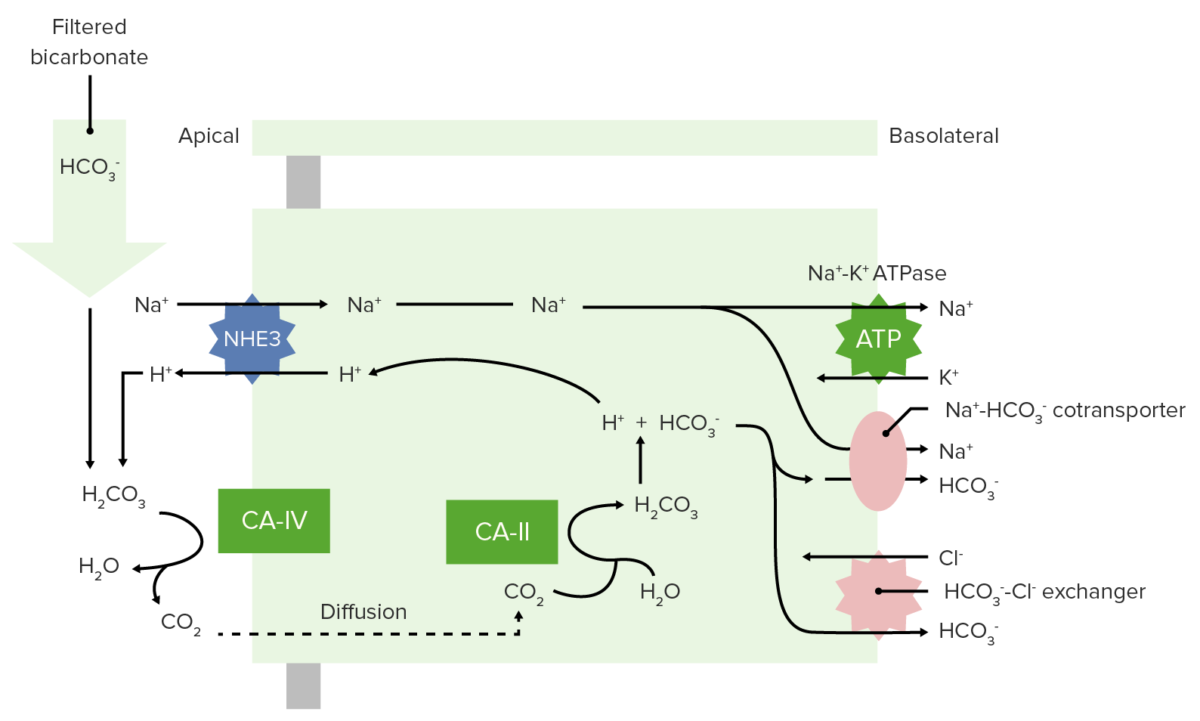
Reabsorción de bicarbonato en el túbulo proximal
CA-IV: anhidrasa carbónica IV
CA-II: anhidrasa carbónica II
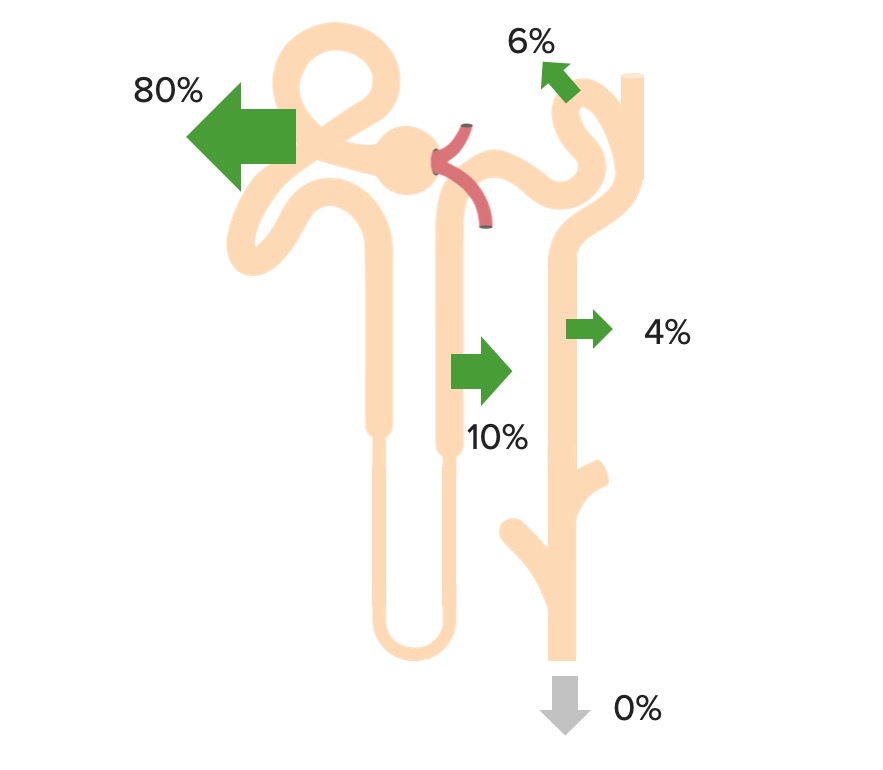
Reabsorción renal de HCO3–
Imagen por Lecturio.El NH3 puede ayudar a excretar ácidos fijos.
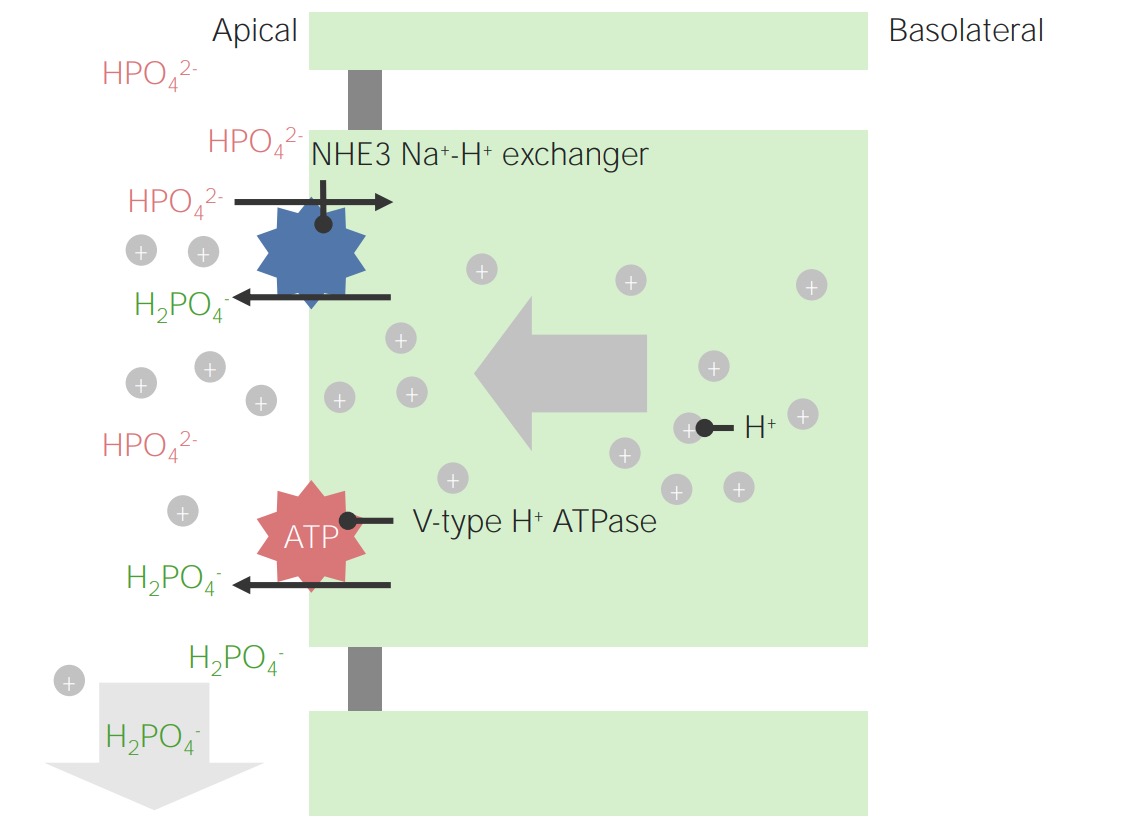
Ejemplo de fosfato como ácido titulable:
Tenga en cuenta que los iones de H+ intracelulares se originan a partir de la disociación de H2CO3. Este es también el mecanismo para la regeneración de HCO3–.
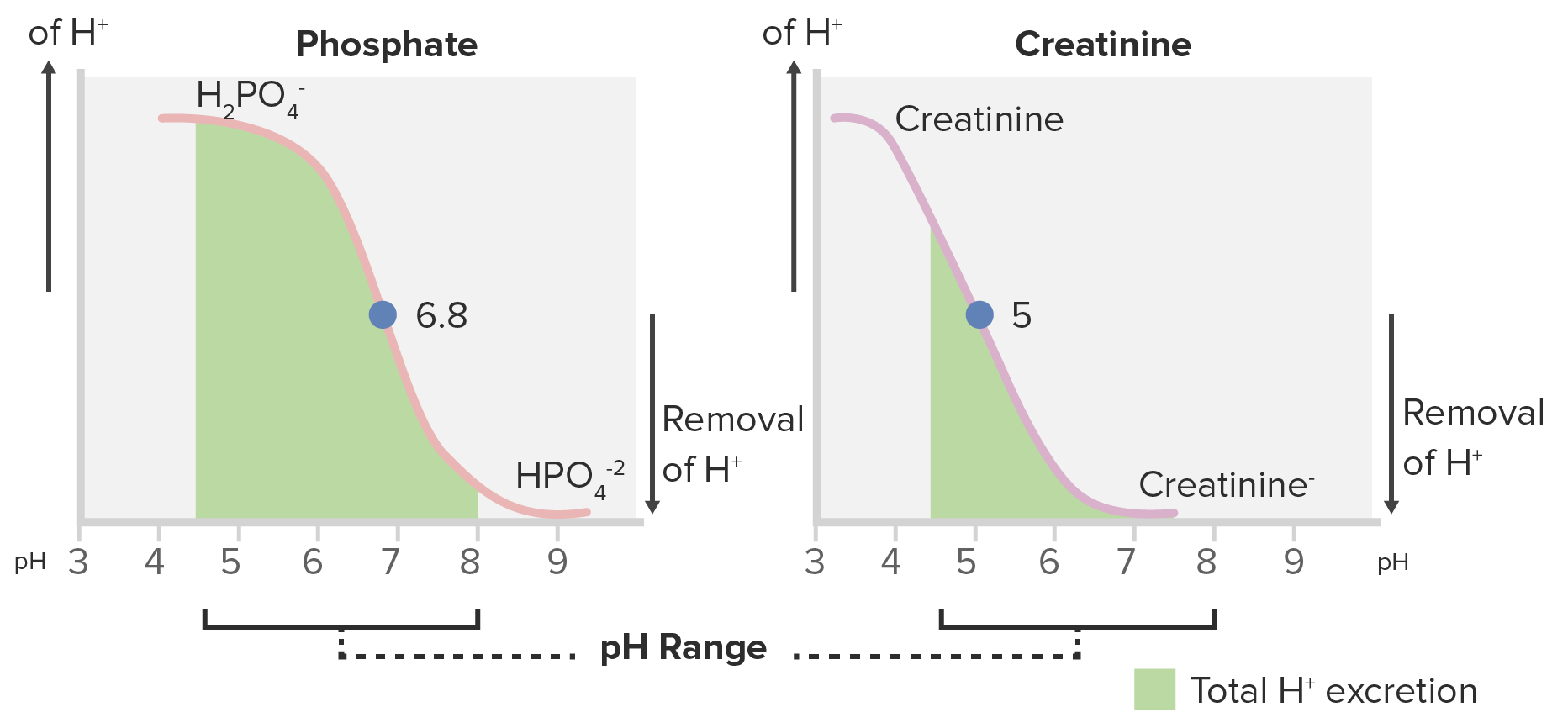
Curvas de titulación para fosfato y creatinina:
El fosfato es un ácido mejor valorable debido a su mayor área bajo la curva dentro del rango del pH normal de la orina (4,5–8).
Cuando un proceso patológico sobrepasa la capacidad normal de regular el pH, se producen los trastornos ácido-base primarios que se enumeran a continuación. También se producen mecanismos compensatorios que ayudan a compensar el cambio de pH.