O processamento de proteínas pós-tradução (incluindo modificação pós-tradução) é o enrolamento, triagem, clivagem e modificações necessárias para tornar uma proteína funcional após a sua tradução. À medida que a proteína se enrola, forma complexas estruturas secundárias, terciárias e quaternárias. Além disso, novos grupos ou moléculas funcionais podem ser adicionados à cadeia polipeptídica, incluindo grupos fosforil, metil ou acetil; carboidratos; e lípidos. As proteínas também têm de ser triadas para o seu compartimento intracelular correto para desempenhar a sua função, devem ser embaladas para secreção ou ser inseridas na membrana celular apropriada.
Última atualização: Apr 17, 2025
Os aminoácidos são os blocos de construção das proteínas. A compreensão dos princípios básicos dos aminoácidos permite uma compreensão mais abrangente do enrolamento e da modificação de proteínas.
Os aminoácidos que compõem as proteínas são conhecidos como α-aminoácidos. Cada um destes aminoácidos tem um carbono central conhecido como “carbono alfa”, que faz 4 ligações:
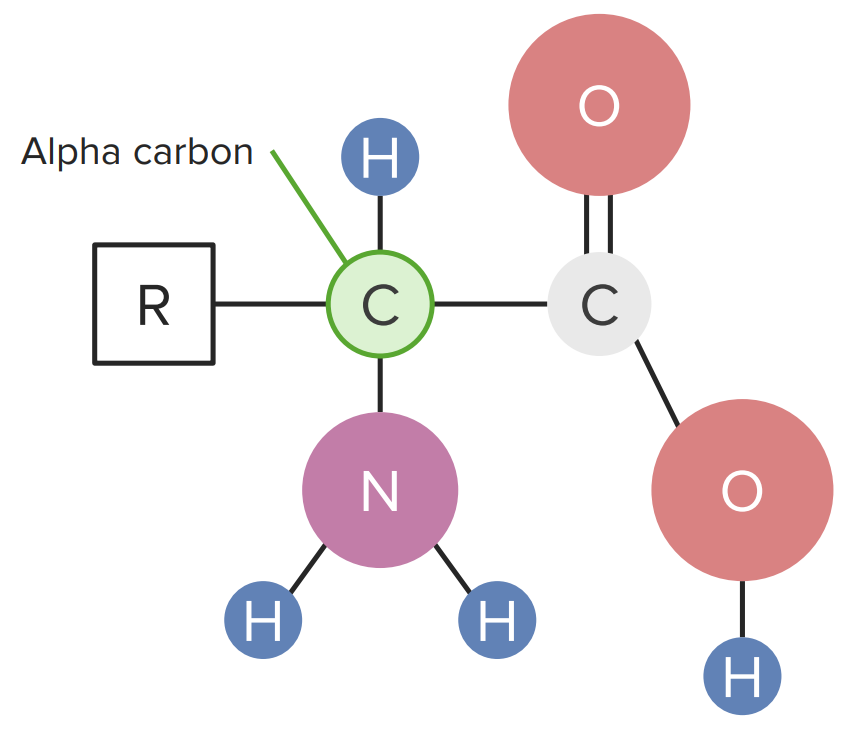
Diagrama de um aminoácido
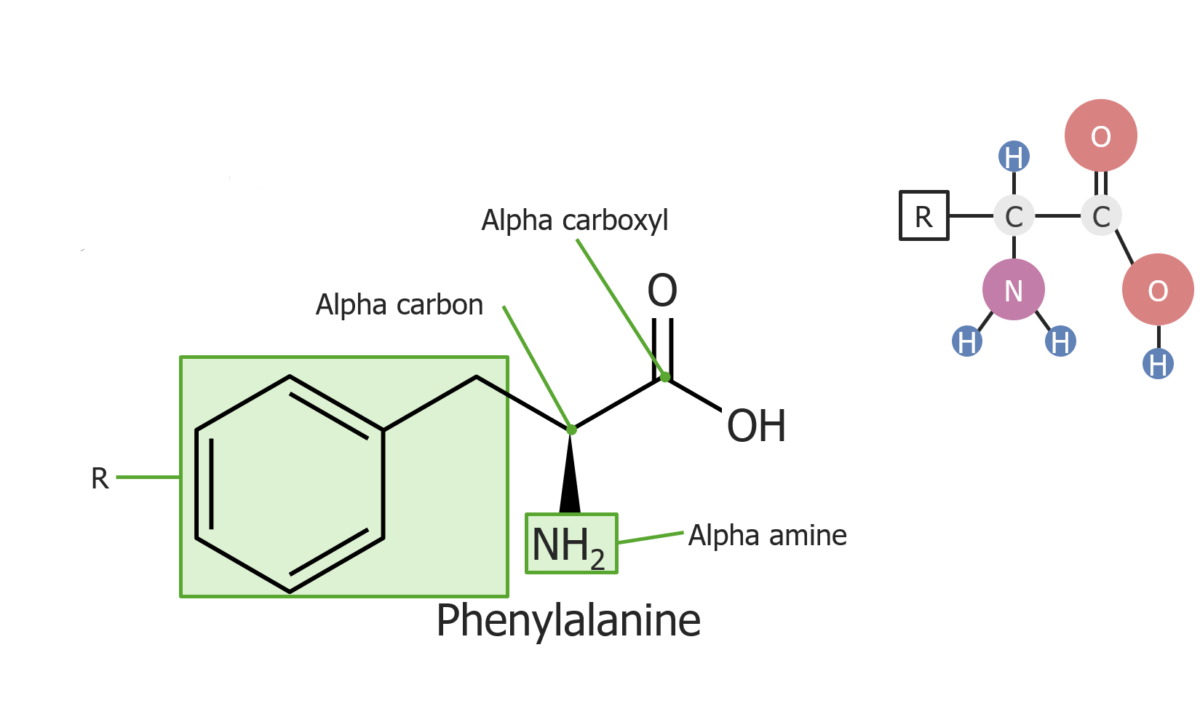
Exemplo do aminoácido fenilalanina
Os aminoácidos podem ser categorizados pelas características dos seus grupos R, que podem ser:

Classificação de aminoácidos por grupo R
Image by Lecturio.A estrutura proteica, que é frequentemente referida como enrolamento de proteínas, tem 4 níveis. Estes níveis são:
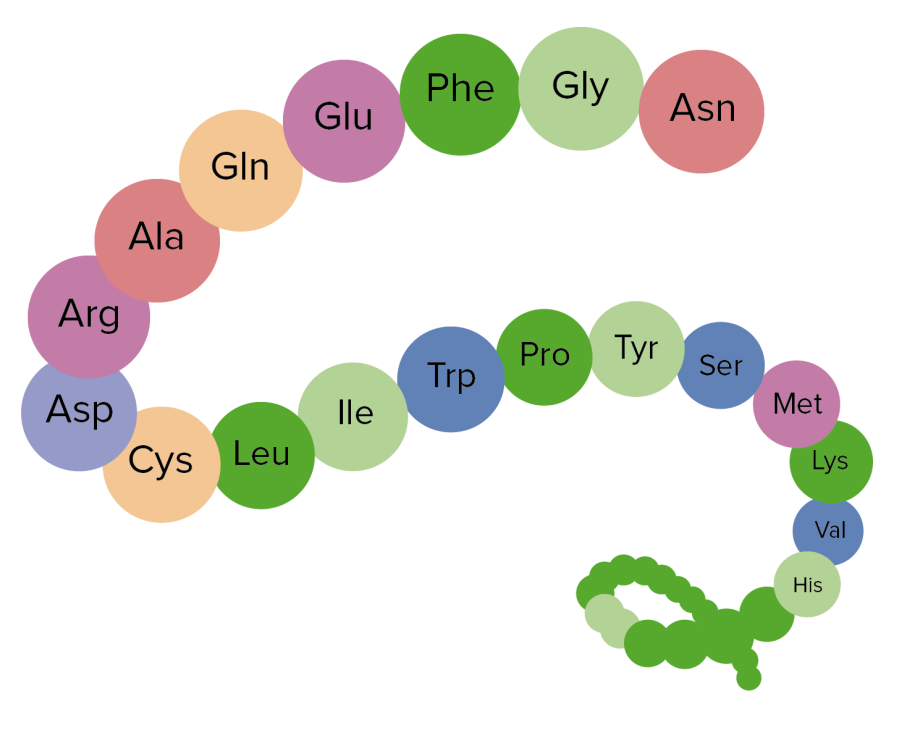
Exemplo da estrutura primária de uma proteína
Image by Lecturio.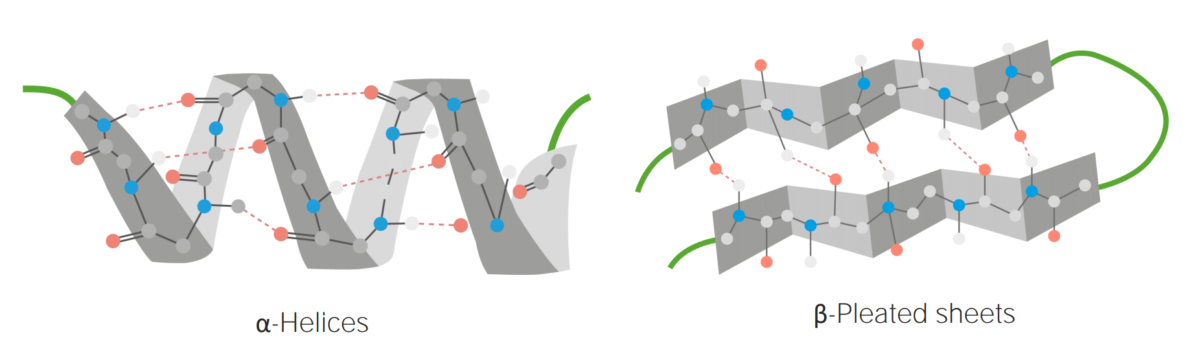
Exemplos de hélices α e folhas β em pregas
Imagem de Lecturio.A estrutura terciária é o enrolamento e os laços complexos que ocorrem como resultado de interações e ligação entre porções da proteína que estão mais distantes. Exemplos de interações que criam estrutura terciária incluem:
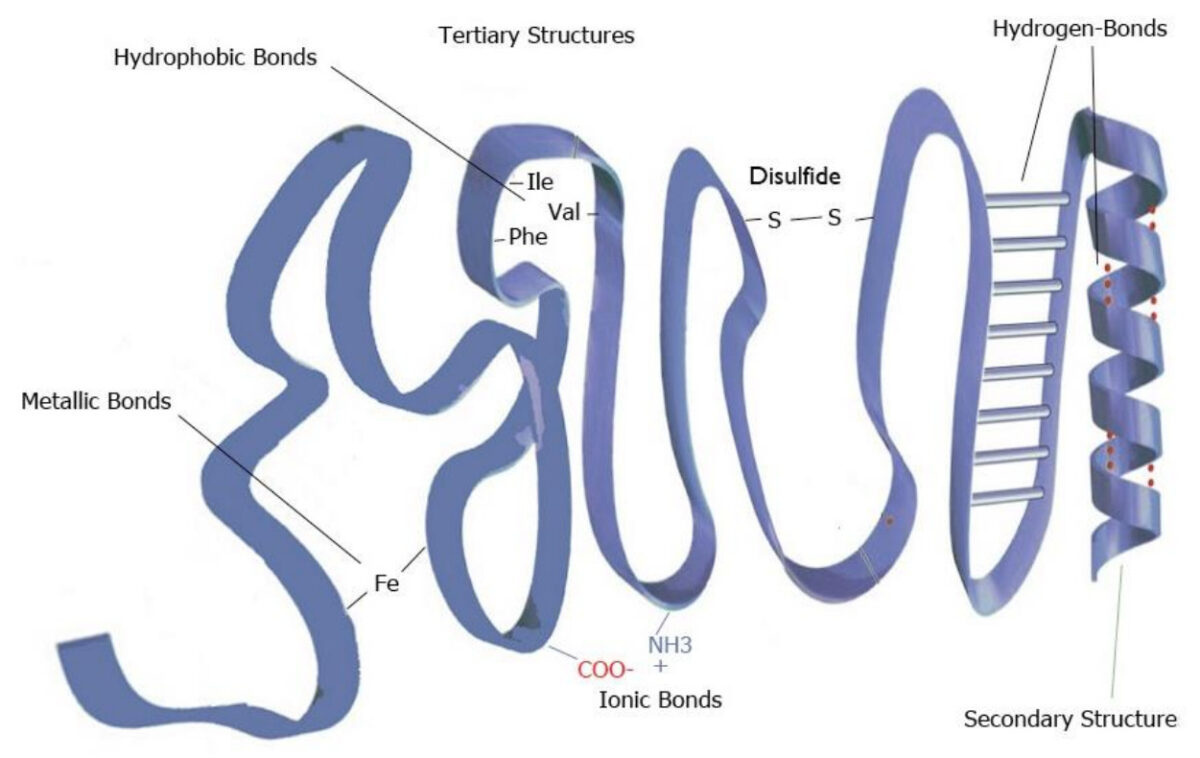
Exemplo de estrutura terciária
Image by Lecturio.Numa estrutura quaternária, várias subunidades de uma proteína juntam-se para formar uma única proteína.
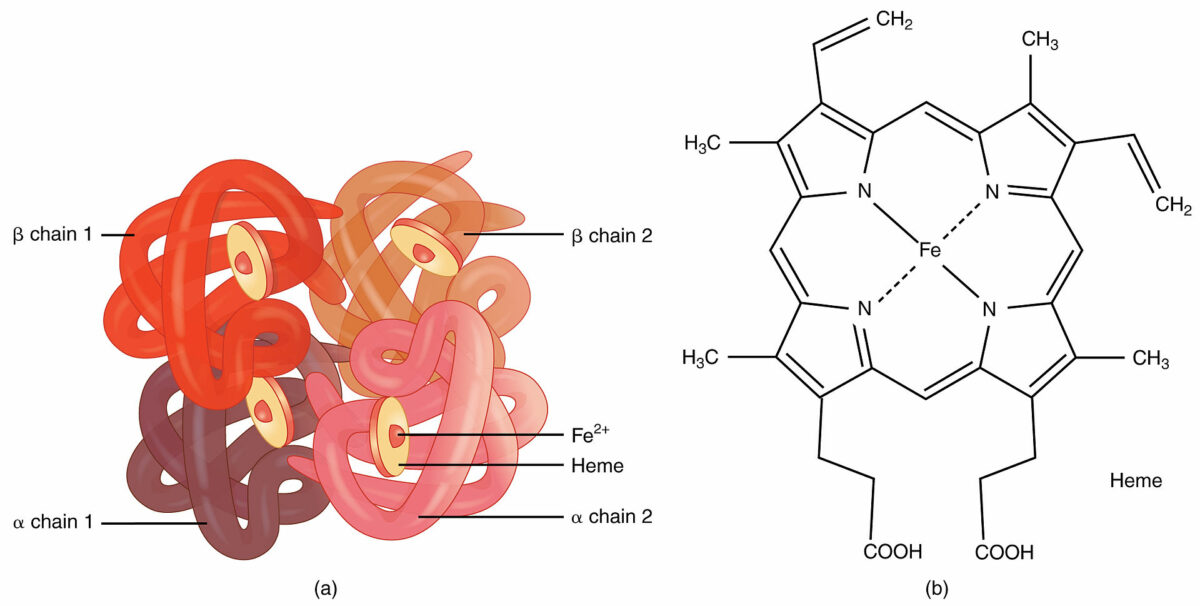
Hemoglobina:
Um exemplo de estrutura quaternária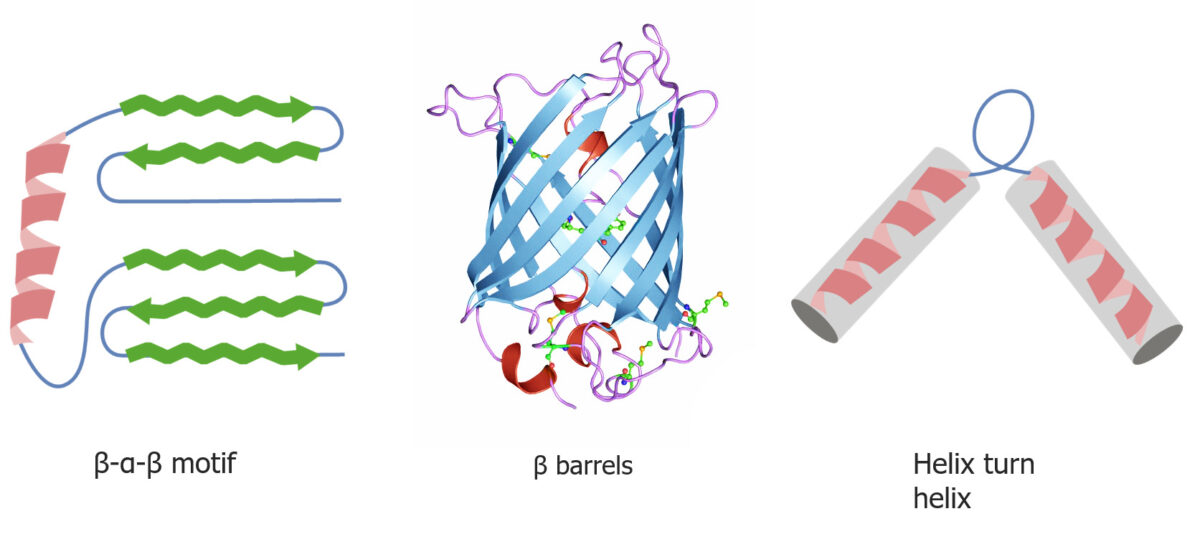
Motivos de enrolamento proteicos quaternários e terciários
As proteínas chaperonas ajudam no enrolamento proteico.
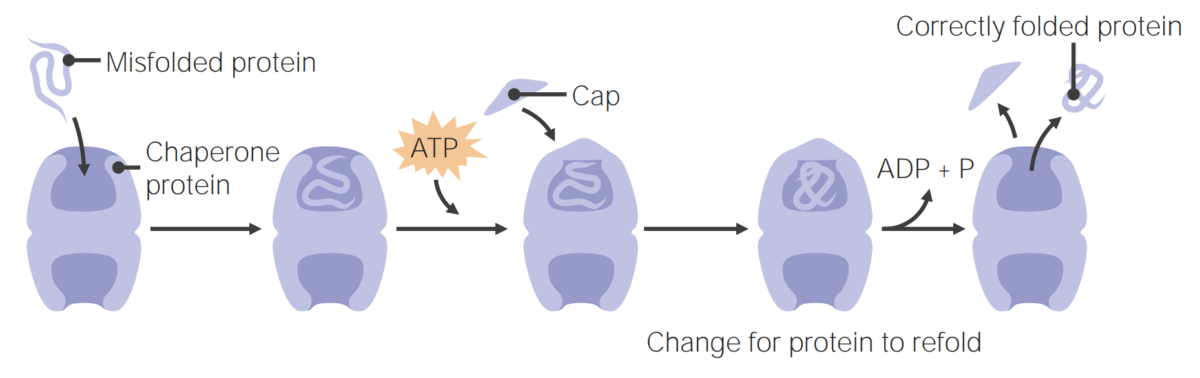
As proteínas chaperonas ajudam no enrolamento das proteínas
Image by Lecturio.Uma proteína desnaturada é uma proteína que foi desenrolada e já não está funcional. Este desenrolamento ocorre sob certas condições, que incluem alterações em:
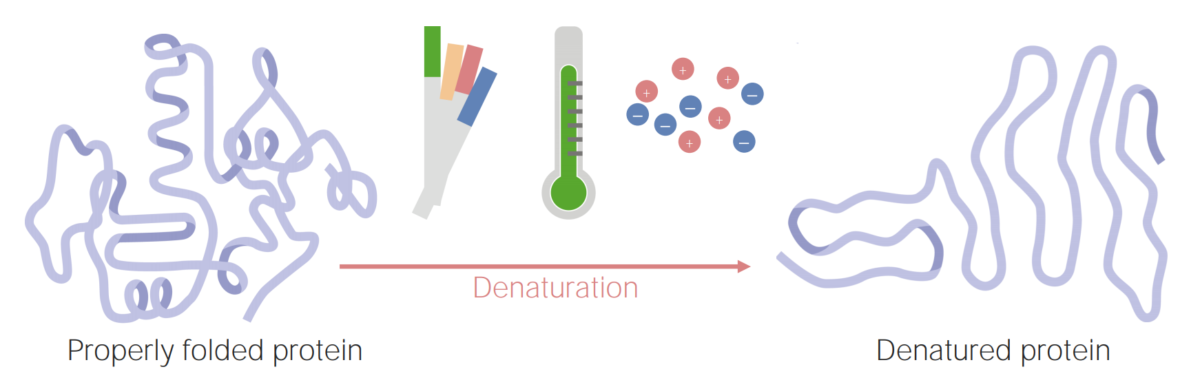
As proteínas podem se desnaturar (ou desenrolar) como resultado de mudanças no pH, na temperatura ou na concentração iónica.
Image by Lecturio.As proteínas precisam ser triadas e acabarão a permanecer na célula, sendo colocadas na parede da célula ou exportadas/secretadas.
As proteínas destinadas à superfície celular e/ou secreção celular são sintetizadas no retículo endoplasmático rugoso (RER):
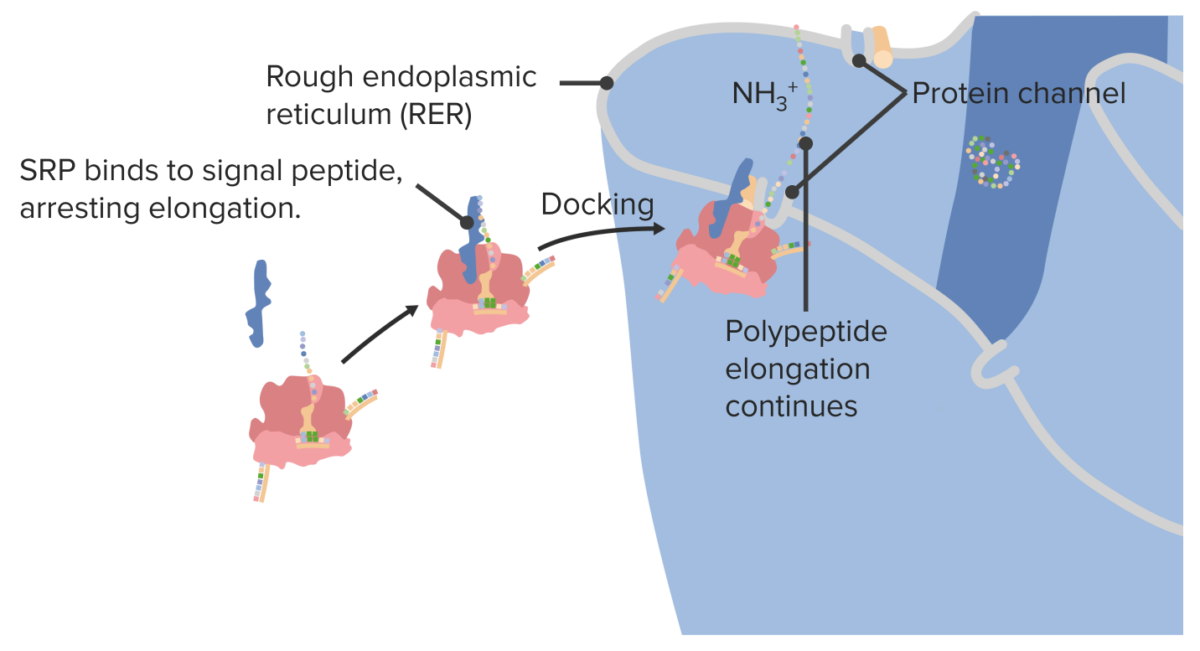
Acoplagem de um ribossoma no retículo endoplasmático rugoso
SRP: proteína de reconhecimento de sinal
Um polipéptido, após ser sintetizado, sofre novas modificações de modo a formar uma proteína funcional. Esta modificação pode incluir o corte de porções da cadeia de polipeptídica ou a adição de um grupo funcional.
A clivagem de proteínas é o processo de remoção de certos polipéptidos para que a proteína se torne funcional.
As proteínas são ainda modificadas pela adição covalente de grupos funcionais e outras moléculas.
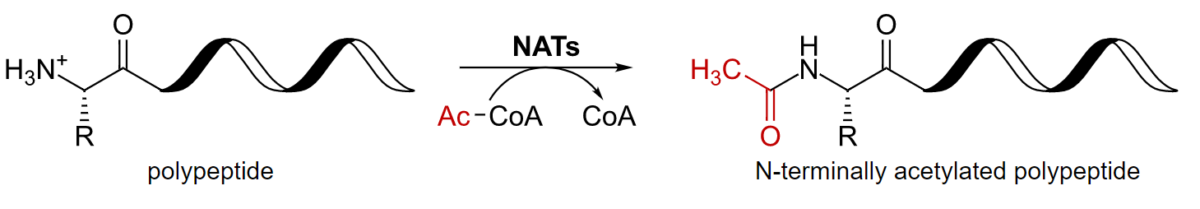
Acetilação de um polipéptido
CoA: coenzima A
NAT: N-terminal acetiltransferases
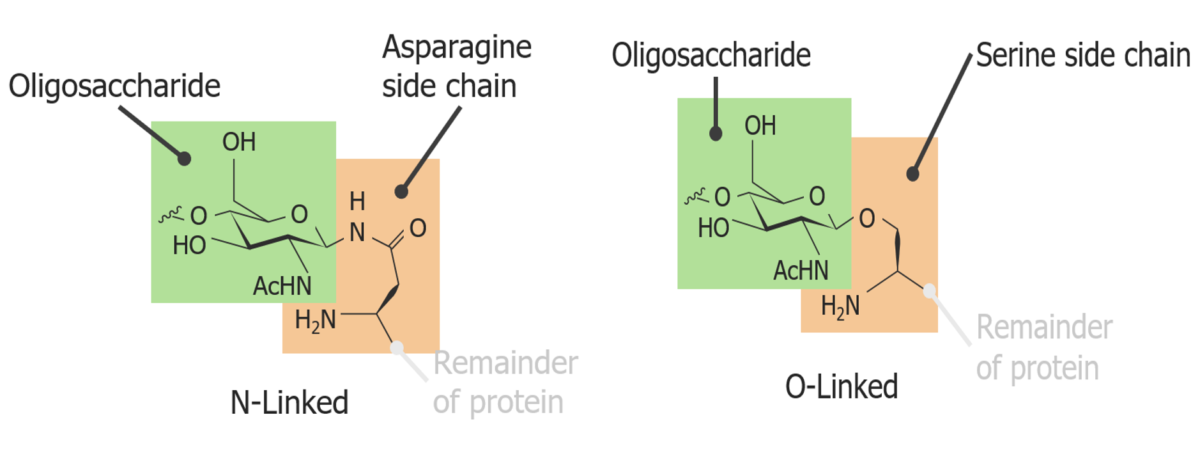
Uma glicoproteína ligada a um N versus uma glicoproteína ligada a um O
Image by Lecturio.Anormalidades na modificação pós-tradução e/ou no enrolamento ou triagem de proteínas podem levar a uma série de patologias médicas relevantes.