O glicogénio é um polímero ramificado e a forma de armazenamento de hidratos de carbono no corpo humano. Os principais locais de armazenamento são o fígado e o músculo esquelético. O glicogénio é a principal fonte de energia durante o jejum ou entre as refeições. O glicogénio fornece energia por até 18 horas, após as quais as necessidades de energia são cumpridas pela oxidação dos ácidos gordos. As 2 vias metabólicas do glicogénio são a glicogénese (síntese de glicogénio) e a glicogenólise (quebra de glicogénio). As principais enzimas regulatórias nesses processos são a glicogénio sintase (na glicogénese) e a glicogénio fosforilase (na glicogenólise). Estas vias ocorrem em função das necessidades energéticas das células, geralmente moduladas por reguladores hormonais e alostéricos. A acumulação anormal de glicogénio ocorre com deficiências enzimáticas, o que causa diferentes tipos de perturbações de armazenamento de glicogénio.
Última atualização: Apr 25, 2025
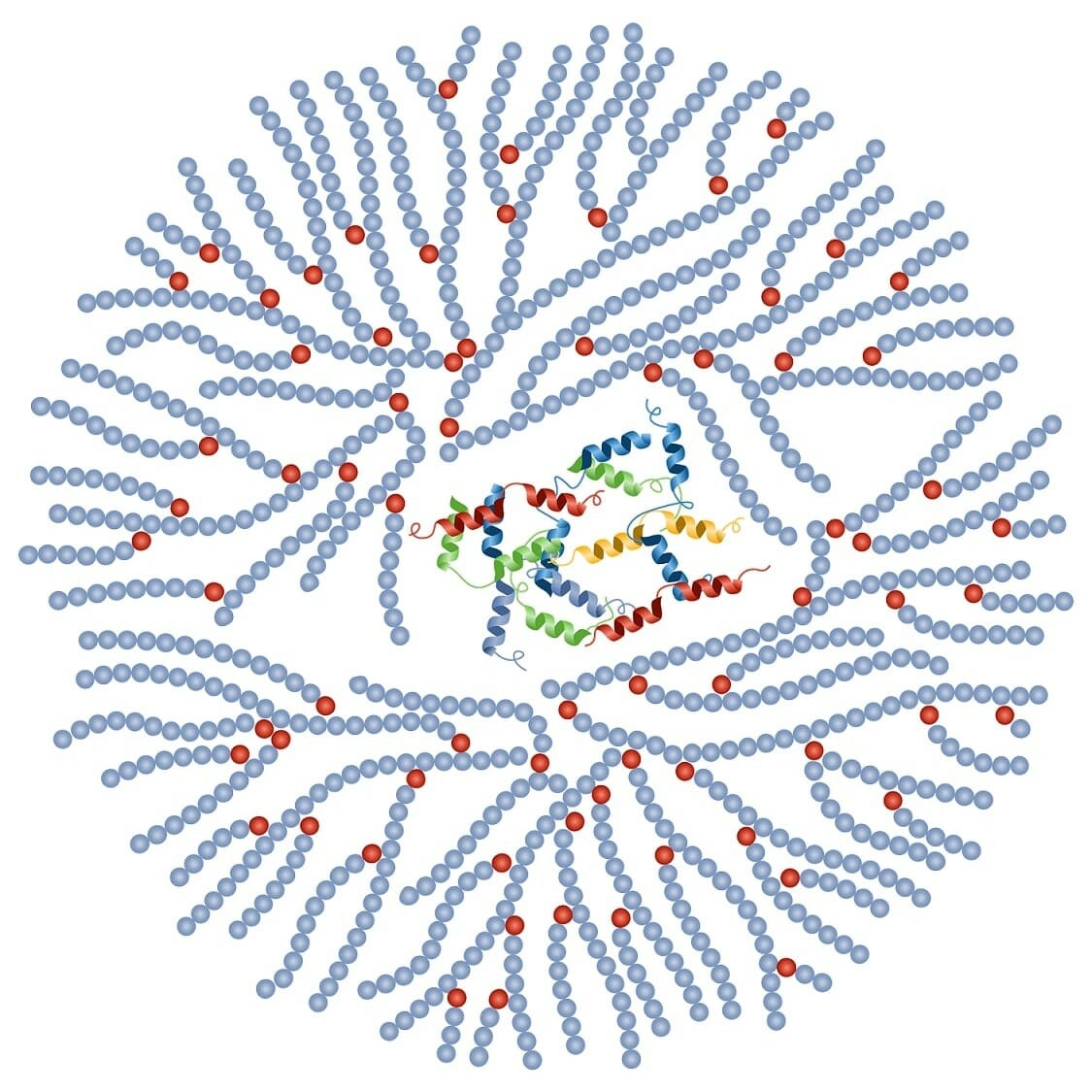
Estrutura do glicogénio:
O glicogénio consiste numa proteína central e está rodeado por 30.000–50.000 unidades de glucose.
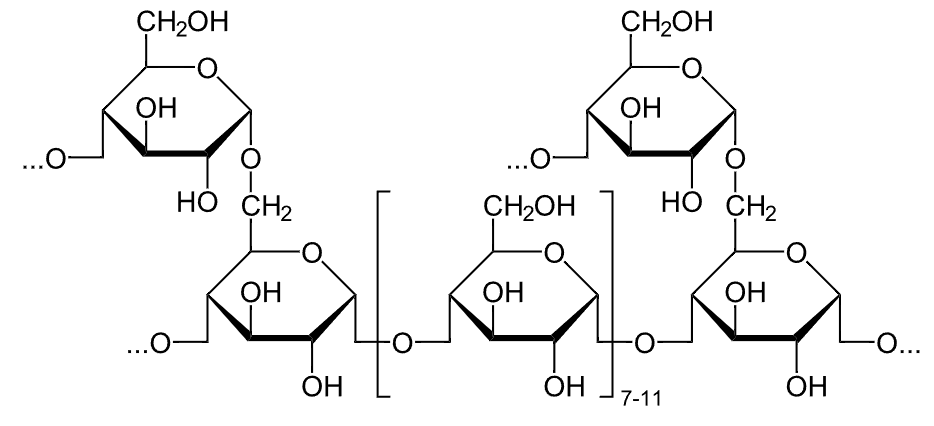
Estrutura química do glicogénio
Imagem: “Glykogen” por NEUROtiker. Licença: Public Domain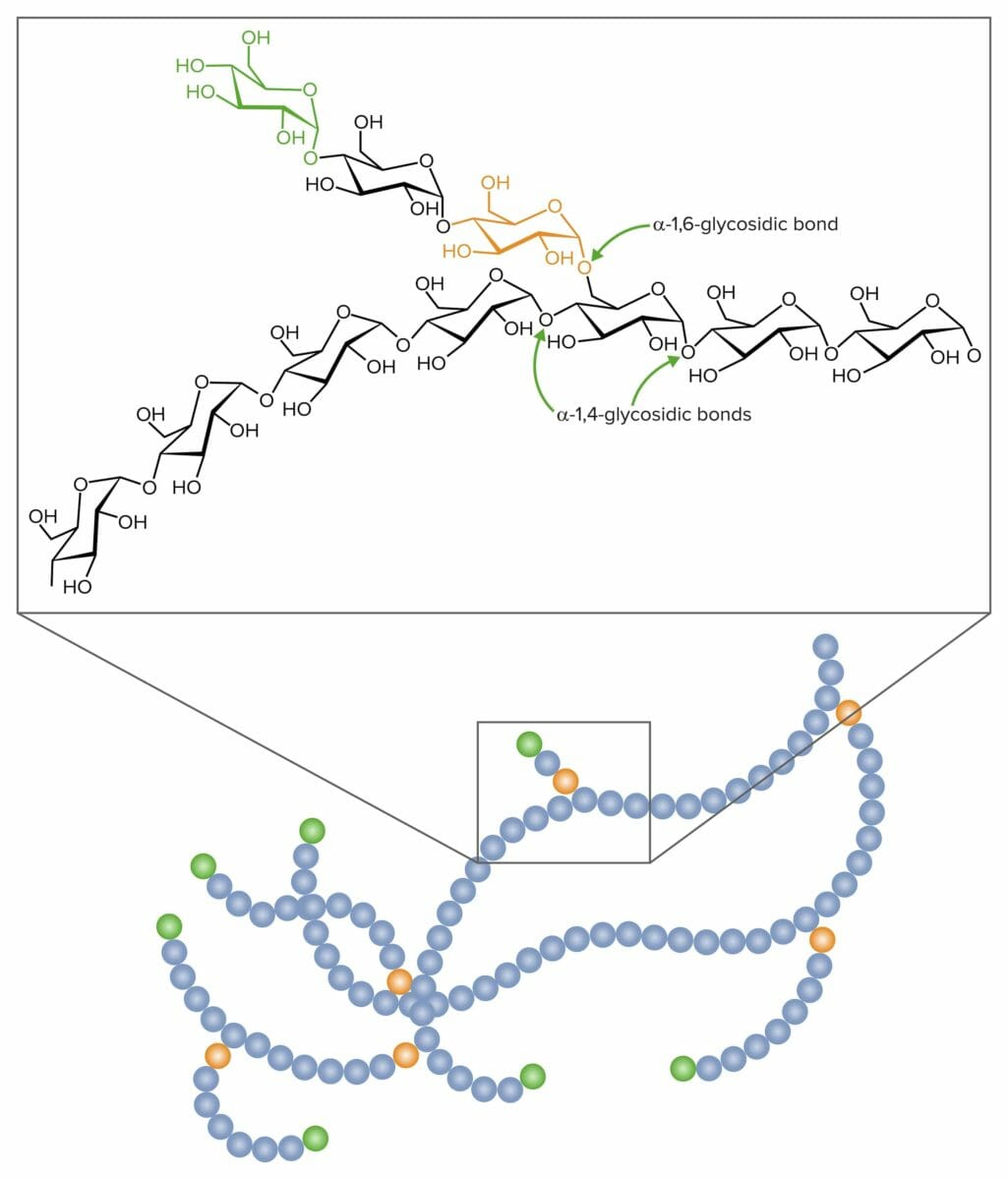
Ligações glicosídicas na formação do glicogénio:
Ligações glicosídicas alfa-1,4 e alfa-1,6
Existem 2 principais vias metabólicas do glicogénio:
Isomerização de glucose-6-fosfato em glucose-1-fosfato
Reação de glucose-1-fosfato com uridina trifosfato (UTP) para formar uma forma ativada de glucose:
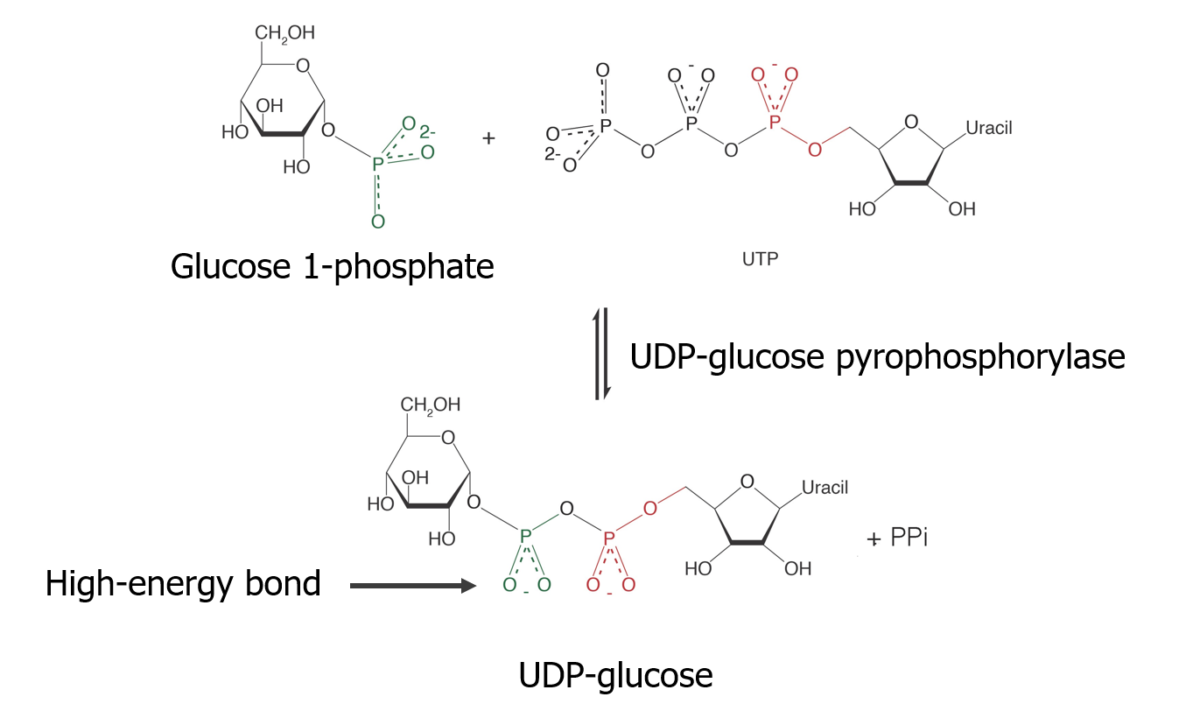
Síntese de glicogénio — Fazendo o substrato:
Formação de UDP-glicose, que está numa forma ativa na glicogénese
Formação da ligação glicosídica
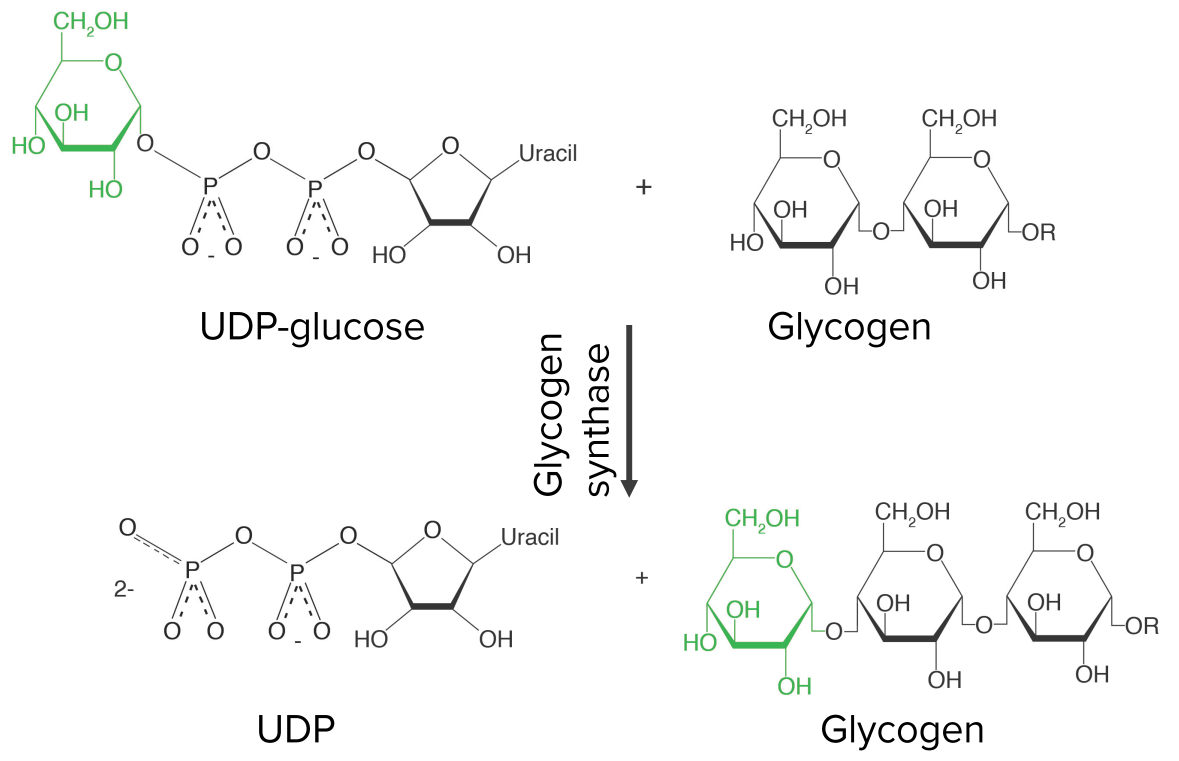
Crescimento da cadeia de glicogénio — etapa 3 da glicogénese:
A uridina difosfato glucose (UDP-glicose) é ligada ao grupo hidroxilo de uma cadeia de glicogénio já existente, libertando UDP no processo. A reação é catalisada pela glicogénio sintase, a principal enzima reguladora da glicogénese.
Ramificação do glicogénio:
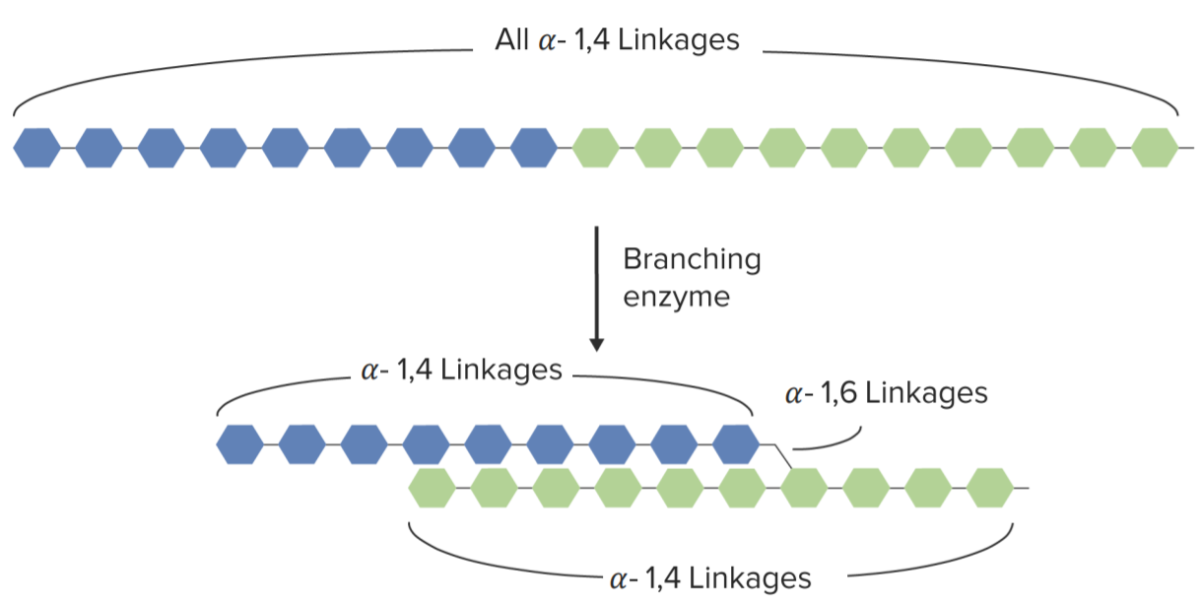
Ramificação da cadeia de glicogénio mediada pela enzima de ramificação
Imagem por Lecturio.Quebra de glicogénio para libertar energia entre as refeições ou após o esgotamento da glucose
Quebra de glicogénio em glucose-1-fosfato:
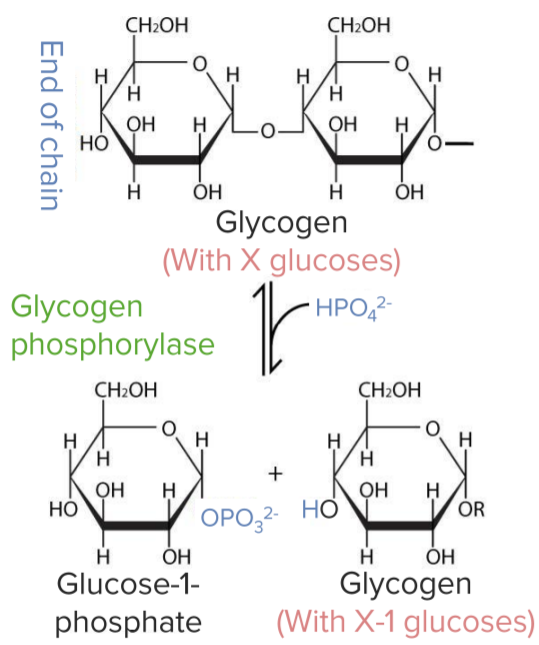
Quebra de glicogénio:
Conversão de glicogénio em glucose-1-fosfato pela enzima glicogénio fosforilase
Remoção de ligações glicosídicas alfa-1,6 (ramificações):
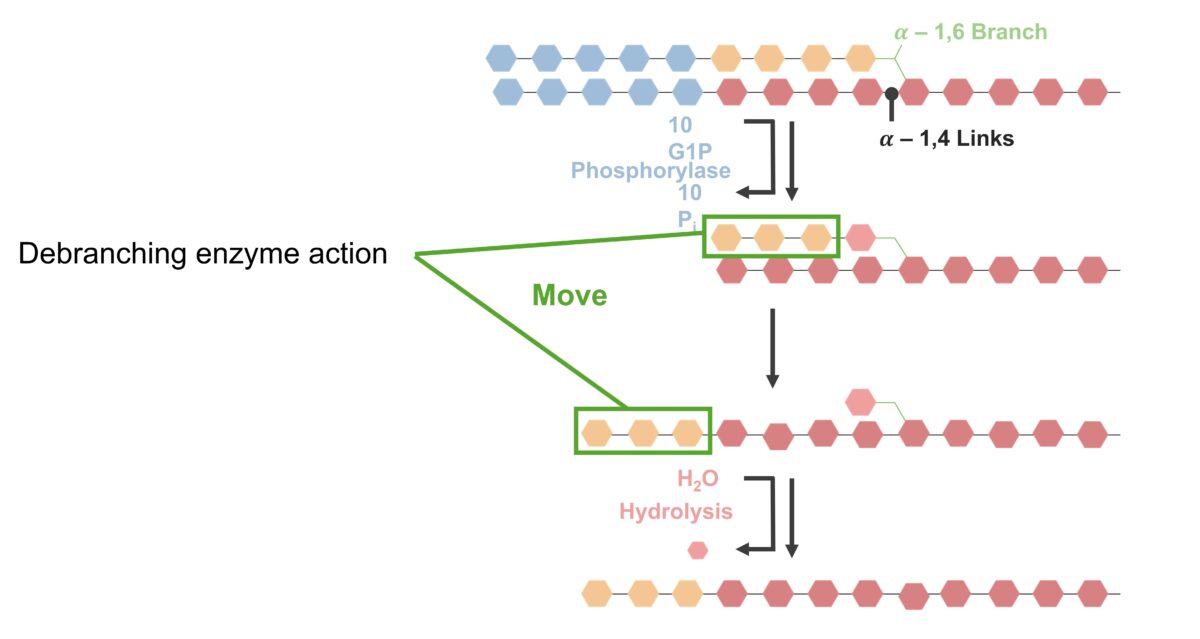
Glicogenólise (quebra de ligações e desramificação):
As ligações alfa-1,4-glicosídicas são quebradas na extremidade terminal, catalisadas pela fosforilase. As ligações entre os resíduos de glucose (azul) são hidrolisadas, libertando glucose-1-fosfato. A fosforilase hidrolisa as ligações alfa-1,4-glicosídicas até que apenas 4 resíduos de glucose (laranja) sobrem antes da ramificação alfa-1,6. A enzima desramificadora (com atividade de transferase e glicosidase) atua sobre os restantes resíduos ligados. Três dos 4 resíduos de glucose (laranja) são removidos, deixando 1 molécula. A cadeia da molécula de 3-glucose (da ramificação) é reconectada à extremidade não redutora da cadeia linear, catalisada pela glucano transferase. A única molécula restante (na ramificação) é removida pela alfa-1,6 glucosidase por hidrólise, libertando a glucose-1-fosfato. O processo de fosforilase / desramificação repete-se para gerar glucose-1-fosfato para uso de energia.
Conversão da glucose-1-fosfato libertada em glucose-6-fosfato:
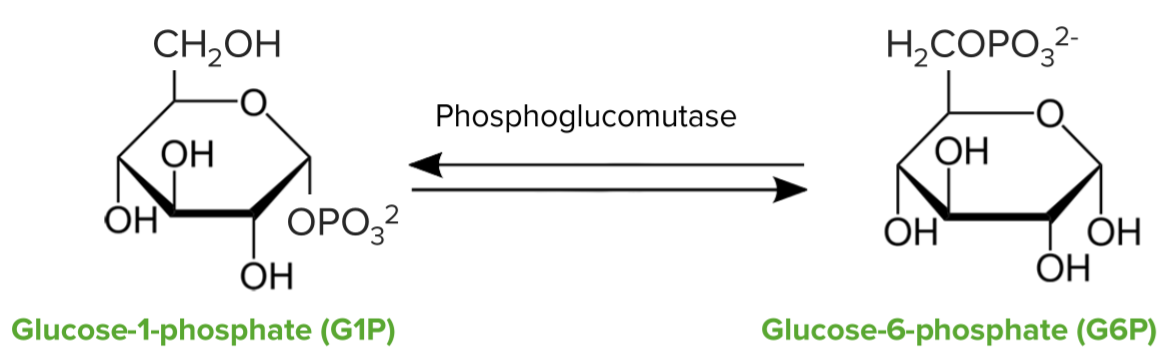
Quebra de glicogénio—glicogénio fosforilase:
Conversão de glucose-1-fosfato em glucose-6-fosfato pela enzima fosfoglucomutase
O glucagon e a epinefrina ativam a adenilato ciclase na membrana celular através de proteínas G.
| Hormona | Glicogénese | Glicogenólise | Glucose no Soro |
|---|---|---|---|
| Insulina | Ativação | Inibição | Diminui |
| Glucagon | Inibição | Ativação | Aumenta |
| Epinefrina | Inibição | Ativação | Aumenta |
| Efetores | Glicogenólise | Glicogénese |
|---|---|---|
| cAMP | ↑ | ↓ |
| PK | ↑ | ↓ |
| AMP (músculo) | ↑ | ↓ |
| Cálcio/contração muscular | ↑ | ↓ |
| Hormonas | Glicogenólise | Glicogénese |
|---|---|---|
| Insulina | ↓ | ↑ |
| Glucagon | ↑ | ↓ |
| Epinefrina | ↑ | ↓ |
| Enzima Reguladora | Glicogenólise | Glicogénese |
|---|---|---|
| Glicogénio sintase | Ativada (a enzima é fosforilada) | Inativada |
| Glicogénio sintase | Inativada | Ativada (a enzima é desfosforilada) |
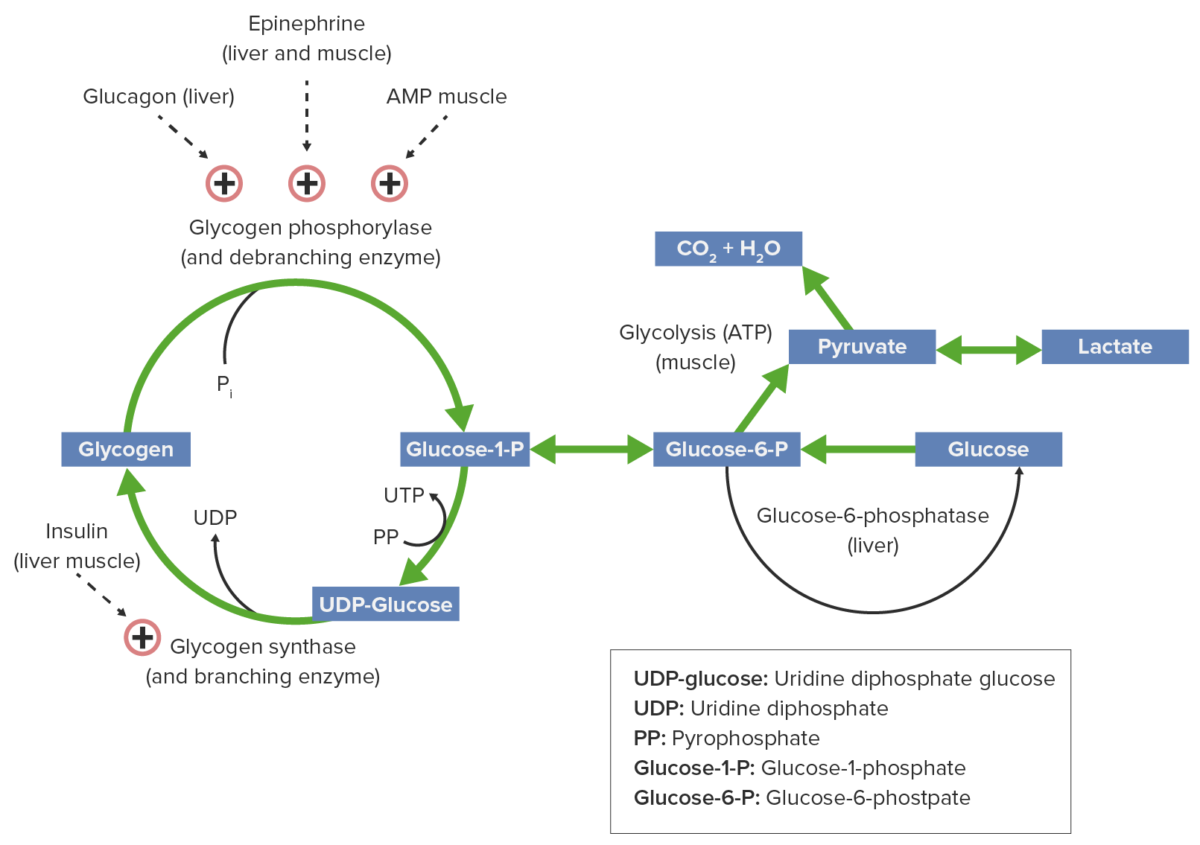
Metabolismo do glicogénio e fatores regulatórios:
A epinefrina, o glucagon e o AMP ativam a glicogénio fosforilase, promovendo assim a glicogenólise, produzindo glucose para consumo energético. A insulina ativa a glicogénio sintase, o que facilita a acumulação de glicogénio.
Doença de armazenamento de glicogénio: um grupo de doenças hereditárias caracterizadas por anormalidades no metabolismo do glicogénio, resultando numa acumulação anormal de glicogénio nos tecidos.
| Tipo | Doenças | Deficiência Enzimática | Características Clínicas |
|---|---|---|---|
| 0 | Doença de Lewis | Glicogénio sintase |
|
| Ⅰ | Doença de von Gierke | Glucose-6-fosfatase |
|
| Ⅱ | Doença de Pompe | Lisossomal α-1,4 e α-1,6 glucosidase (maltase ácida) |
|
| Ⅲ | Doença de Forbes-Cori | Enzima de desramificação (amilo-1,6-glucosidase) |
|
| Ⅳ | Doença de Andersen | Enzima ramificadora de 1,4 -α – glucano |
|
| Ⅴ | Doença de McArdle | Fosforilase muscular |
|
| Ⅵ | Doença de Hers | Fosforilase hepática |
|
| Ⅶ | Doença de Tarui | Fosfofrutocinase (PFK) muscular |
|
| Ⅷ | Deficiência de fosforilase cinase hepática | Fosforilase cinase hepática |
|
| Ⅸ | Deficiência de fosforilase quinase | Fosforilase cinase do fígado e do músculo |
|
| Ⅹ | Deficiência de PGAM | Fosfoglicerato mutase |
|
| ⅩⅠ | Deficiência de lactato desidrogenase A | Lactato desidrogenase A |
|
| XII | Deficiência de aldolase A | Aldolase A |
|
| XIII | Deficiência de beta-enolase (músculo) | Beta-enolase |
|
| XIV | Deficiência de fosfoglucomutase I (músculo) | Fosfoglucomutase I |
|
| XV | Deficiência de glicogenina I (músculo) | Glicogenina I |
|
| Síndrome de Fanconi-Bickel | GLUT2 |
|