A leucemia mielóide aguda (LMA) é uma doença hematológica maligna caracterizada pela proliferação descontrolada de células precursoras mielóides. A LMA apresenta-se tipicamente em adultos mais velhos e caracteriza-se por uma acumulação de mieloblastos e substituição da medula normal por células malignas, com compromisso da hematopoiese. A apresentação clínica consiste em fadiga, hemorragia, febre e infeção, associada a anemia, trombocitopenia e ausência de leucócitos funcionais. O início dos sintomas ocorre em dias a semanas. Os achados adicionais na LMA podem incluir hipertrofia gengival e infiltração cutânea (leucemia cutis). O diagnóstico é realizado através de um esfregaço de sangue periférico e biópsia da medula óssea (revela mieloblastos). As células precursoras apresentam bastonetes de Auer. A imunofenotipagem, a histoquímica e a análise genética auxiliam na identificação e orientação do tratamento da LMA. O tratamento é realizado com quimioterapia administrada em diversas fases (indução, consolidação e manutenção) com base nos subtipos. O prognóstico varia de acordo com a idade de início e o tipo de leucemia.
Última atualização: Sep 17, 2022
A leucemia mielóide aguda (LMA) é uma doença hematológica maligna caracterizada por proliferação patológica de células precursoras mielóides na medula óssea e subsequente substituição de outros precursores de células sanguíneas.
O sistema de classificação da Organização Mundial da Saúde (OMS) é baseado em vários fatores, incluindo morfologia, genética e características clínicas:
A hematopoiese inicia-se com uma célula estaminal hematopoiética, estimulada a dividir-se e diferenciar-se com estímulos químicos apropriados (fatores de crescimento hematopoiéticos).
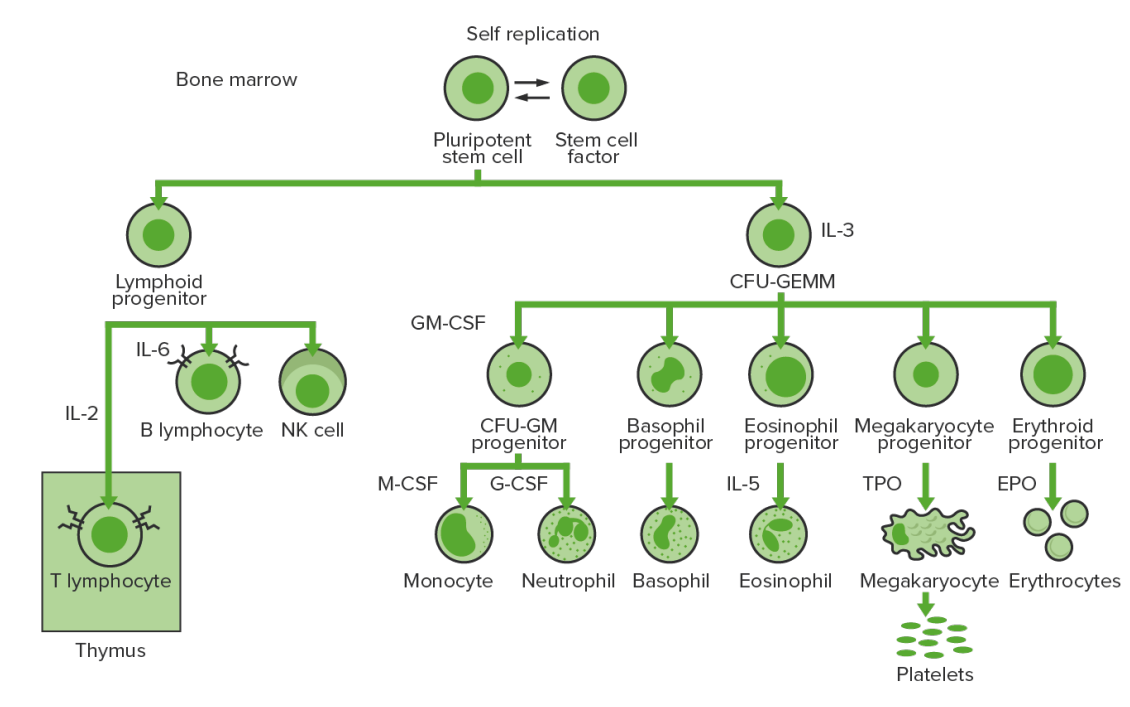
Hematopoiese da medula óssea: proliferação e diferenciação dos elementos sanguíneos.
CFU-GEMM (pela sigla em inglês): unidade formadora de colónias de granulócitos, eritrócitos, monócitos, megacariócitos
CFU-GM (pela sigla em inglês): unidade formadora de colónias de granulócitos e macrófagos
GM-CSF (pela sigla em inglês): fator estimulador de colónias de granulócitos e macrófagos
M-CSF (pela sigla em inglês): fator estimulador de colónias de macrófagos
G-CSF (pela sigla em inglês): fator estimulador de colónias de granulócitos
NK: natural killer
TPO: trombopoietina
| Características | LLA | LMA |
|---|---|---|
| População | Mais comum em crianças | Mais comum em adultos |
| Características comuns |
|
|
| Exame objetivo |
|
|
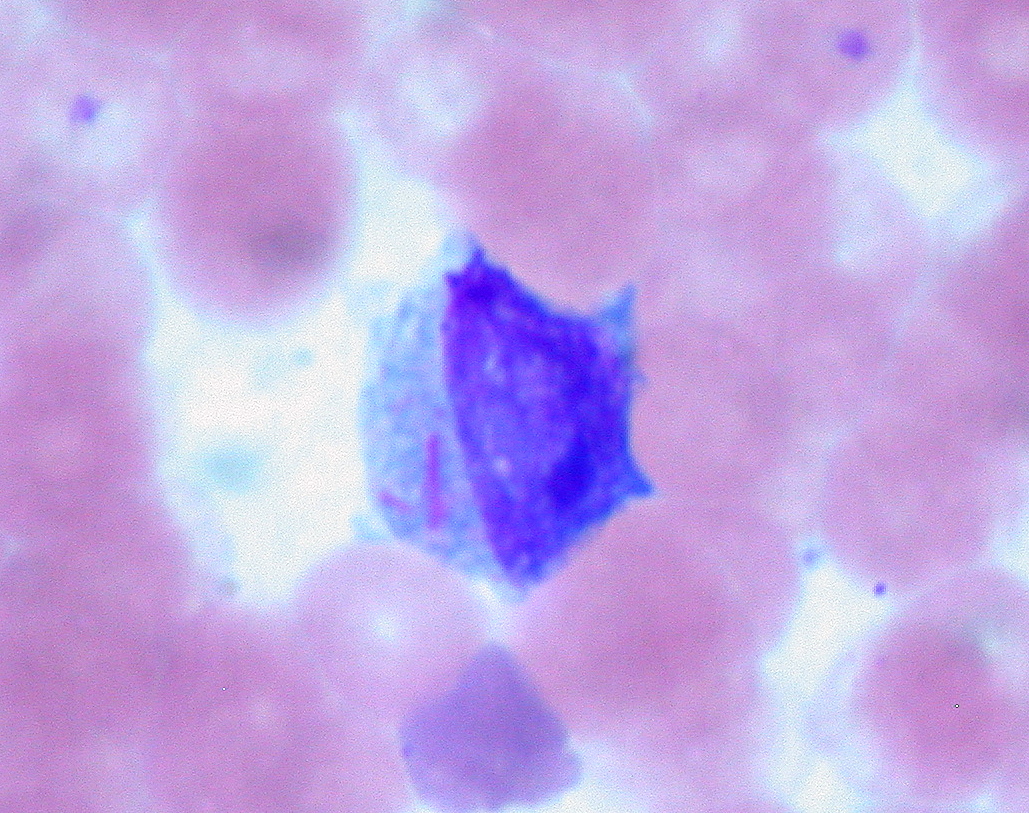
Leucemia mielóide aguda (LMA): achados na medula óssea compatíveis com bastonetes de Auer (estruturas em forma de agulha rosa no citoplasma) num mieloblasto
Imagem: “Auer Rods in Leukemic Blast” por Ed Uthman. Licença: CC BY 2.0| Características | LLA | LMA |
|---|---|---|
| Achados laboratoriais | Anemia; trombocitopenia; leucócitos – variável | |
| Esfregaço de sangue periférico ou exame da medula óssea (morfologia) | Linfoblastos:
|
Mieloblastos:
|
| Citoquímica |
|
|
| Imunofenotipagem |
|
CD13, CD33, CD117, HLA-DR |
A quimioterapia requer avaliação pré-tratamento, incluindo objetivos e preferências do doente, comorbilidades, capacidade funcional e fatores prognósticos associados ao tipo de LMA.
| Tratamento | LLA | LMA |
|---|---|---|
| Indução |
|
|
| Consolidação | Opções:
|
Quimioterapia adicional (citarabina) |
| Manutenção |
|
Quimioterapia não mielossupressora e/ou agente terapêutico direcionado |
| Tratamento adicional |
|
Leucemia promielocítica aguda:
|
| Transplante de células hematopoéticas | Para indivíduos com mau prognóstico | |
| Prognóstico |
|
|