Os organismos multirresistentes (OMR) e as infeções nosocomiais são uma questão de saúde global e uma das principais causas de morbilidade e mortalidade. Os OMR são microorganismos, principalmente bactérias, que são resistentes/não-suscetíveis a ≥1 agente em ≥3 classes de antimicrobianos. Incluem-se neste grupo os Staphylococcus aureus resistentes à meticilina (MRSA, pela sigla em inglês), enterocococos resistentes à vancomicina (VRE, pela sigla em inglês), bactérias Gram-negativas que produzem beta-lactamases de espectro alargado (ESBLs, pela sigla em inglês), Pseudomonas aeruginosa difíceis de tratar/resistentes e enterobactérias resistentes a carbapenemes ou CREs (pela sigla em inglês) (por exemplo, Escherichia coli, Salmonella e Klebsiella). Uma vez que a terapia antibiótica para OMR é limitada, são recomendadas medidas preventivas tais como a administração de antibióticos e o controlo de infeção. As infeções nosocomiais, também chamadas infeções "associadas a cuidados de saúde" ou infeções "adquiridas no hospital" (IAH), são infeções transmitidas num hospital ou unidade de saúde, e que estavam ausentes no momento da admissão. Estas incluem infeções relacionadas com cateteres intravasculares, infeções do trato urinário associadas a cateteres (CAUTIs, pela sigla em inglês), pneumonia adquirida no hospital (PAH), pneumonia associada a ventilador (PAV), infeções por Clostridioides difficile (ICD) e infeções do local cirúrgico. Os fatores de risco para desenvolver estas infeções incluem hospitalização, residência numa unidade de saúde a longo prazo, uso frequente de antibióticos e comorbilidades subjacentes.
Última atualização: Jul 11, 2023
Conteúdo
Excluindo a transmissão nosocomial de SARS-CoV-2 durante a pandemia, as IAH não bacterianas são menos comuns do que as IAH bacterianas.
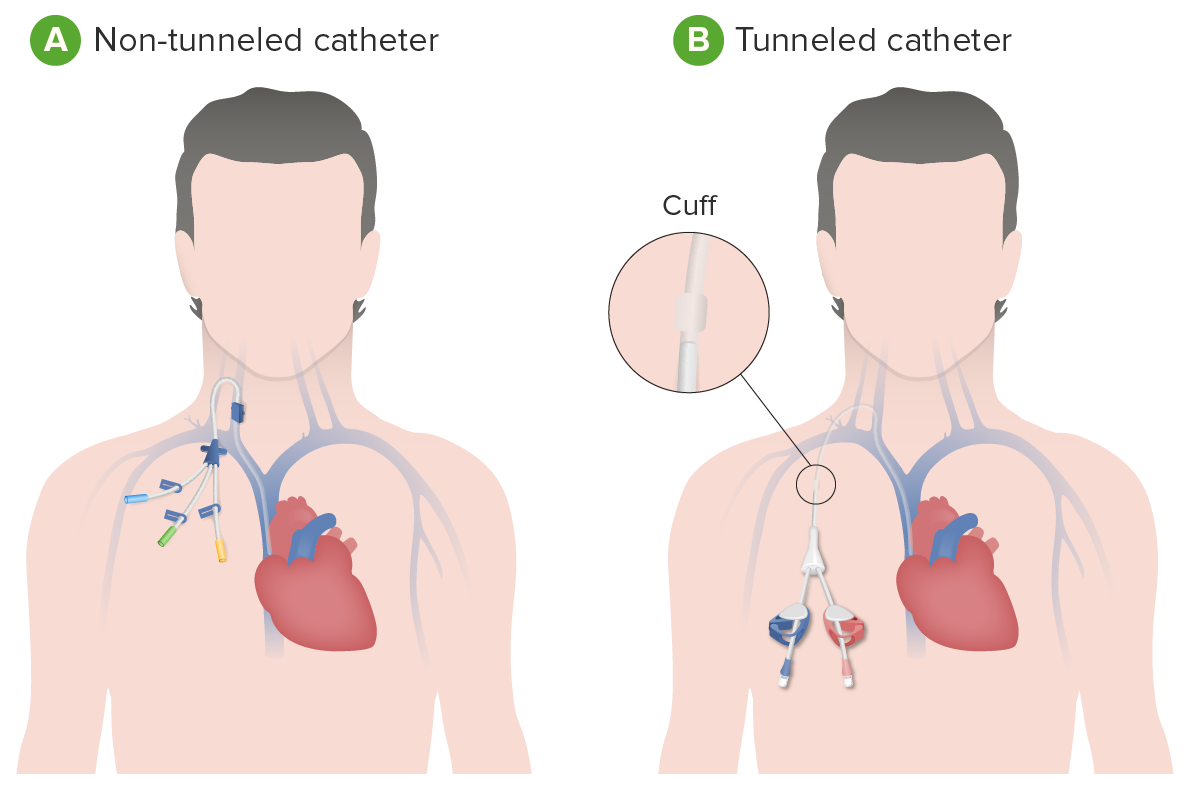
Um cateter venoso central (por exemplo, um cateter de diálise) é uma fonte potencial de infeção:
A: cateter não tunelizado (desenhado para ser temporário e pode ser colocado numa veia de grande calibre próximo do pescoço, peito ou virilha)
B: cateter de diálise tunelizado (colocado sob a pele) (pretende-se que seja usado durante um período de tempo longo)
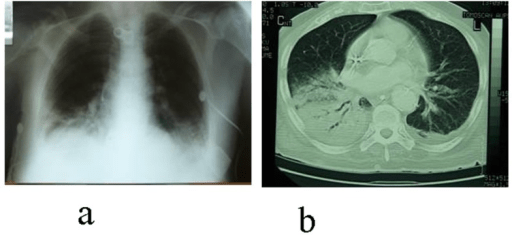
Pneumonia associada à ventilação:
a: Raio-X do tórax que demonstra pneumonia na base do pulmão direito
b: TC torácica que revelar um abcesso pulmonar em desenvolvimento com pleurite e aparente empiema na área notada no raio-X de tórax
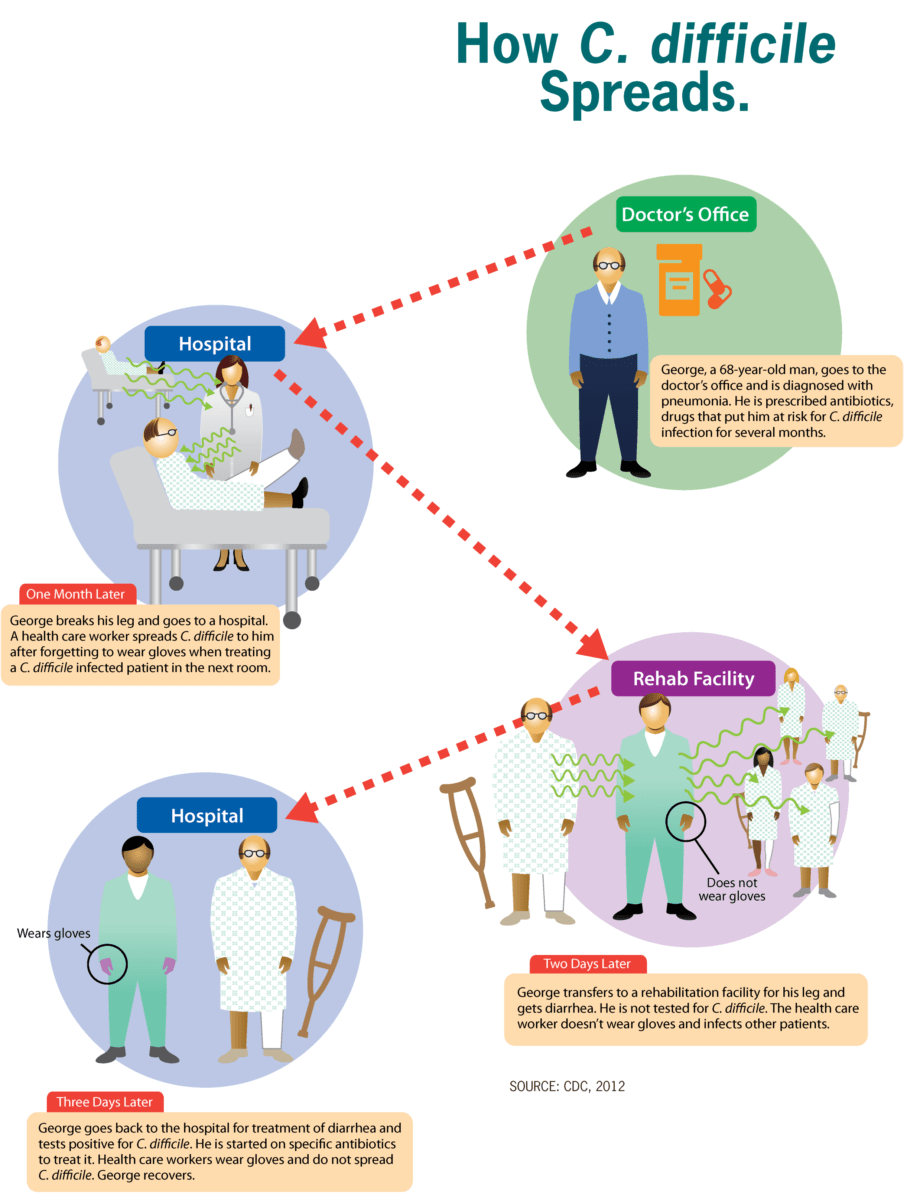
A imagem mostra como o Clostridioides difficile (C. difficile) se propaga pelo ambiente, favorecendo ambientes de saúde como hospitais e unidades de reabilitação
Imagem: “How C. difficile spreads” por CDC. Licença: Domínio Público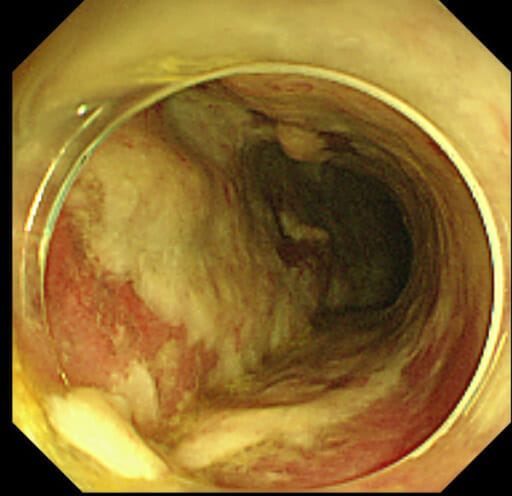
Colite pseudomembranosa devido a infeção por C. difficile: imagem de colonoscopia que mostra uma parede do cólon coberta por pseudomembranas espessas, que consistem em placas de material fibrinopurulento e descamação do epitélio da mucosa que se sobrepõe à mucosa intestinal vermelha e inflamada
Imagem: “Colonoscopy on the fifth postoperative day” por Departamento de Cirurgia, Jichi Medical University Saitama Medical Center. Licença: CC BY 2.0