A imunodeficiência combinada severa (SCID, pela sigla em inglês), também denominada “doença do menino da bolha”, é um distúrbio genético raro no qual o desenvolvimento de células B e T funcionais é perturbado devido a várias mutações genéticas, que resultam na redução ou usência da função imunológica. É a forma mais grave de imunodeficiência primária e é caracterizada por disfunção nas resposta imune humoral e mediada por células. Múltiplas mutações podem resultar em tipos heterogéneos de SCID. Os doentes apresentam infeções graves e recorrentes nos primeiros meses de vida. O tratamento inclui imunoglobulinas IV e transplante de medula óssea. Se não for tratada, a SCID geralmente é fatal no primeiro ano de vida.
Última atualização: Mar 21, 2025
Pelo menos 12 genes são conhecidos por causar imunodeficiência combinada grave (SCID, pela sigla em inglês) se mutados, incluindo aqueles que codificam para o seguinte:
O padrão de hereditariedade depende do tipo de mutação genética envolvida:
| Fenótipo | Defeito genético |
|---|---|
| T–B+NK– | γC, JAK3 |
| T–B–NK+ | RAG-1, RAG-2, Artemis, DNA ligase IV, Cernunnos, DNA PKcs |
| T–B+NK+ | IL-7Rα, CD3δ, CD3ζ, Coronin-1A, ZAP-70, CD45 |
| T–B–NK– | ADA, AK2 |
| Síndrome | Defeito |
|---|---|
| Imunodeficiência Combinada Severa Ligada ao X | Mutações no gene que codifica a cadeia γ comum, uma proteína que é compartilhada pelos recetores das interleucinas IL-2, IL-4, IL-7, IL-9, IL-15 e IL-21 |
| Deficiência da adenosina desaminase |
|
| Deficiência de nucleosídeo fosforilase de purina (PNP, pela sigla em inglês) | Doença autossómica recessiva que envolve mutações do gene PNP |
| Disgenesia reticular | Incapacidade dos precursores de granulócitos formarem grânulos secundários devido ao mau funcionamento da adenilato cinase 2 mitocondrial |
| Síndrome de Omenn |
|
| Síndrome do linfócito nu |
|
| JAK3 | JAK3 é uma enzima que medeia a transdução a jusante dos sinais γc. |
A doença geralmente apresenta-se na primeira infância (2-6 meses). Nos indivíduos afetados observam-se infeções oportunistas graves e recorrentes.
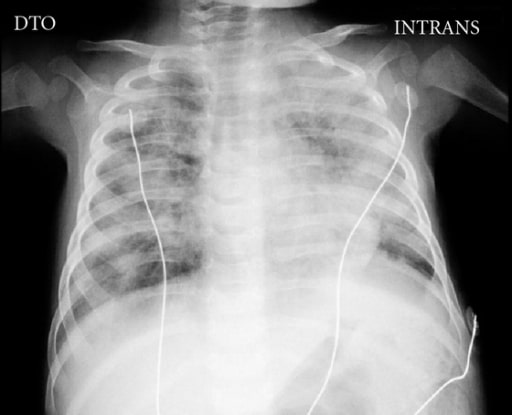
Radiografia de tórax de um menino de 5 meses com SCID complicada por doença disseminada pelo bacilo Calmette-Guérin (BCG) a demostrar a ausência de timo e áreas bilaterais de opacidades
Imagem: “Chest X-ray” por Pediatric Intensive Care Unit, Hospital Dona Estefânia, 1169-045 Lisboa, Portugal. Licença: CC BY 3.0
As seguintes condições são diagnósticos diferenciais de SCID: