Glioblastoma multiforme é um astrocitoma de alto grau, ou seja, um tumor cerebral agressivo com origem nos astrocitos, com etiologia desconhecida e associações pouco claras com eventuais fatores de risco. Existem dois tipos principais: o primário, o tipo mais agressivo e mais frequente em doentes mais velhos, e o secundário, que se desenvolve a partir de astrocitomas de grau inferior e é visto mais comummente em doentes mais jovens. Os glioblastomas manifestam-se frequentemente com dores de cabeça, convulsões e défices neurológicos. A ressecção cirúrgica em combinação com radioterapia e quimioterapia é o tratamento de escolha. O prognóstico é extremamente desfavorável, com uma sobrevida média de 1-5 anos nos doentes submetidos a tratamentos agressivos e apenas 3 meses nos doentes sem tratamento.
Última atualização: Jun 20, 2022
O Glioblastoma multiforme (GBM) é um tipo agressivo e rapidamente progressivo de tumor cerebral com origem nos astrocitos:
| Categorias | Tumores específicos |
|---|---|
| Tumores neuroepiteliais no SNC |
|
| Tumores meníngeos |
|
| Tumores da região selar |
|
| Linfoma primário do SNC | Linfoma primário do SNC |
| Metástases cerebrais (5x mais comum do que os tumores cerebrais primários) | Que resultam frequentemente de:
|
| Tumores Periféricos |
|
Os 2 principais tipos de glioblastoma são:
A etiologia dos glioblastomas não está estabelecida e é difícil determinar uma única causa. Os fatores de risco que parecem contribuir para o desenvolvimento dos glioblastomas incluem:
Várias mutações genéticas estão associadas a astrocitomas:
Muitos dos sintomas gerais ocorrem devido ao aumento da PIC. Os sintomas podem incluir:
O diagnóstico dos glioblastomas é obtido através da realização de exames de imagem, após a colheita de uma história clínica e exame físico apropriados que levantam suspeitas de um tumor cerebral. A biópsia é necessária para a confirmação do diagnóstico. Os estudos laboratoriais não têm utilidade no diagnóstico de GBMs.
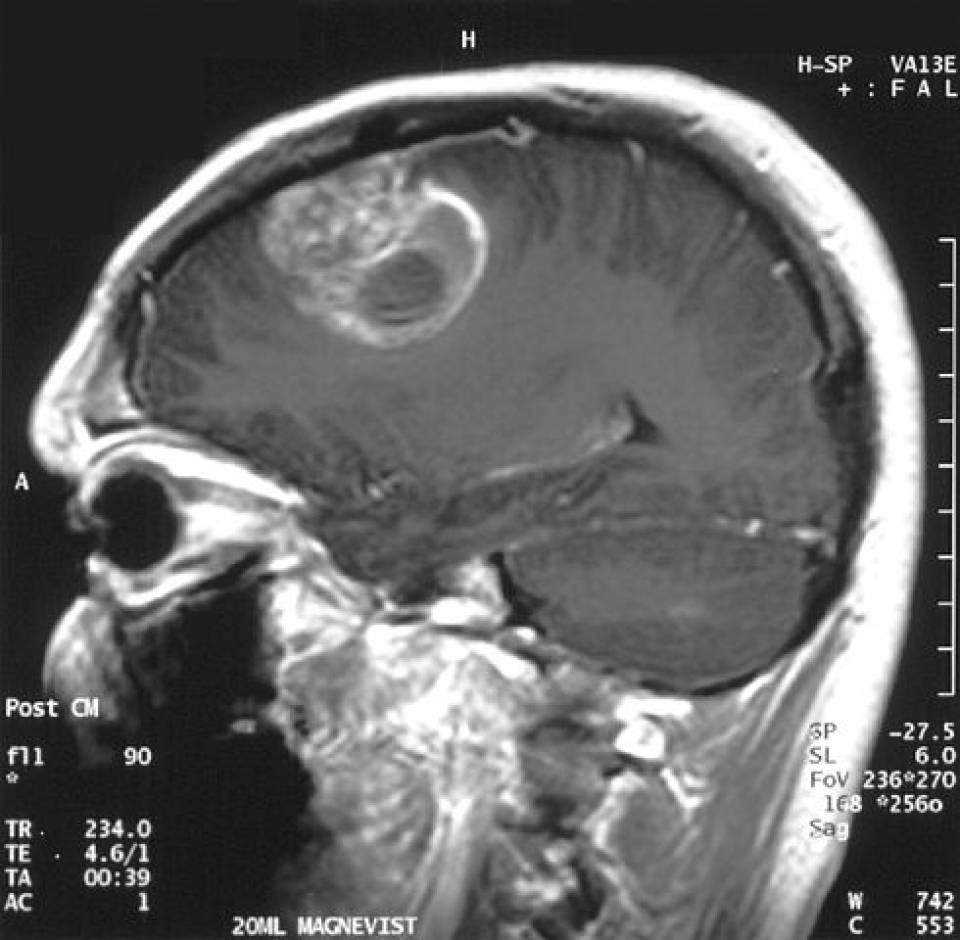
Ressonância magnética de um glioblastoma:
Lesão realçada com contraste e com uma área de clareira central correspondente a necrose.
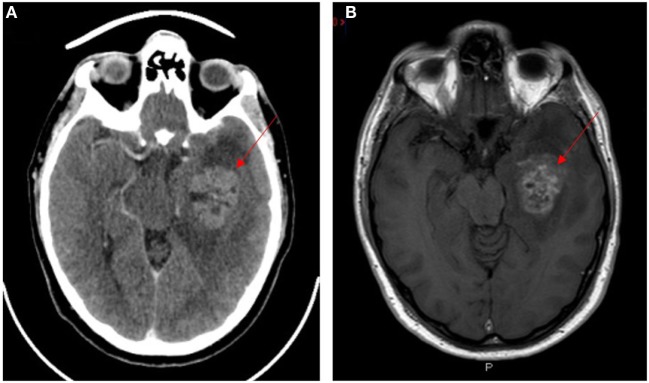
Neuroimagem do glioblastoma multiforme (lesões indicadas por setas vermelhas):
A: TAC com contraste
B: Ressonância magnética com contraste ponderado em T1
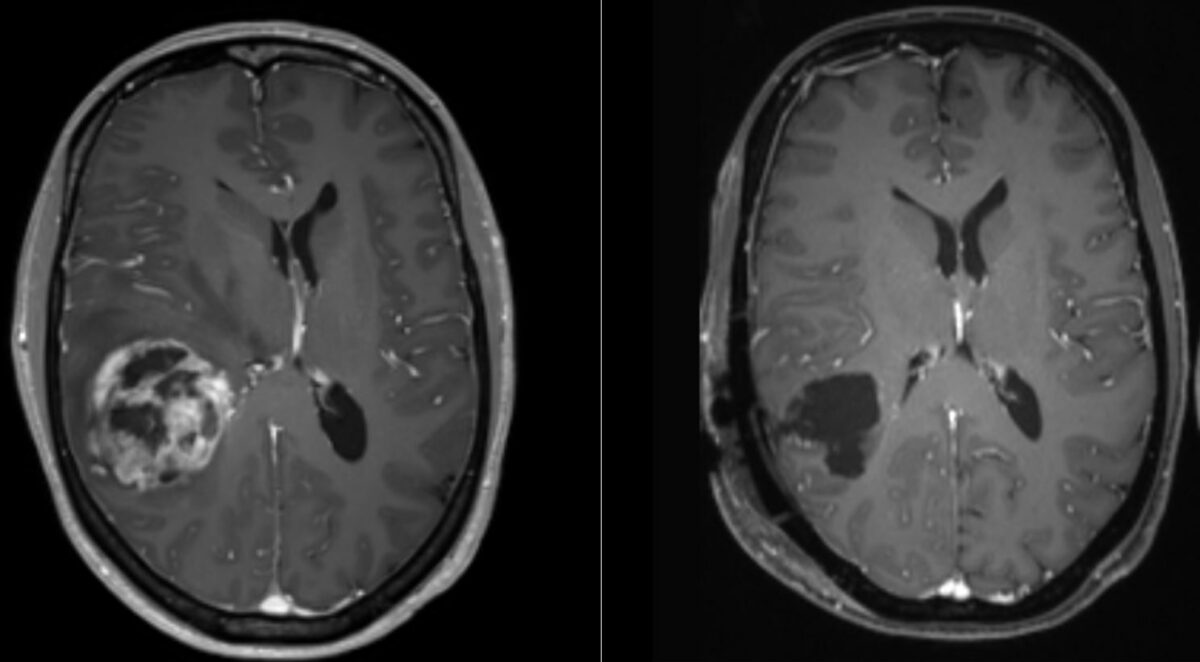
Ressonância magnética de glioblastoma:
Imagens do tumor no pré-operatório (esquerda) e no pós-operatório (direita). À esquerda, área de necrose central rodeada por uma região realçada por contraste e um deslocamento da linha média.
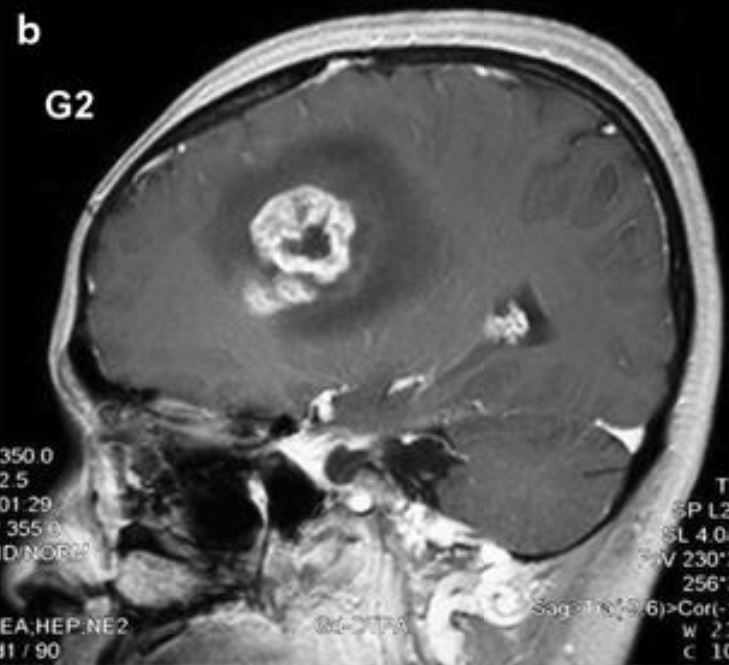
Ressonância magnética sagital que mostra uma lesão cerebral diagnosticada como glioblastoma:
Lesão com uma área central de necrose circundada por uma área realçada por contraste.
A realização de biopsia com posterior avaliação histológica é necessária para a confirmação do diagnóstico. Os achados incluem:
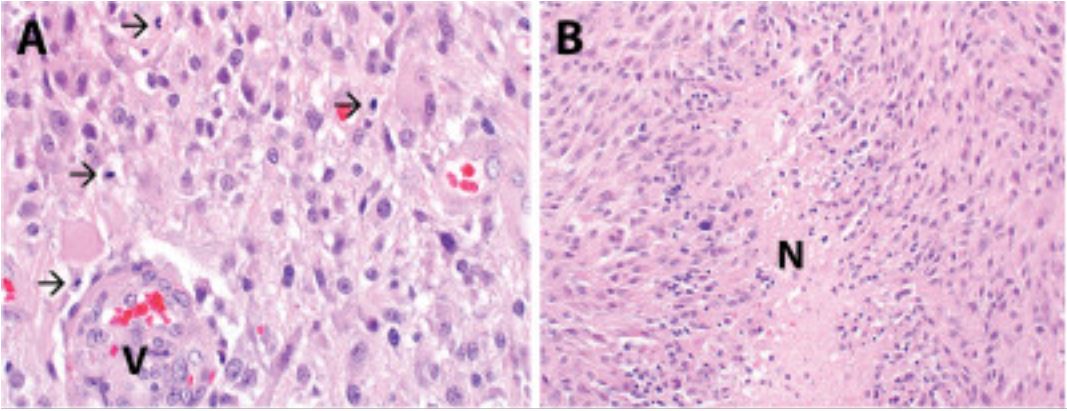
Glioblastoma multiforme (astrocitoma de grau IV da OMS):
A avaliação histológica revela uma neoplasia astrocítica hipercelular que se infiltra no parênquima cerebral envolvente.
B: A amostra mostra áreas de necrose, incluindo necrose pseudopalisada (designada por N).
Imagem: “Complete clinical regression of a BRAF V600E-mutant pediatric glioblastoma multiforme after BRAF inhibitor therapy” por Robinson GW, Orr BA, Gajjar A. License: CC BY 2.0, cropped by Lecturio.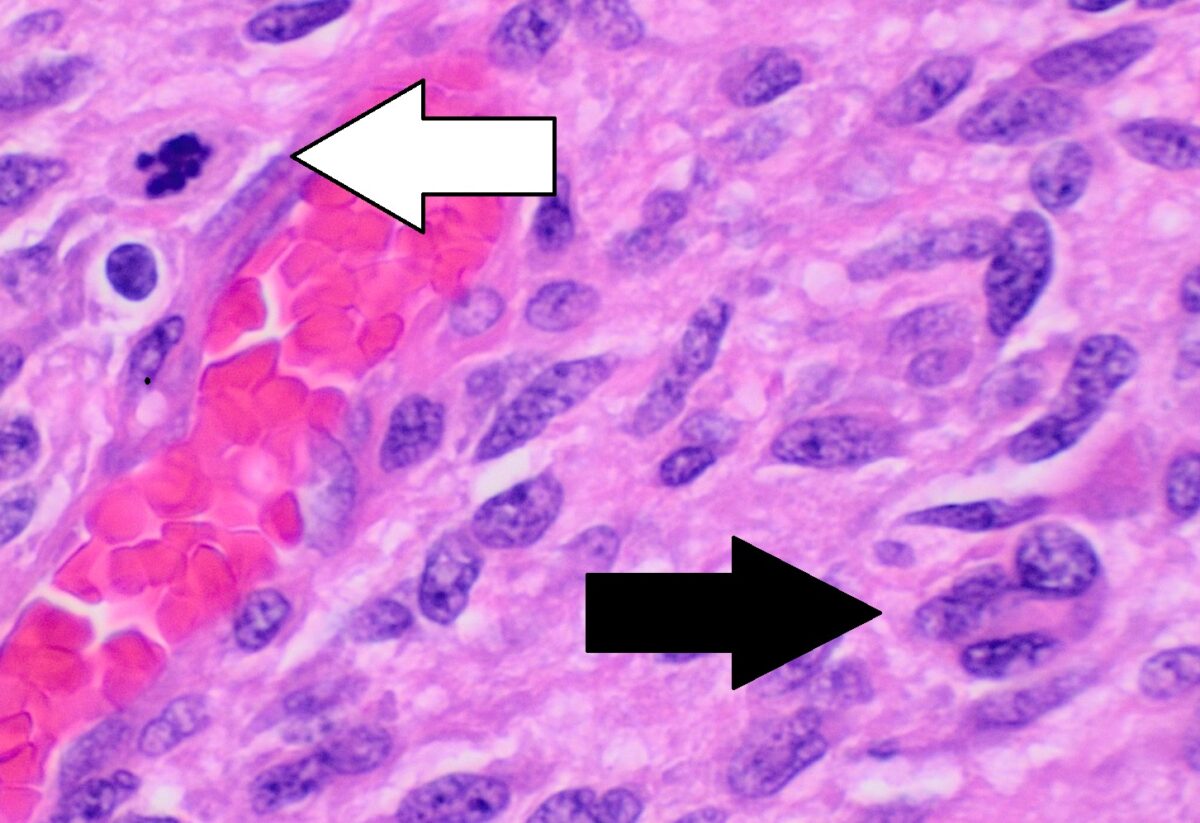
Exame histopatológico do glioblastoma que mostra um pleomorfismo nuclear, múltiplas figuras mitóticas (seta branca), e células multinucleadas (seta preta)
Há um arranjo de células sem padrão.
A principal abordagem terapêutica é a intervenção cirúrgica, seguida de radioterapia e quimioterapia. Nenhuma opção terapêutica é curativa, e o prognóstico permanece desfavorável, mesmo com esquemas de tratamento agressivos.
Os desafios que dificultam o tratamento dos glioblastomas são:
Para doentes com sintomas neurológicos, as seguintes condições devem ser consideradas no diagnóstico diferencial do glioblastoma multiforme.