El glioblastoma multiforme es un astrocitoma de alto grado, el cual es un tumor cerebral agresivo que surge de los astrocitos, con una causa desconocida y una relación poco conocida con los factores de riesgo. Existen dos tipos principales: el primario, el cual es una forma más agresiva que se observa con mayor frecuencia en pacientes de edad avanzada y el secundario, que se desarrolla a partir de astrocitomas de bajo grado y se observa con mayor frecuencia en pacientes más jóvenes. Los glioblastomas suelen presentarse con cefalea, convulsiones y déficits neurológicos. La RM es el estándar de oro y la resección quirúrgica combinada con radiación y quimioterapia son el tratamiento de elección. El pronóstico es extremadamente malo, con una supervivencia solamente de 1–5 años en los pacientes que reciben un tratamiento agresivo y de solo 3 meses en los pacientes que no se someten a tratamiento.
Última actualización: Jul 13, 2022
El glioblastoma multiforme es un tipo de tumor cerebral agresivo y rápidamente progresivo que surge de los astrocitos:
| Categorías | Tumores específicos |
|---|---|
| Tumores neuroepiteliales en el SNC |
|
| Tumores meníngeos |
|
| Tumores de la región selar |
|
| Linfoma primario del SNC | Linfoma primario del SNC |
| Metástasis al cerebro (5 veces más frecuente que los tumores cerebrales primarios) | Más comúnmente surgen de:
|
| Tumores periféricos |
|
Los dos tipos principales de glioblastoma son:
La causa de los glioblastomas no está clara y es difícil determinar una única causa. Los factores de riesgo que parecen contribuir al glioblastoma incluyen:
Hay varias mutaciones genéticas asociadas a los astrocitomas:
Muchos síntomas generalizados se deben al aumento de la PIC. Los síntomas pueden incluir:
El diagnóstico de los glioblastomas se basa principalmente en el diagnóstico por imagen después de la presentación clínica, con una evaluación cuidadosa de antecedentes y del examen físico que hagan sospechar de un tumor cerebral. Se requiere una biopsia para confirmar el diagnóstico. Los estudios de laboratorio no son útiles para diagnosticar los glioblastoma multiforme.
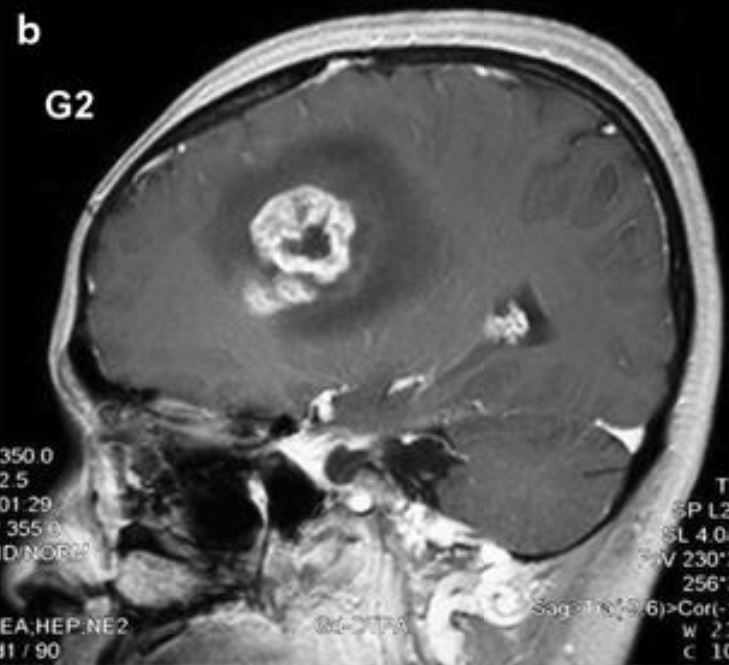
Resonancia magnética de un glioblastoma:
El realce de la lesión con aclaramiento central indica necrosis central.
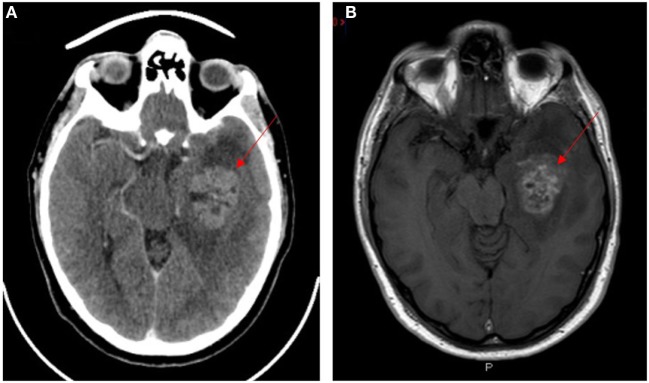
Neuroimagen del glioblastoma multiforme (lesiones indicadas con flechas rojas):
A: TC con contraste
B: RM con contraste ponderado en T1
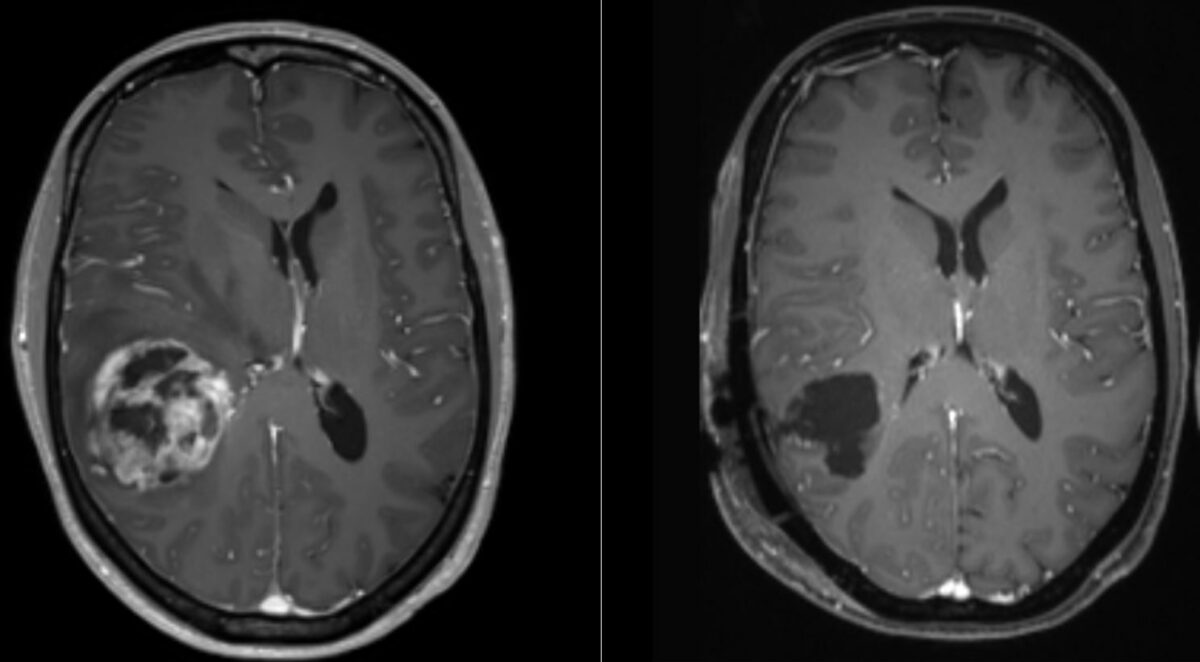
RM del glioblastoma:
La imagen representa el tumor visto antes de la operación (izquierda) y después de la misma (derecha). La imagen de la izquierda muestra una zona central de necrosis rodeada por una región realzada y un desplazamiento de la línea media.
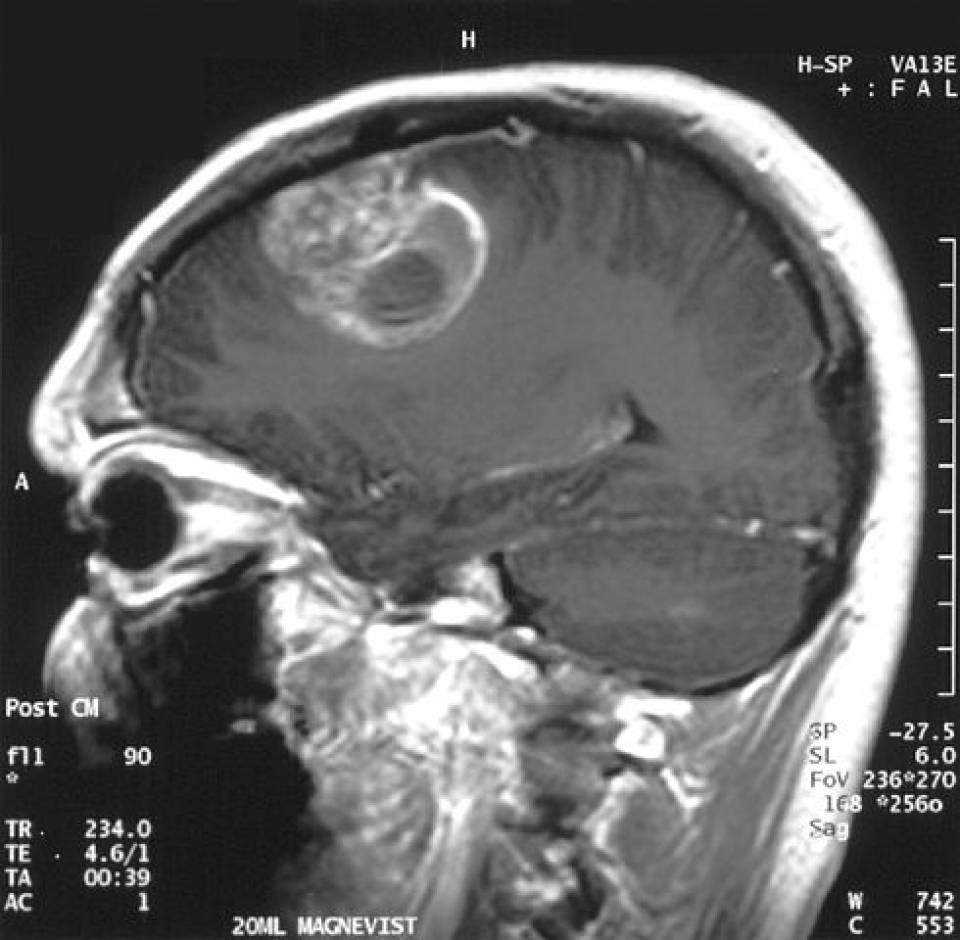
Resonancia magnética sagital que muestra una masa en el cerebro diagnosticada como glioblastoma:
La lesión está rodeada por una zona de realce y una zona central de necrosis.
Se requiere una muestra histopatológica obtenida mediante biopsia para el diagnóstico definitivo. Los hallazgos incluyen:
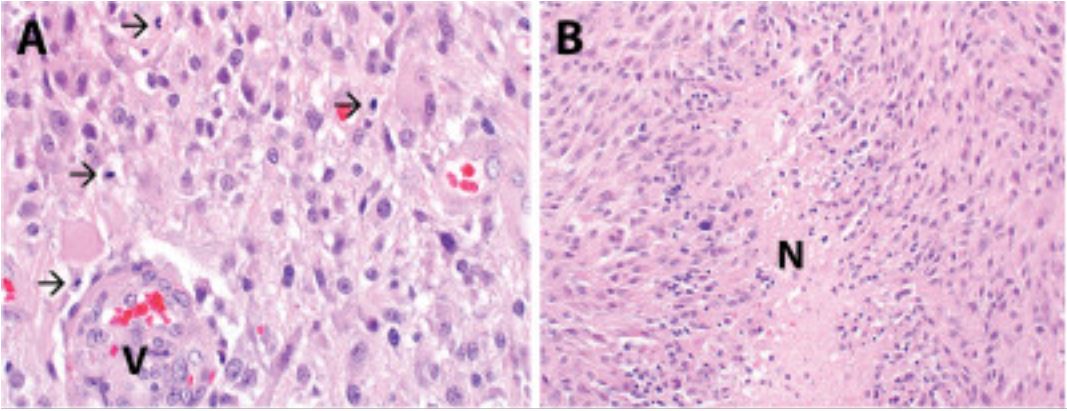
Glioblastoma multiforme (astrocitoma de grado IV de la OMS):
La evaluación histopatológica revela una neoplasia astrocítica hipercelular que infiltra el parénquima cerebral circundante.
B: Se observa necrosis en la muestra, incluida la necrosis pseudopalisante (designada N).
Imagen: “Complete clinical regression of a BRAF V600E-mutant pediatric glioblastoma multiforme after BRAF inhibitor therapy” por Robinson GW, Orr BA, Gajjar A. Licencia: CC BY 2.0, recortada por Lecturio.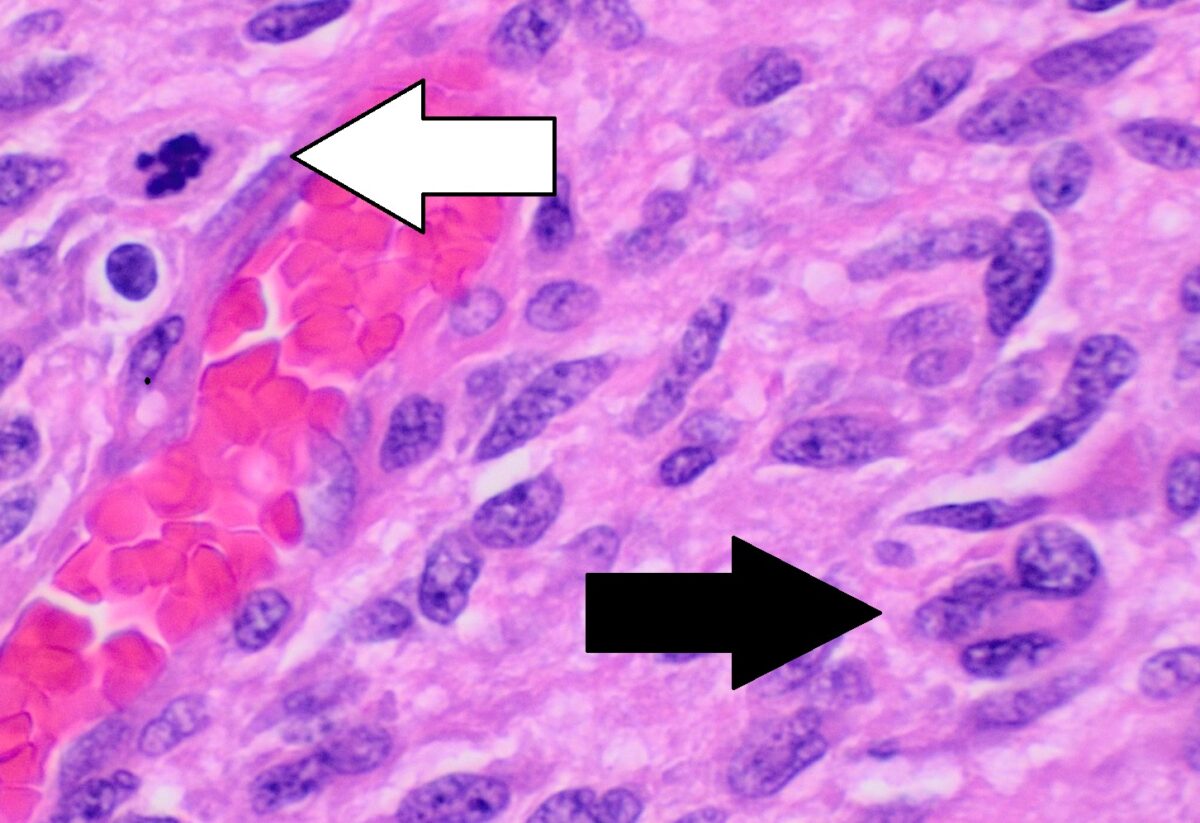
Histopatología de un glioblastoma que muestra pleomorfismo nuclear, múltiples figuras mitóticas (flecha blanca) y células multinucleadas (flecha negra)
La disposición celular no tiene algún patrón.
El enfoque principal del tratamiento es la intervención quirúrgica, seguida de radioterapia y quimioterapia. Ningún tratamiento es curativo y el pronóstico sigue siendo malo, incluso con un tratamiento agresivo.
Los retos que dificultan el tratamiento de los glioblastomas son:
En el caso de los pacientes que presentan hallazgos neurológicos, deben considerarse las siguientes afecciones en el diagnóstico diferencial del glioblastoma multiforme.