A glicólise é uma via metabólica central responsável pela quebra de glucose e tem um papel vital na geração de energia livre para a célula e metabolitos para posterior degradação oxidativa. A glucose fica disponível principalmente no sangue como resultado da degradação do glicogénio ou da sua síntese a partir de precursores não carboidratos (gluconeogénese), sendo importada para as células por proteínas transportadoras específicas. A glicólise ocorre no citoplasma e consiste em 10 reacções, cujo resultado líquido é a conversão de 1 glucose C6 em 2 moléculas de piruvato C3. A energia livre deste processo é recolhida para produzir adenosina trifosfato (ATP) e nicotinamida adenina dinucleótido hidreto (NADH), metabolitos-chave para a produção de energia. A estequiometria geral do percurso é: glucose + 2 Pi + 2 ADP + 2 NAD+> 2 piruvato + 2 ATP + 2 NADH + 2 H+ + 2 H2O (H+: ião hidrogénio, Pi: ião fosfato, NAD+: nicotinamida adenina dinucleótido).
Última atualização: Apr 25, 2025
A 1.ª metade da glicólise requer um investimento energético de 2 moléculas de adenosina trifosfato (ATP) e serve para converter a glucose hexagonal em 2 trioses. O processo consiste em 5 etapas:
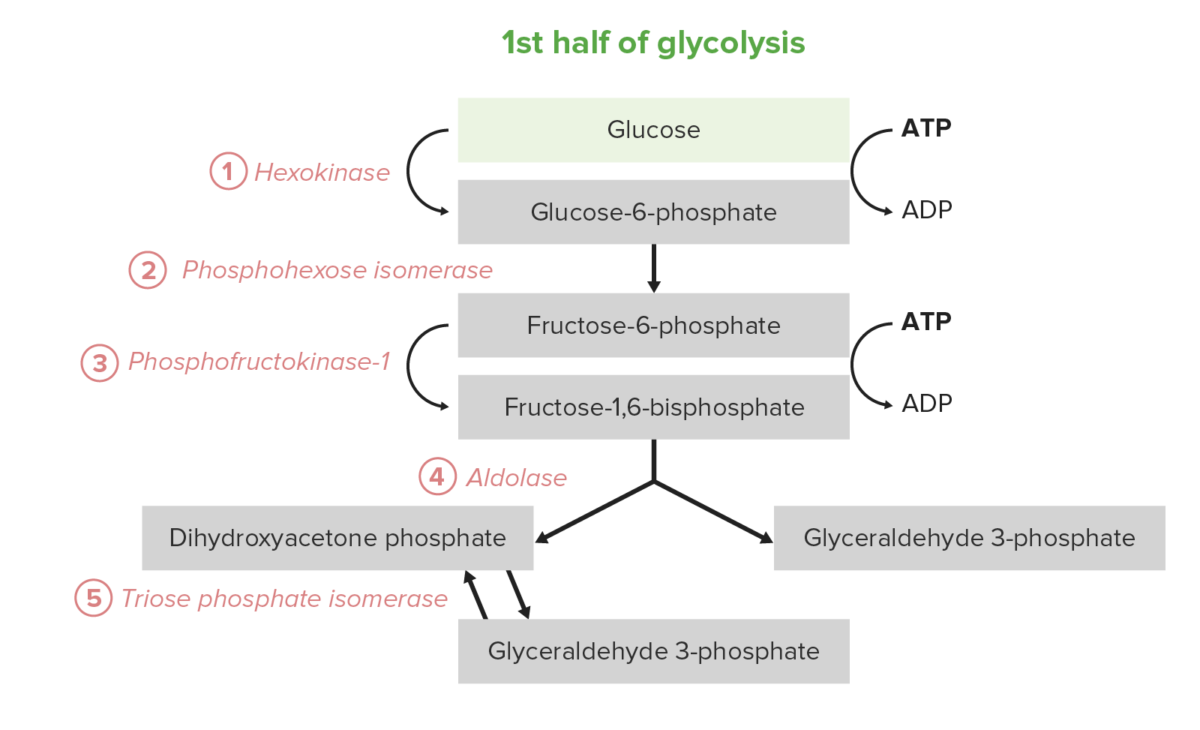
Os 5 primeiros passos (primeira metade) do percurso da glicólise
Image by Lecturio.A segunda metade da glicólise converte a triose GAP em piruvato, com a geração concomitante de 4 ATP e 2 nicotinamida adenina dinucleótido hidreto (NADH) por cada 2 GAP. Assim, o investimento energético dos passos 1–5 é pago duas vezes aqui. Em certos tipos de células e condições, estes 5 passos são a fonte predominante de ATP:
Reacção líquida: glucose + 2 Pi + 2 ADP + 2 NAD+ → 2 piruvato + 2 ATP + 2 NADH + 2 H+ + 2 H2O
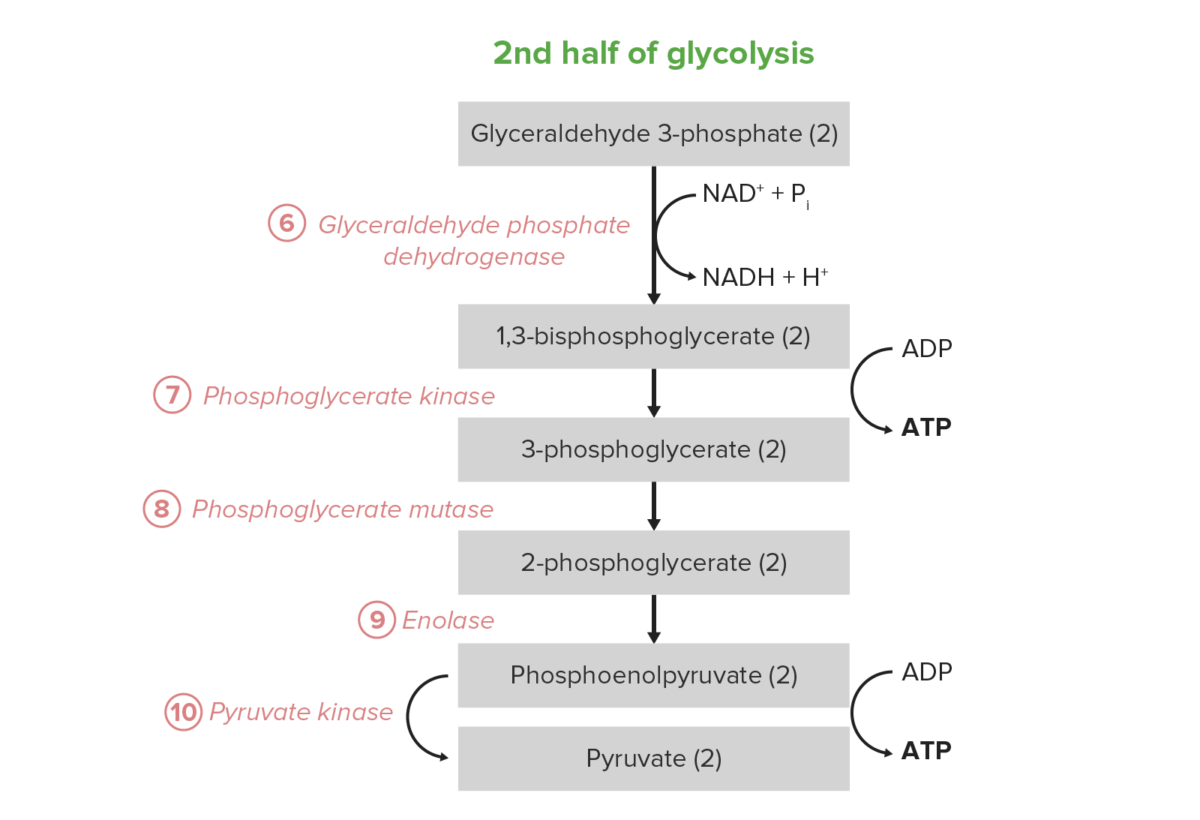
Os últimos 5 passos (última metade) da via da glicólise.
Image by Lecturio.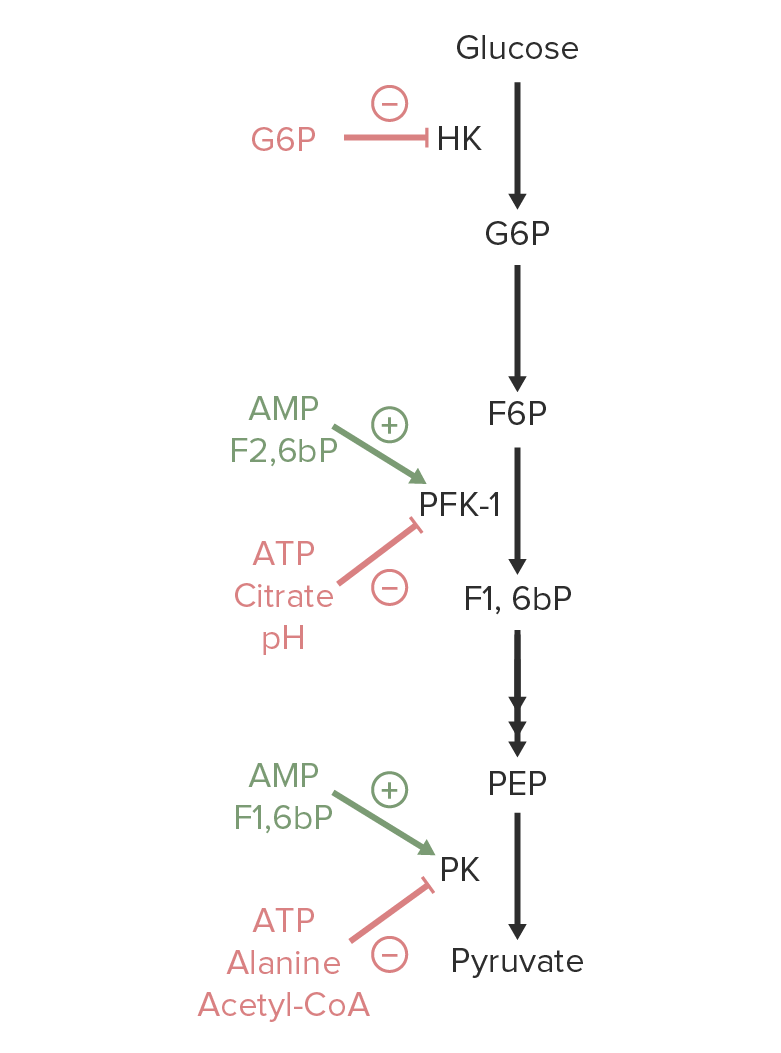
Uma visão geral da regulação da glicólise. Os ativadores da hexocinase (HK), da fosfofrutocinase-1 (PFK-1), ou a piruvato cinase (PK) estão marcados a verde. Os metabolitos que inibem estas enzimas estão marcados a vermelho.
Image by Lecturio.De seguida estão apresentadas enzimas da via da glicólise que podem estar envolvidas em defeitos enzimáticos congénitos:
Estes defeitos enzimáticos congénitos produzem anemia hemolítica.
Anemia hemolítica: grupo de anemias que se devem à destruição ou eliminação prematura de hemácias. Anomalias intrínsecas de hemácias levam à depuração esplénica (hemólise extravascular). A destruição crónica de hemácias pode-se apresentar como icterícia, esplenomegalia, colelitíase, hematúria e sintomas de anemia (falta de ar, fadiga, síncope e taquicardia).