La glucólisis es una vía metabólica central responsable de la descomposición de la glucosa y juega un papel vital en la generación de energía libre para la célula y metabolitos para una mayor degradación oxidativa. La glucosa está disponible principalmente en la sangre como resultado de la descomposición del glucógeno o de su síntesis a partir de precursores distintos de los carbohidratos (gluconeogénesis) y se importa a las células mediante proteínas de transporte específicas. La glucólisis se produce en el citoplasma y consta de 10 reacciones, cuyo resultado neto es la conversión de 1 molécula de glucosa C6 en 2 moléculas de piruvato C3. La energía libre de este proceso se recolecta para producir adenosin trifosfato (ATP, por sus siglas en inglés) y nicotinamida adenina dinucleótido hidruro (NADH, por sus siglas en inglés), metabolitos clave que producen energía. La estequiometría general de la vía es: glucosa + 2 Pi + 2 adenosin difosfato (ADP, por sus siglas en inglés) + 2 NAD+ > 2 piruvato + 2 ATP + 2 NADH + 2H+ + 2H2O (H+: ion hidrógeno, Pi: ion fosfato, NAD+: nicotinamida adenina dinucleótido).
Última actualización: Abr 25, 2025
La 1ra mitad de la glucólisis requiere una inversión energética de 2 moléculas de ATP y sirve para convertir la glucosa hexosa en 2 triosas. El proceso consta de 5 pasos:
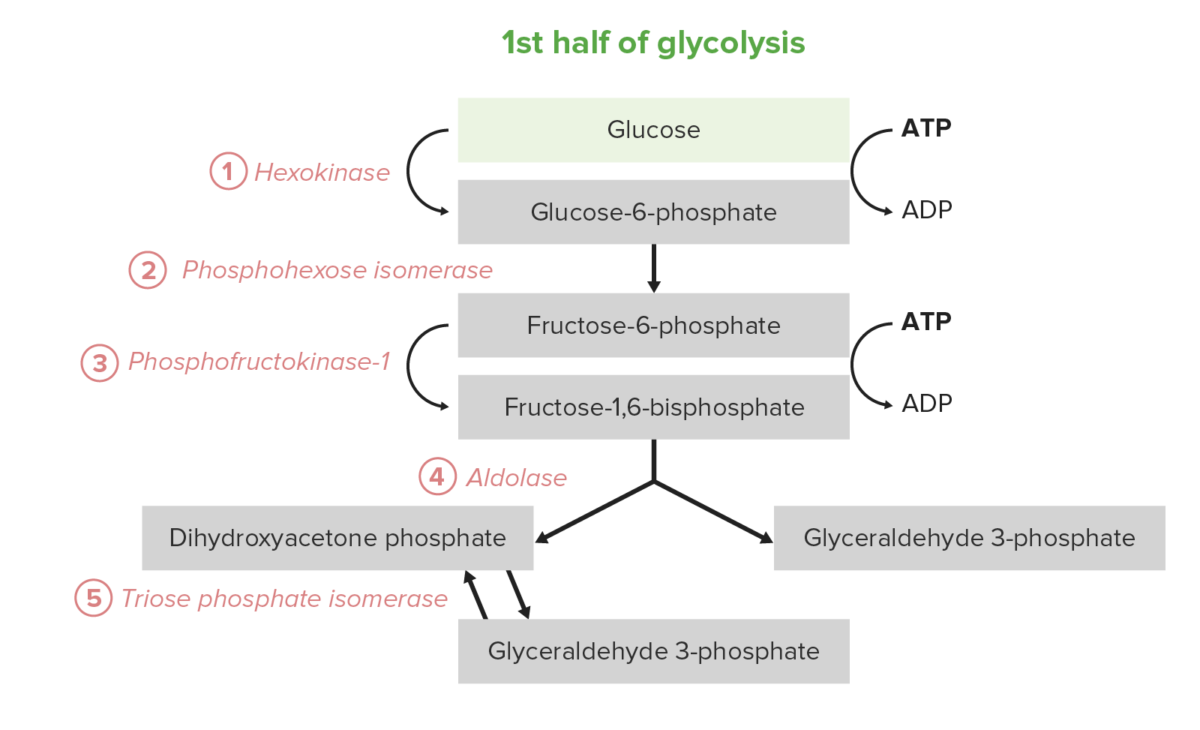
Los primeros 5 pasos (primera mitad) de la vía de la glucólisis
Imagen por Lecturio.La 2da mitad de la glucólisis convierte la triosa GAP en piruvato, con la generación concomitante de 4 ATP y 2 NADH por 2 GAP. Por lo tanto, la inversión en energía de los pasos 1–5 se paga dos veces aquí. En ciertos tipos y condiciones celulares, estos 5 pasos son la fuente predominante de ATP:
Reacción neta: glucosa + 2 Pi + 2 ADP + 2 NAD+ → 2 piruvato + 2 ATP + 2 NADH + 2 H+ + 2 H2O
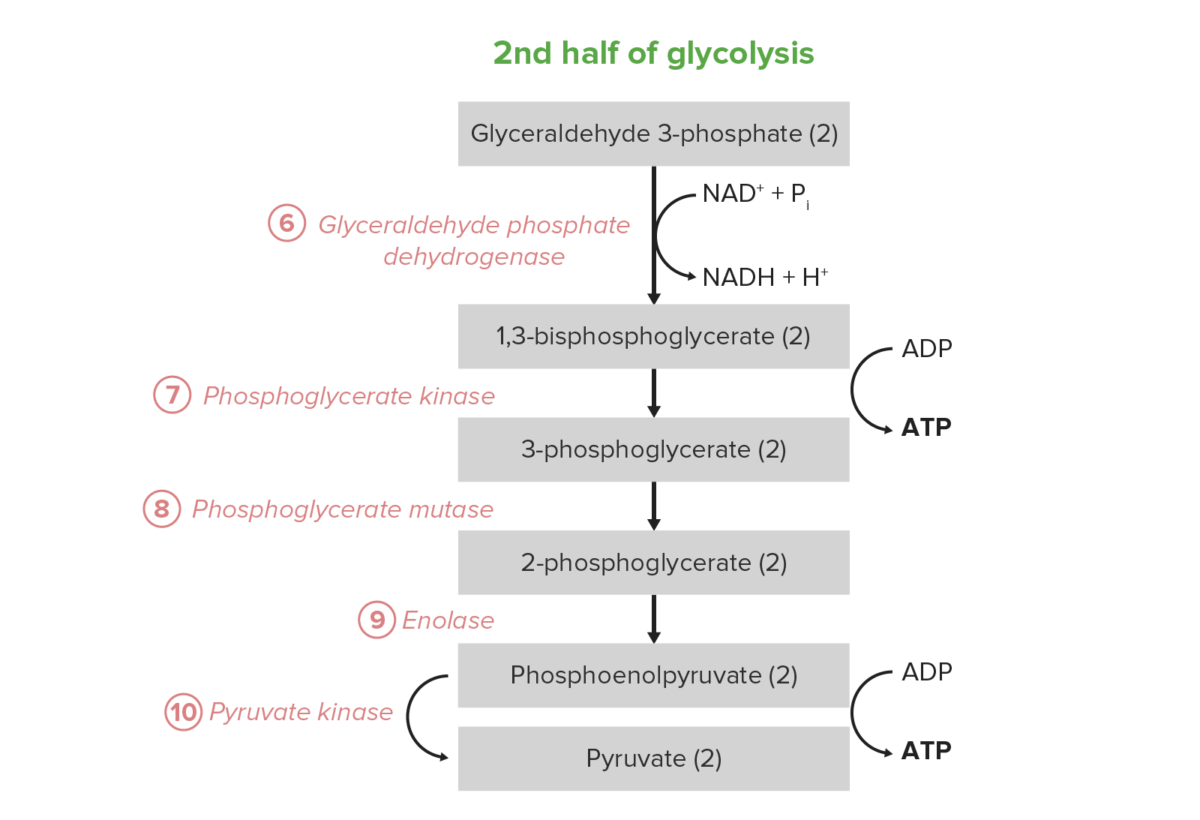
Los últimos 5 pasos (última mitad) de la vía de la glucólisis.
Imagen por Lecturio.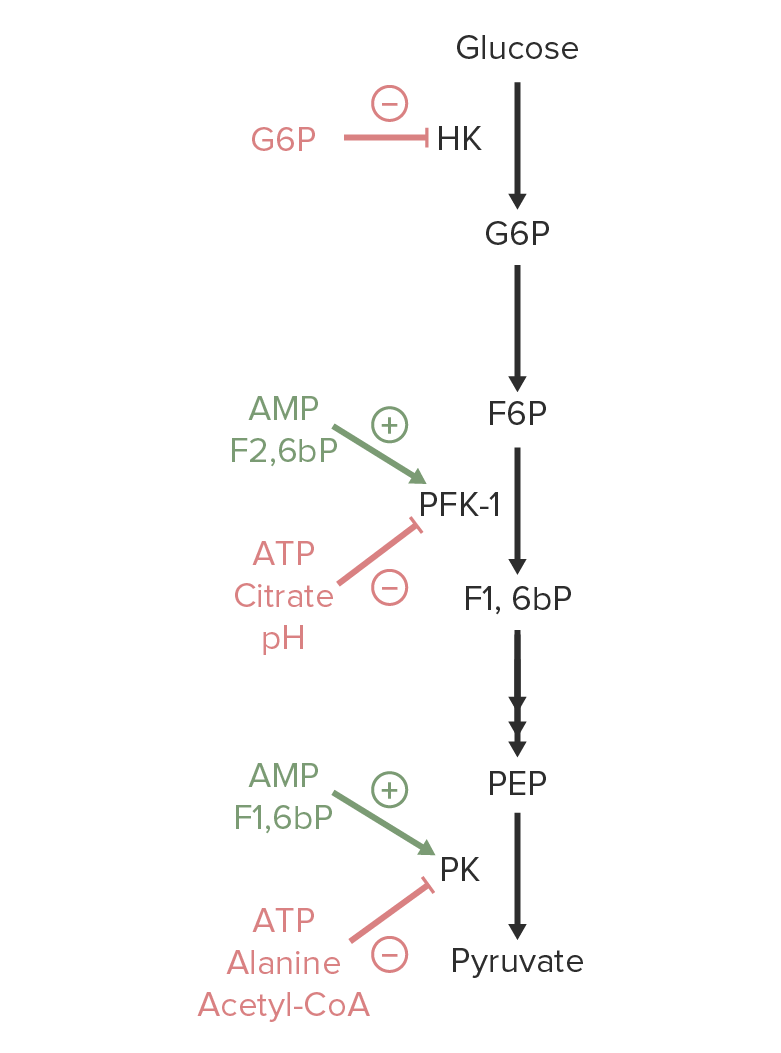
Una visión general de la regulación de la glucólisis. Los activadores de hexoquinasa (HK, por sus siglas en inglés), fosfofructoquinasa-1 (PFK-1) o piruvato quinasa (PK, por sus siglas en inglés) están marcados en verde. Los metabolitos que inhiben estas enzimas están marcados en rojo.
Imagen por Lecturio.Las siguientes son enzimas de la vía de la glucólisis que pueden estar involucradas en los defectos enzimáticos congénitos:
Estos defectos enzimáticos congénitos producen anemia hemolítica.
Anemia hemolítica: un grupo de anemias que se deben a la destrucción o eliminación prematura de los eritrocitos. Las anomalías intrínsecas de los eritrocitos conducen a la depuración esplénica (hemólisis extravascular). La destrucción crónica de los eritrocitos puede presentarse como ictericia, esplenomegalia, colelitiasis, hematuria y síntomas de anemia (dificultad para respirar, fatiga, síncope y taquicardia).