A doença hemolítica do feto e do recém-nascido (DHFRN), também conhecida como eritroblastose fetal, é causada pela destruição dos eritrócitos fetais pelos anticorpos IgG maternos. A incompatibilidade do grupo sanguíneo Rhesus (Rh) (frequentemente desencadeada pelo antigénio D) e a incompatibilidade ABO são causas comuns. Na incompatibilidade Rh, uma mãe RhD-negativa gesta um feto RhD-positivo; assim, os anticorpos contra os antigénios formam-se quando os eritrócitos fetais entram na circulação materna. Na incompatibilidade ABO, frequentemente, uma mãe com sangue tipo O possui anticorpos existentes para os antigénios A e B. O bebé afetado pode sofrer de anemia hemolítica levando a icterícia neonatal grave, hidropsia fetal, complicações cardíacas e morte fetal. Se houver incompatibilidade Rh a afetar a gravidez, a vigilância pré-natal determina a necessidade de transfusão intrauterina e de parto precoce. O tratamento pós-natal inclui monitorização rigorosa, fototerapia para a icterícia e exsanguineotransfusão em casos graves. Em mães RhD-negativas, a sensibilização materna pode ser prevenida usando imunoglobulina anti-D (RhoGAM). O prognóstico é excelente se houver cuidados pré-natais, rastreio do tipo sanguíneo e disponibilidade de imunoglobulina RhD.
Última atualização: Apr 5, 2022
A doença hemolítica do feto e do recém-nascido (DHFRN) é a anemia hemolítica do feto ou do recém-nascido com graus variados de gravidade devido a anticorpos IgG maternos contra antigénios de superfície dos eritrócitos fetais.
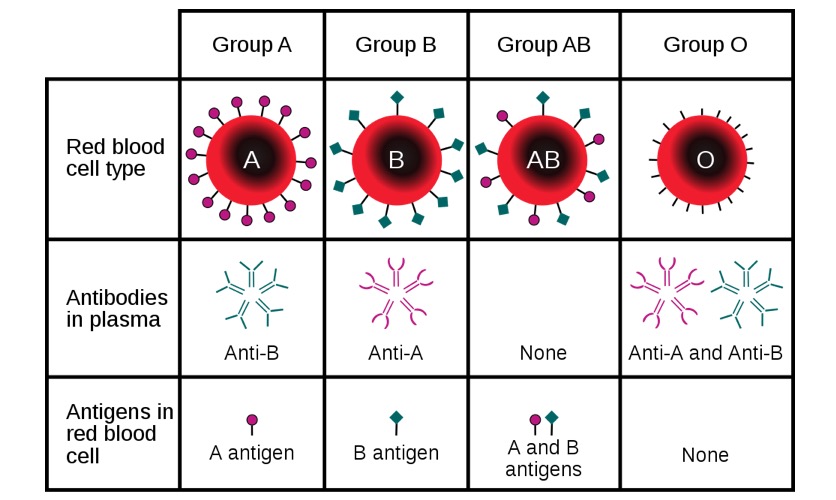
Principais grupos sanguíneos ABO com os respetivos antigénios e anticorpos com base no tipo sanguíneo
Imagem: “ABO blood type” por InvictaHOG. Licença: Domínio PúblicoDurante a gravidez, os eritrócitos fetais movem-se através da placenta para a circulação materna:
Incompatibilidade ABO:
Incompatibilidade Rhesus:
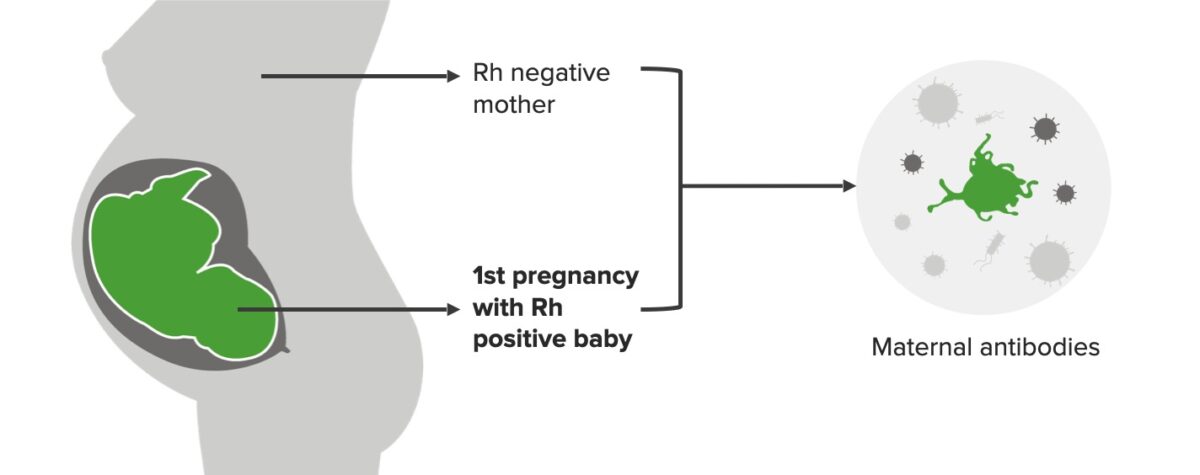
Incompatibilidade Rh, 1ª gravidez:
A mãe é Rh negativa e o feto é Rh positivo na 1ª gestação, o que desencadeia a formação de anticorpos maternos (IgM). Este cenário não afeta o 1º bebé.
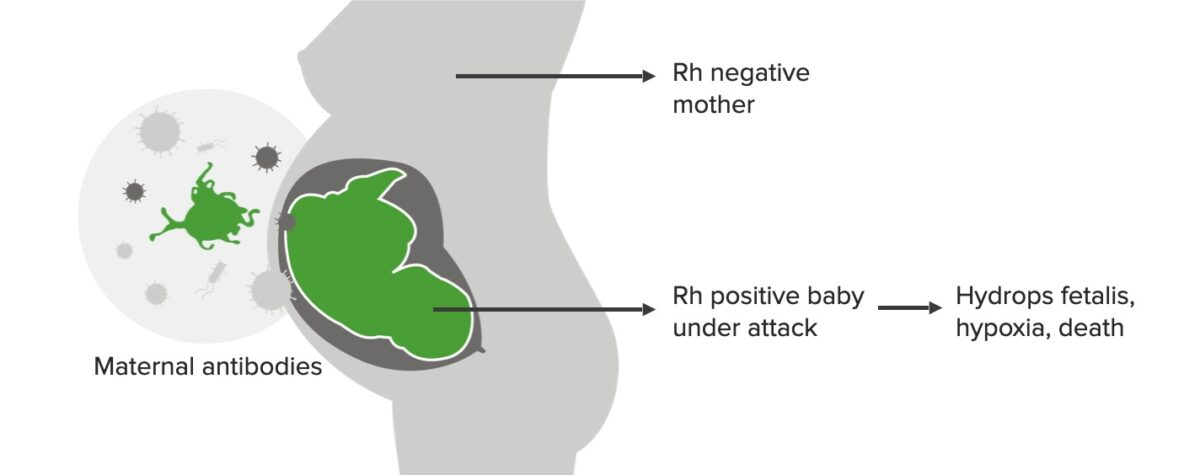
Incompatibilidade Rh, 2ª gravidez:
Embora o primeiro bebé não seja afetado, nessa altura, desenvolveram-se anticorpos maternos IgG, que atacam o feto se for Rh positivo. Este cenário pode levar a hidropsia fetal, hipóxia e morte.
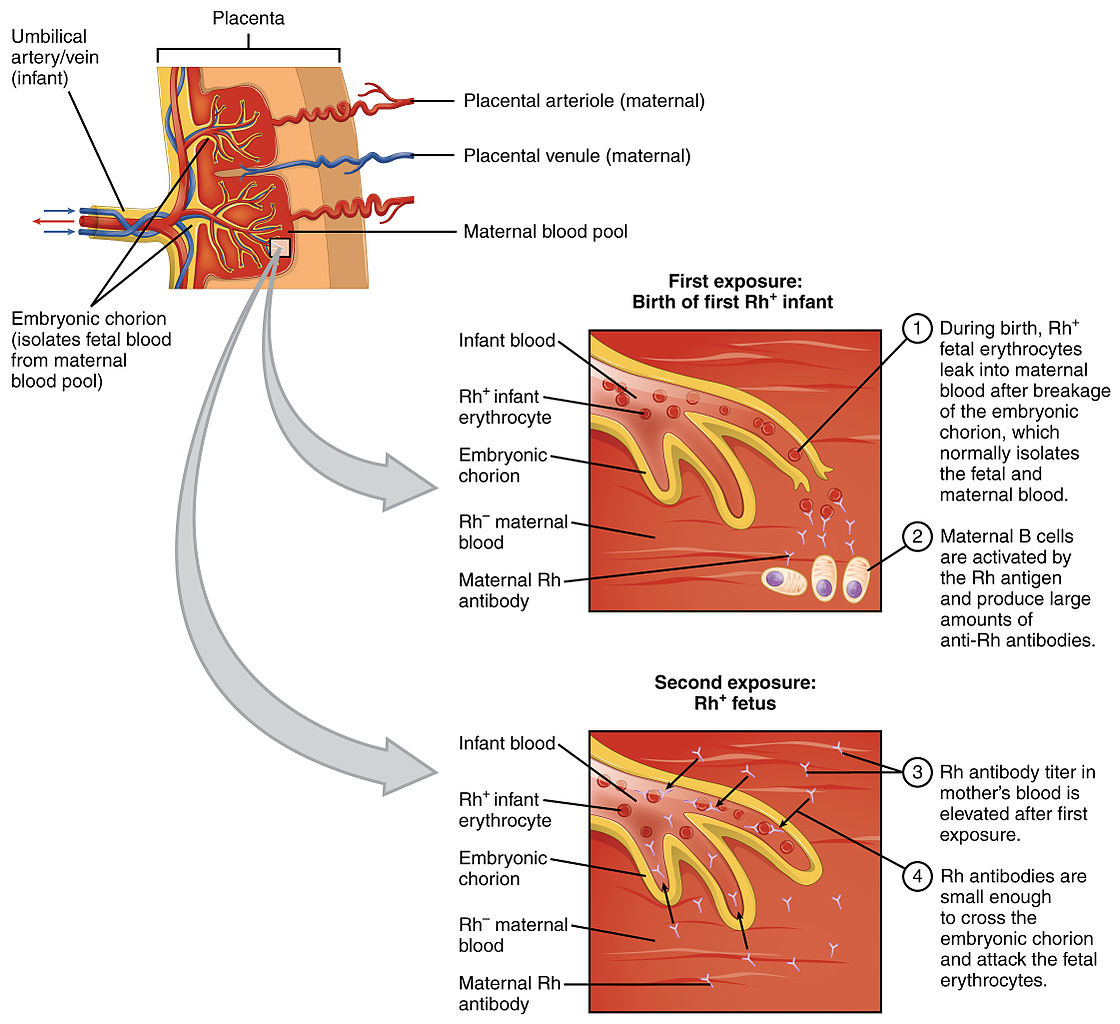
Fisiopatologia da incompatibilidade de Rhesus durante a gravidez
Imagem : “Eritroblastose Fetal” pelo OpenStax College. Licença: CC BY 3.0A ecografia pode mostrar evidência de hidropsia fetal, uma condição com risco de vida na qual os fetos têm uma acumulação anormal de líquido no corpo. Os achados na ecografia compatíveis com hidropsia fetal imune podem incluir:
Doença ligeira a moderada:
Doença grave:
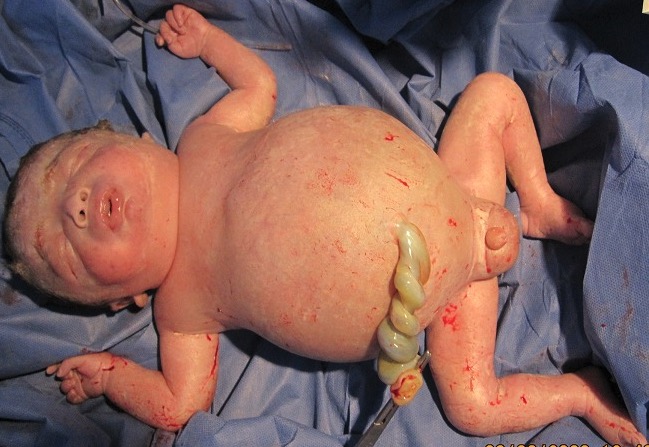
Hidropsia fetal num recém-nascido, nascido de mãe Rhesus-negativo sem prevenção adequada:
Observe o edema generalizado.
É importante identificar os potenciais fatores de risco para sensibilização desconhecida e história prévia de DHFRN durante a gravidez. Potenciais incompatibilidades sanguíneas incluem:
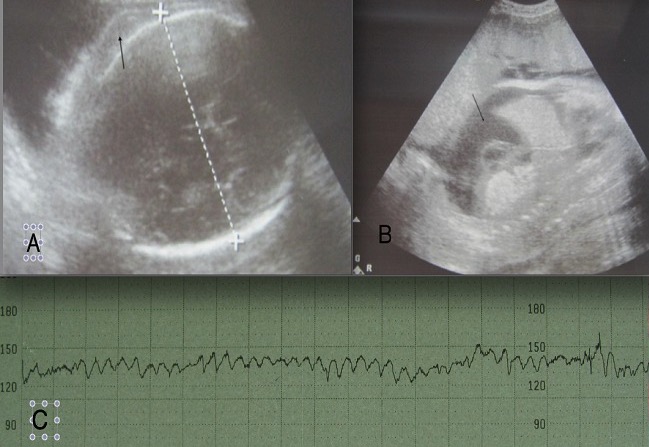
Diagnóstico de doença hemolítica do feto e do recém-nascido
A: imagem ecográfica da cabeça do feto mostrando edema do couro cabeludo (seta); B: ecografia mostrando ascite (seta) em corte sagital do abdómen; C: padrão sinusoidal da frequência cardíaca fetal observado em pacientes com anemia grave
As incompatibilidades RhD são as únicas formas de aloimunização que podem ser prevenidas.
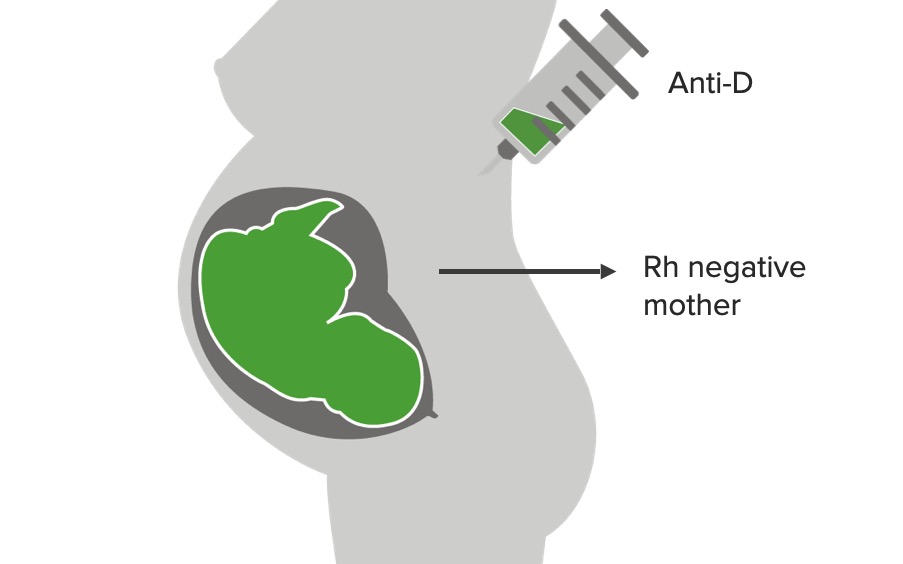
Prevenção da sensibilização usando imunoglobulina anti-D (RhoGAM):
O Anti-D liga-se aos antigénios Rh negativos na circulação da mãe para evitar a sensibilização e o desenvolvimento de resposta imune/formação de anticorpos versus Rh negativo.
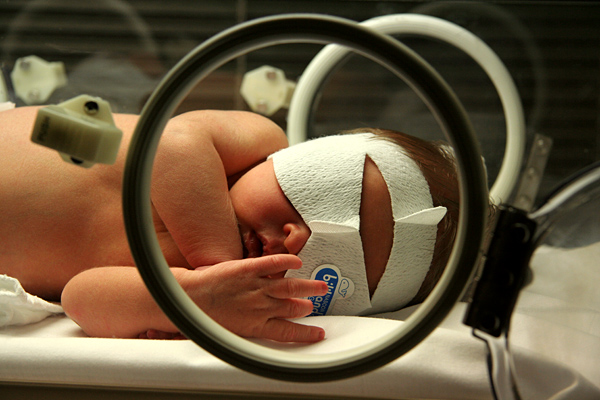
Imagem de icterícia neonatal: recém-nascido em fototerapia
Imagem: “Jaundice phototherapy” por Martin Pot. Licença: CC BY 3.0