A distrofia muscular de Duchenne (DMD) é uma doença genética recessiva ligada ao cromossoma X, causada por uma mutação no gene DMD. Esta mutação leva a uma produção anormal de distrofina, o que resulta na destruição e substituição das fibras musculares em tecido adiposo ou fibroso. Os indivíduos afetados apresentam-se com fraqueza muscular proximal progressiva, que pode levar à perda da marcha, assim como contraturas musculares, escoliose, miocardiopatia e insuficiência respiratória. Pode-se ainda registar uma elevação acentuada da creatina cinase (CK). O diagnóstico é confirmado com o recurso a testes genéticos. A abordagem terapêutica consiste em medidas de suporte que visam retardar a progressão da doença e das suas complicações. A Distrofia muscular de Duchenne é fatal, apresentando uma esperança média de vida de cerca de 20 anos.
Última atualização: Jun 30, 2022
A Distrofia muscular de Duchenne (DMD) é a distrofia muscular mais comum e mais grave.
A Distrofia muscular de Duchenne resulta de uma mutação no gene da distrofina (DMD) no braço curto do cromossoma X.
Fisiologia normal:
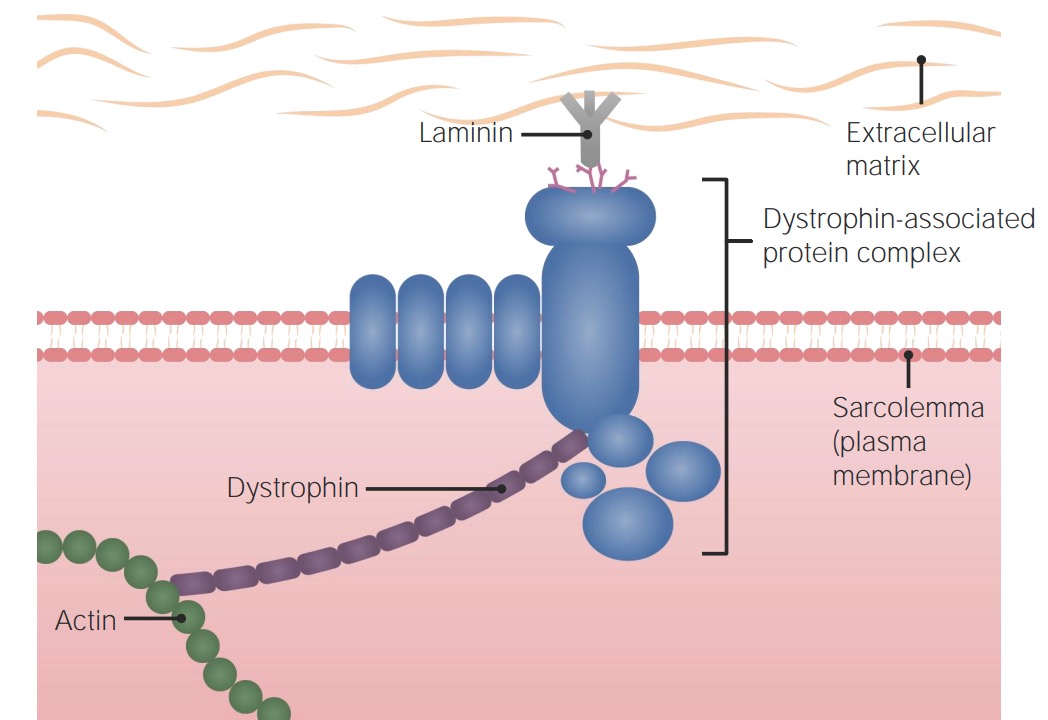
Fisiologia muscular normal:
A proteína da distrofina ajuda na ligação do complexo proteico associado à distrofina (que se conecta à matriz extracelular) ao citoesqueleto da célula muscular.
Fisiopatologia da DMD:
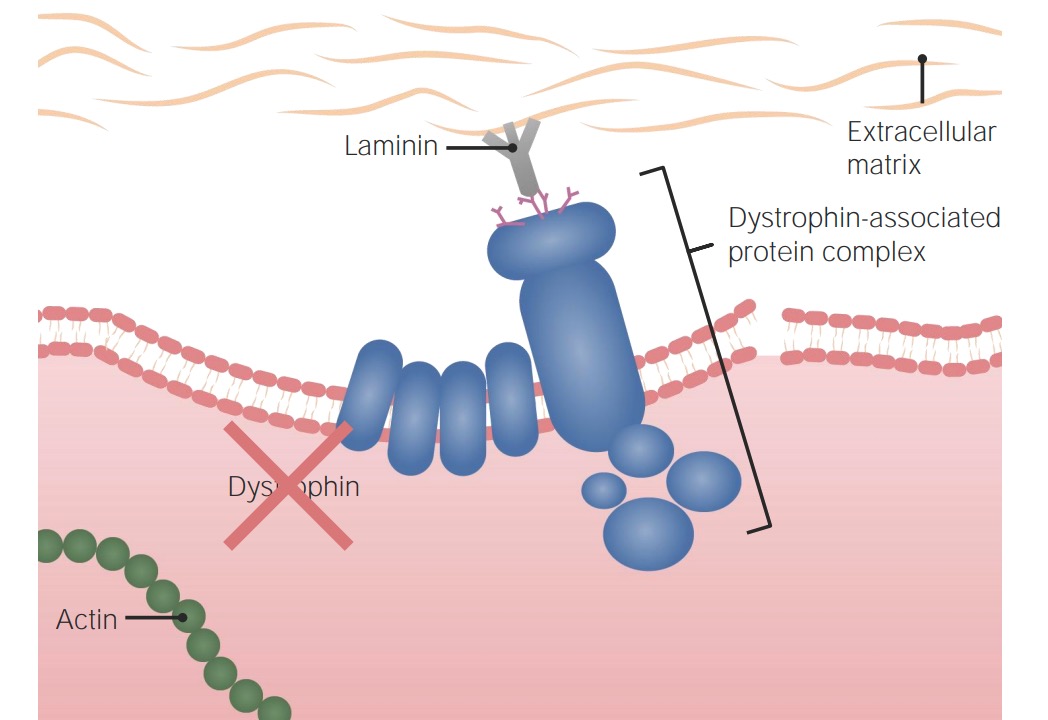
Patogénese da distrofia muscular de Duchenne:
Sem uma proteína da distrofina funcional, a célula não está adequadamente ancorada à matriz extracelular e ao citoesqueleto celular, tornando-a suscetível a dano e morte.
A distrofia muscular de Duchenne apresenta-se como fraqueza muscular progressiva.
Linha temporal:
Evolução clínica:
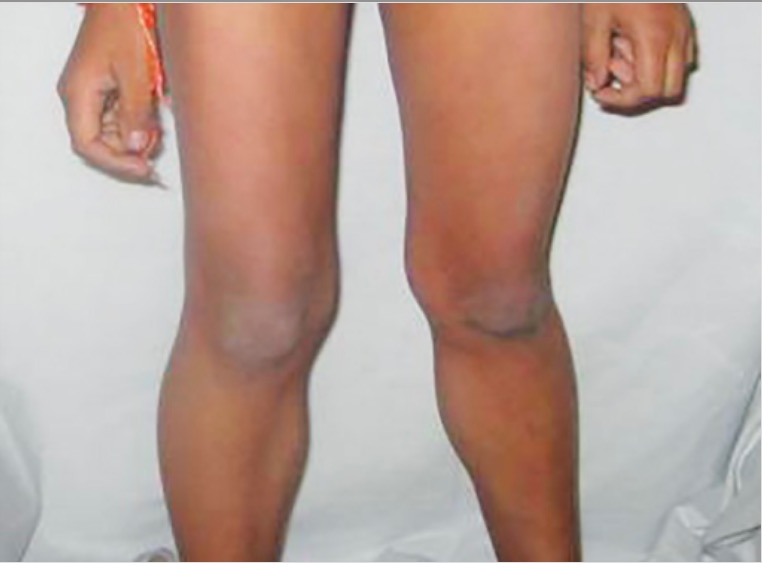
Pseudo-hipertrofia dos músculos gastrocnémios na distrofia muscular de Duchenne
Imagem: “Calf hypertrophy” por Professor, Departamento de Pedodontia e Odontologia Preventiva, Faculdade Dentária BJS, Ludhiana, Punjab, India. Licença: CC BY 3.0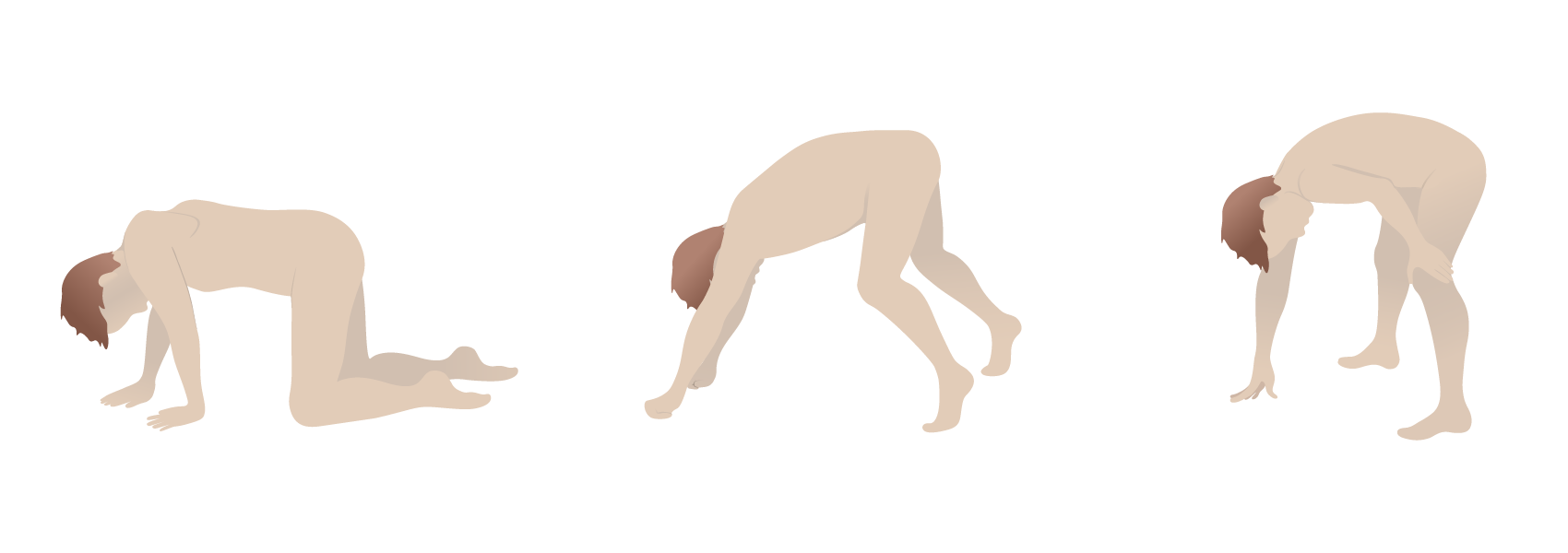
Sinal de Gower na distrofia muscular de Duchenne: devido à fraqueza muscular proximal, recorre-se ao uso dos braços e mãos como apoio para posicionamento em pé
Imagem por Lecturio.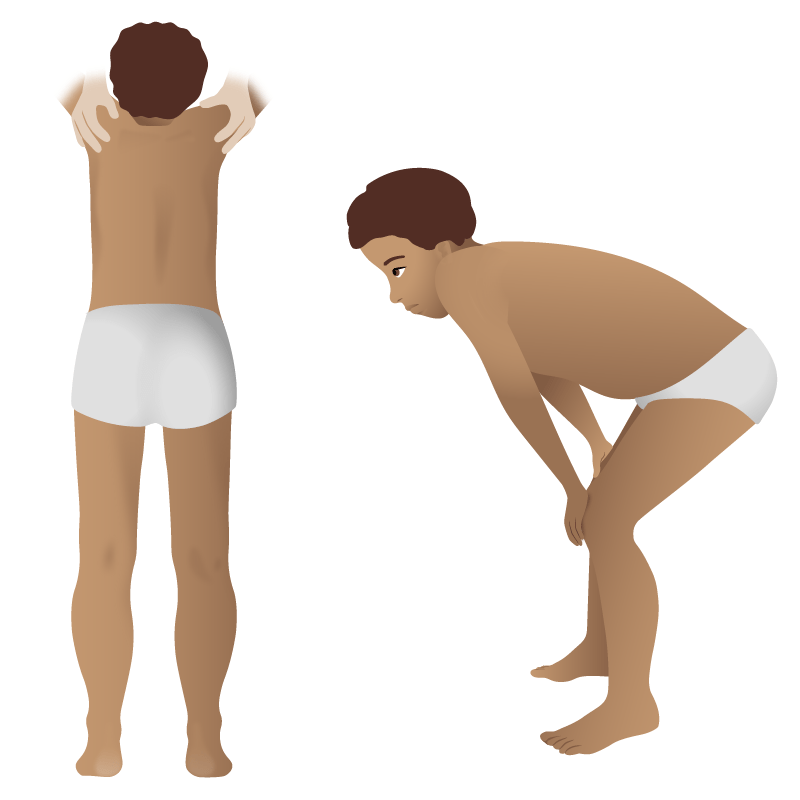
Achados ao exame objetivo na distrofia muscular de Duchenne:
Estas são imagens de um rapaz com fraqueza muscular proximal e pseudohipertrofia dos gastrocnémios.
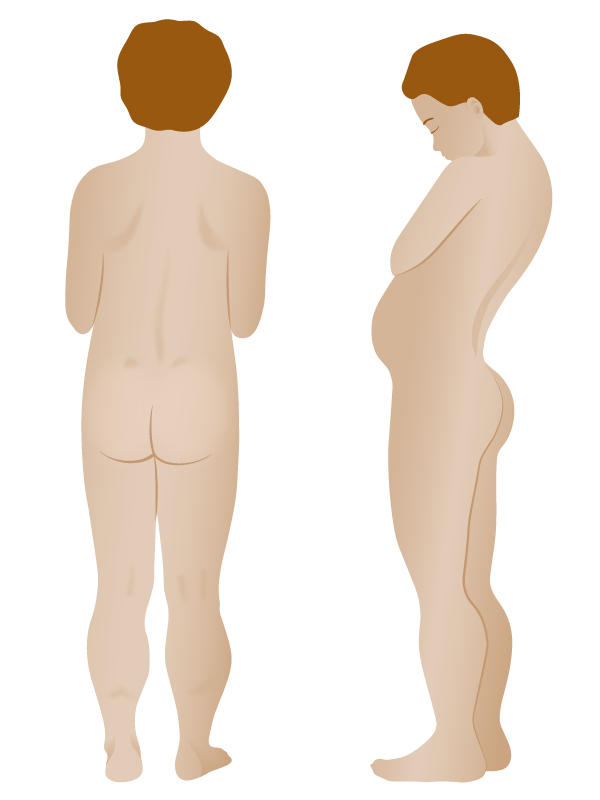
Desenho que mostra achados ao exame objetino na distrofia muscular de Duchenne:
Há desenvolvimento excessivo da região gemelar (pseudohipertrofia)e braços finos. Na figura da direita, a lordose lombar é visível.
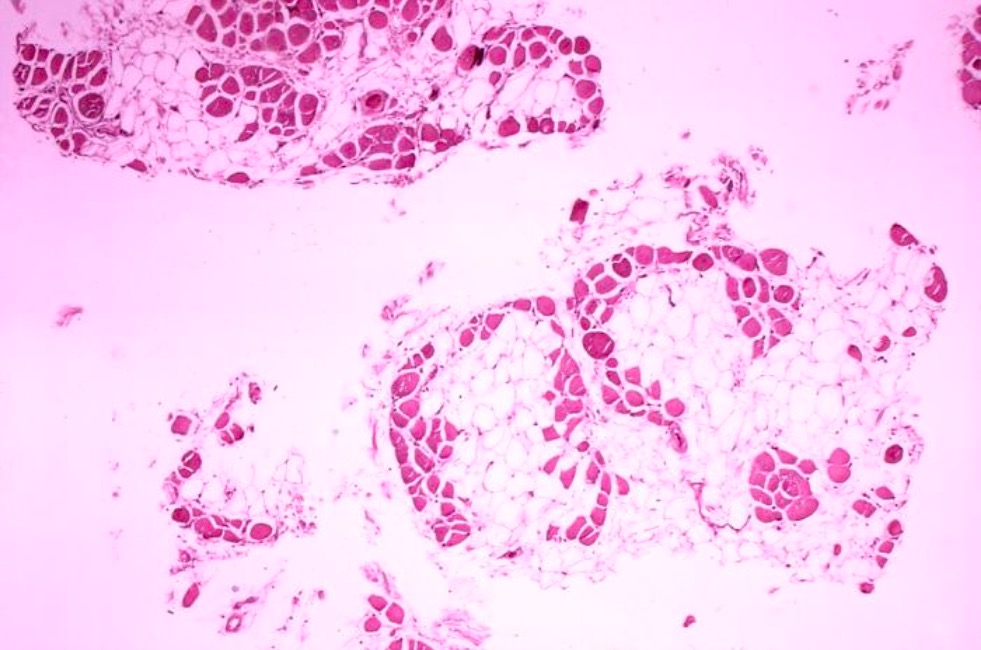
Imagem histológica da biópsia muscular na distrofia muscular de Duchenne:
Substituição significativa das fibras musculares por células adiposas (zonas a claro).
Não existe cura para a DMD. O tratamento é principalmente de suporte e paliativo, muitas vezes orientado pelas preferências individuais.