As proteínas têm uma grande variedade de funções no organismo. As proteínas estruturais ajudam a manter a integridade física das células e permitem o movimento de substâncias no seu interior. As proteínas com função catalítica são enzimas importantes em quase todas as funções biológicas (por exemplo, metabolismo, coagulação, digestão). As proteínas de comunicação, sinalização e regulação, que incluem recetores, hormonas, neurotransmissores, moléculas de sinalização intracelular (como quinases e proteínas G) e fatores de transcrição, são importantes para a coordenação de respostas no organismo. Adicionalmente, as proteínas participam no transporte de substâncias através da corrente sanguínea e das membranas celulares, e desempenham um papel importante no sistema imunológico.
Última atualização: Apr 25, 2025
As proteínas são 1 dos 3 principais macronutrientes utilizados pelo organismo. As proteínas são compostas por aminoácidos (AAs) e apresentam uma grande diversidade de funções no organismo, incluindo:
As proteínas estruturais são importantes para a manutenção da forma e da integridade física celular.
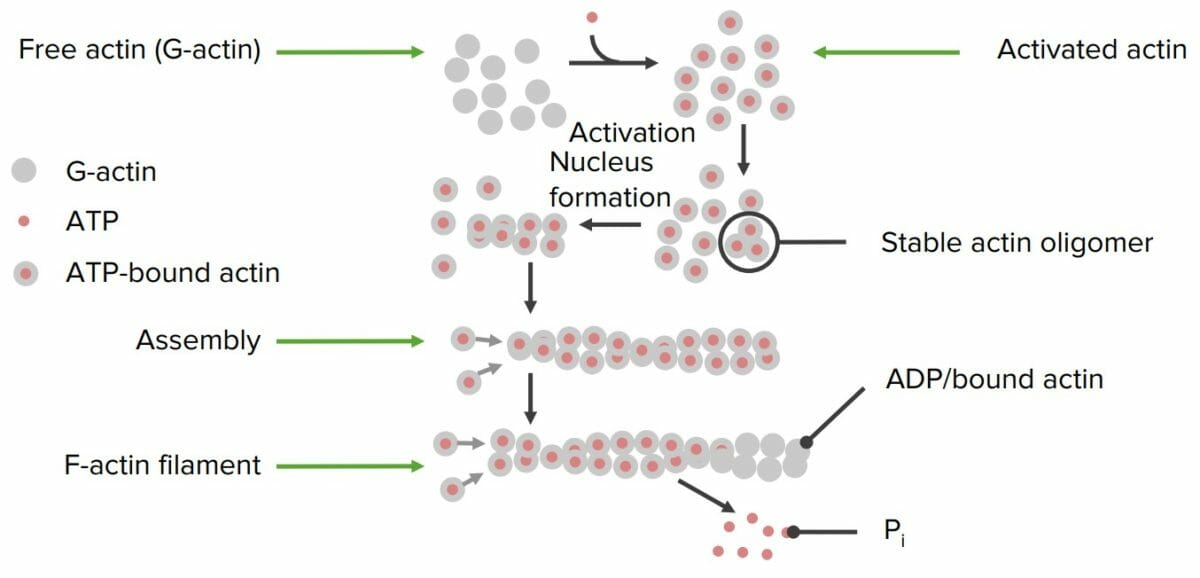
Formação de filamentos de actina a partir de proteínas de actina individuais:
A actina livre é ativada com moléculas de ATP. Ocorre a formação de um núcleo de ativação e inicia-se a polimerização. Uma vez construido o filamento, é libertado um fosfato individual (Pi) das proteínas individuais de actina, que o “desativa”, resultando num filamento final estável. Uma molécula de ADP permanece ligada a cada filamento de actina.
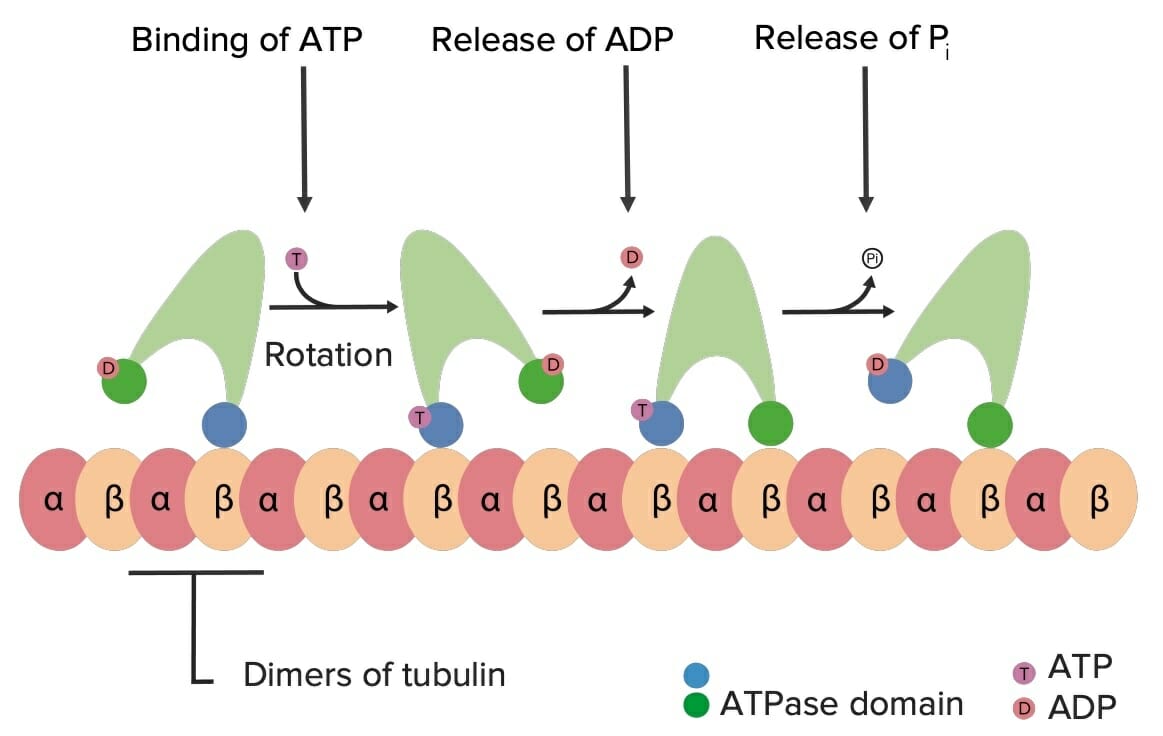
Exemplo da forma como a cinesina se movimenta ao longo dos microtúbulos utilizando a energia da molécula de ATP:
Quando o ATP se liga à cinesina, resulta numa alteração molecular conformacional, que permite que esta “rode” ao longo da tubulina. Isto promove o movimento de “caminhada” da cinesina (e da carga que esta transporta) pelas “estradas” que são os microtúbulos, no interior da célula.
Pi: fosfato
Estas proteínas são responsáveis por:
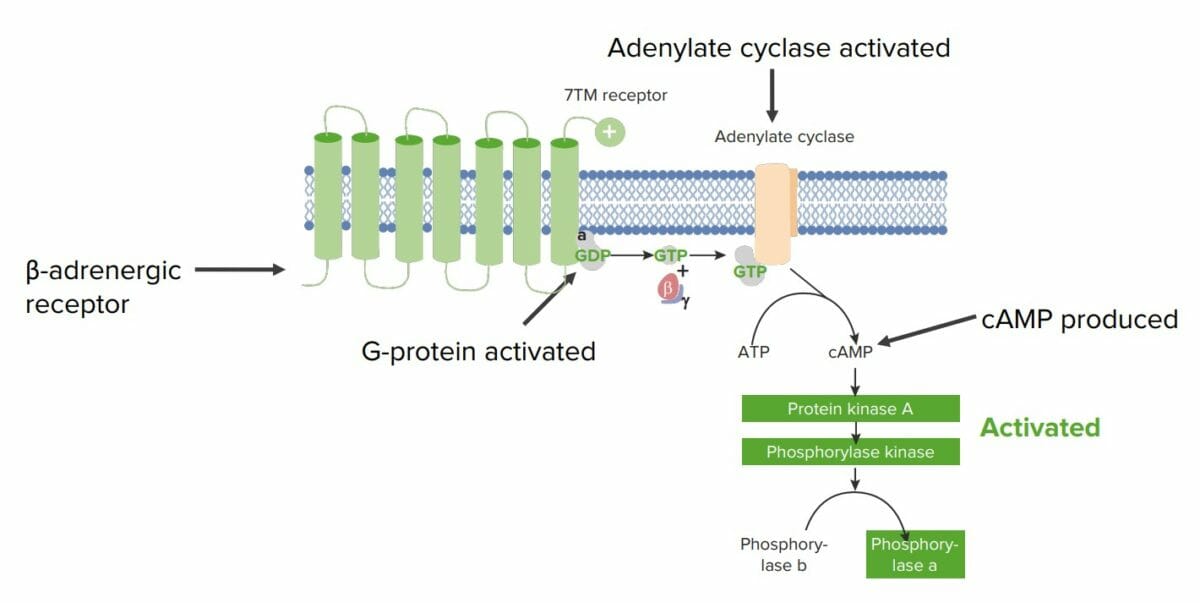
Exemplo da participação das proteínas na sinalização celular num hepatócito:
Os recetores β-adrenérgicos são recetores 7TM ligados à membrana (recetor com 7 domínios transmembranares) que estão associados a uma proteína G no lado citosólico e respondem às catecolaminas circulantes (por exemplo, à epinefrina, uma monoamina derivada dos aminoácidos).
A epinefrina induz uma alteração conformacional no recetor, que ativa a proteína G.
A proteína G liga-se ao GTP e liberta 2 das suas subunidades (β e 𝝲). A restante unidade α ligada ao GTP ativa outra proteína ligada à membrana, chamada adenilato ciclase.
A adenilato ciclase converte o ATP em AMPc, um segundo mensageiro intracelular frequente. Aqui, o AMPc ativa a proteína quinase A (PKA), que fosforila a fosforilase quinase, ativando-a.
Assim, a fosforilase quinase fosforila a glicogénio fosforilase B, dando origem à glicogénio fosforilase A, capaz de degradar o glicogénio para sintetizar moléculas de glicose.
Neste exemplo, a molécula sinalizadora (epinefrina) desencadeou a formação de um 2.º mensageiro intracelular e depois uma cascata de fosforilação, resultando na libertação de glicose do hepatócito.
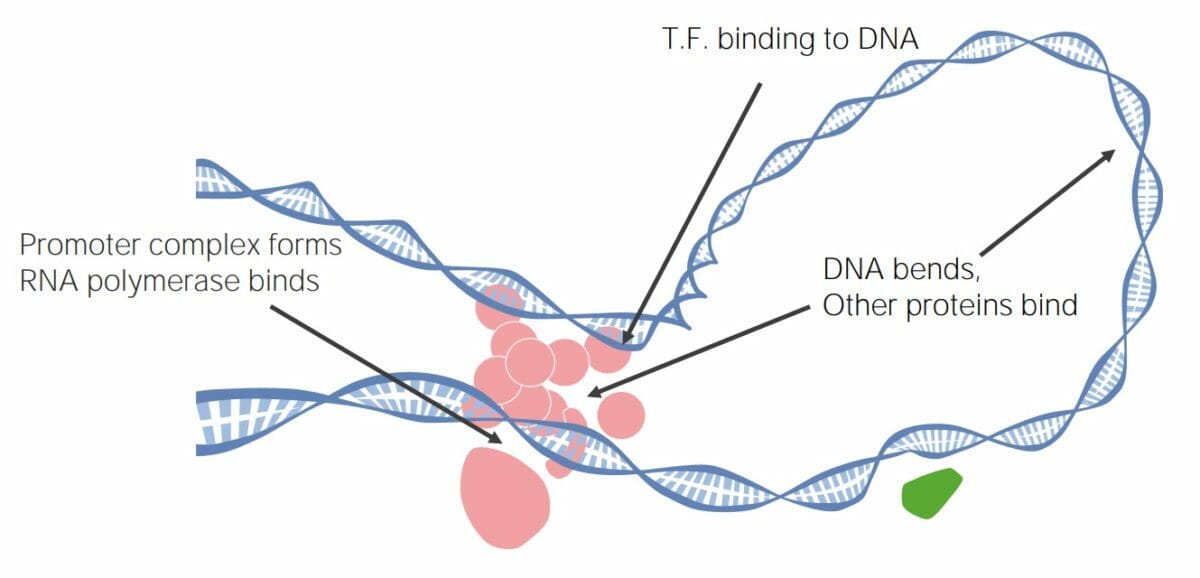
Os fatores de transcrição (TFs, pela sigla em inglês) podem se ligar ao DNA, criando grandes complexos de transcrição que promovem ou inibem a transcrição, regulando a expressão genética.
Imagem por Lecturio.Existem 2 modelos principais que ajudam a explicar o funcionamento enzimático:
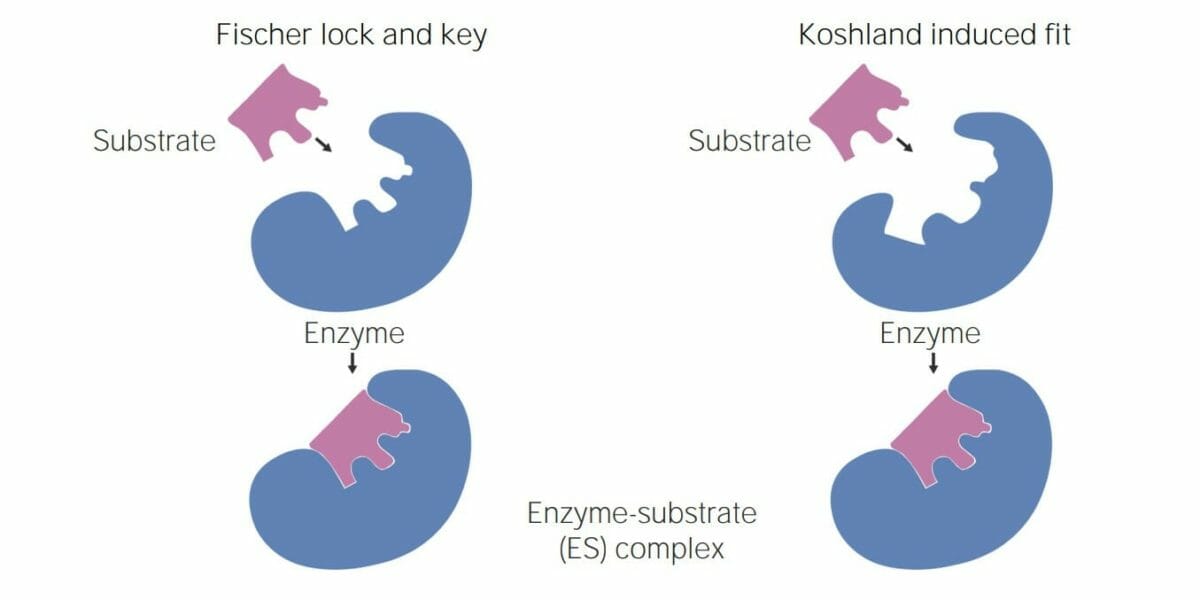
A imagem apresentada representa os 2 modelos da interação enzima-substrato
Imagem por Lecturio.Outra função importante das proteínas é transportar e/ou armazenar biomoléculas, incluindo substâncias como o oxigénio, vitaminas e minerais, hormonas e muitas outras.
As proteínas circulantes transportam as substâncias pelo sangue e/ou espaços intersticiais; alguns exemplos incluem:
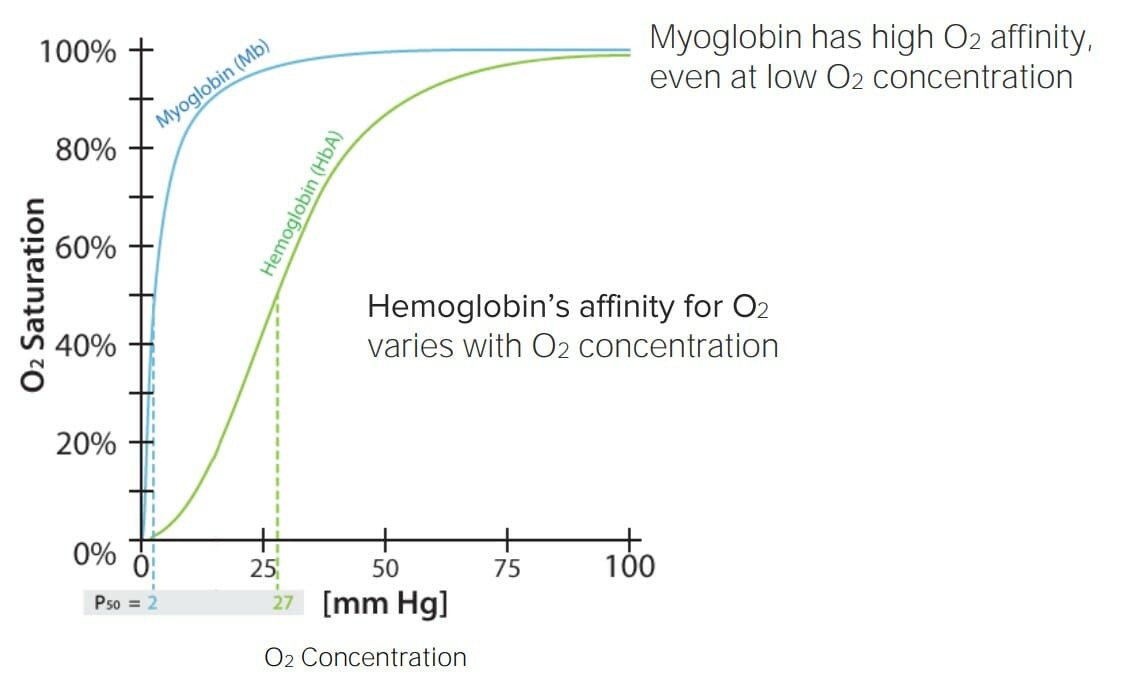
Afinidade da hemoglobina e da mioglobina para o oxigénio (O2) dependendo da saturação de O2:
Observe a variação da afinidade da hemoglobina consoante a saturação de O2 em circulação. Isto significa que a hemoglobina se ligará, de forma rápida, ao O2 quando a concentração do mesmo for elevada (por exemplo, durante a inspiração a nível pulmonar), mas a libertará rapidamente quando a saturação for baixa (por exemplo, nos tecidos).
Isto torna a hemoglobina uma excelente molécula de transporte do O2. Por outro lado, a mioglobina tem uma alta afinidade pelo O 2, independentemente da saturação de O 2 circundante, o que significa que esta associa-se rapidamente ao O2 e não o liberta até que a saturação de O 2 em circulação seja próxima de 0. Este facto faz com que a mioglobina seja uma excelente molécula de armazenamento de O2.
P50: pressão com a qual 50% das moléculas (hemoglobina ou mioglobina) estão saturadas com O2. Imagem por Lecturio.
As proteínas de ligação à membrana são responsáveis pelo movimento de substâncias através da membrana celular. Alguns exemplos são:
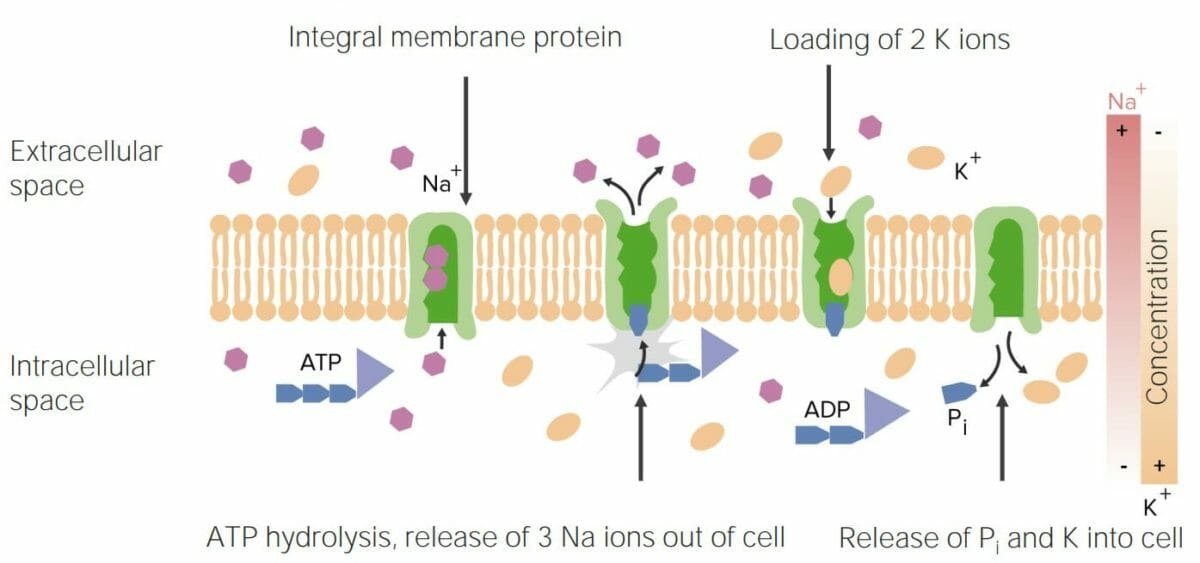
A imagem apresentada mostra o funcionamento do transportador Na/K-ATPase, que constitui uma função importante das proteínas
Pi: fosfato
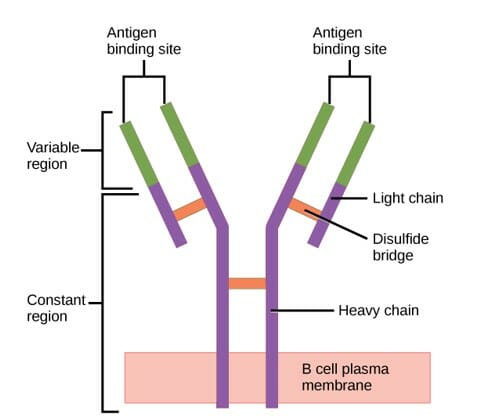
Estrutura do anticorpo (regiões):
O anticorpo apresenta uma região variável única (formada por cadeias pesadas e leves) capaz de se ligar a um antigénio diferente e uma região constante (formada por cadeias pesadas).
Existem 5 classes diferentes de imunoglobulinas:
Monómero IgD
Imagem: “Five classes of antibodies” por OpenStax. Licença: CC BY 4.0
Monómero IgE
Imagem: “Five classes of antibodies” por OpenStax. Licença: CC BY 4.0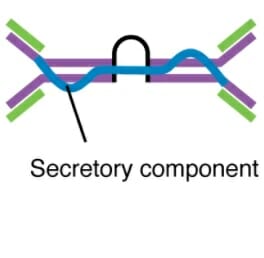
Dímero secretor de IgA
Imagem: “Five classes of antibodies” por OpenStax. Licença: CC BY 4.0
Monómero IgM
Imagem: “Five classes of antibodies” por OpenStax. Licença: CC BY 4.0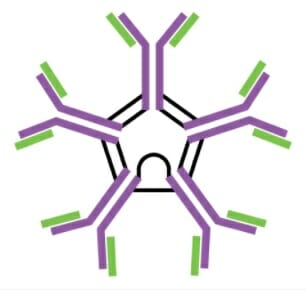
Pentâmero IgM
Imagem: “Five classes of antibodies” por OpenStax. Licença: CC BY 4.0| Pentâmero IgM | Monómero IgG | Dímero secretor de IgA | Monómero IgE | Monómero IgD | |
|---|---|---|---|---|---|
| Cadeias pesadas | μ | γ | α | ε | δ |
| Número de locais de ligação ao antigénio | 10 | 2 | 4 | 2 | 2 |
| Peso molecular (daltons) | 900,000 | 150,000 | 385,000 | 200,000 | 180,000 |
| Percentagem total de anticorpo no sangue | 6% | 80% | 13% | 0.002% | 1% |
| Atravessa a placenta | Não | Sim | Não | Não | Não |
| Fixa o complemento | Sim | Sim | Não | Não | Não |
| A região “Fc” liga-se a | Fagócitos | Mastócitos e basófilos | |||
| Função | Anticorpo principal envolvido nas respostas primárias, o melhor na fixação do complemento; a forma sob monómero da IgM serve como recetor das células B | Anticorpo sanguíneo principal envolvido nas respostas secundárias, neutraliza as toxinas, opsonização | Secretadas no muco, lágrimas, saliva, colostro | Anticorpo com atividade alérgica e antiparasitária | Recetor das células B |
Existem diversas patologias que são causadas por anomalias ou défices de proteínas e/ou anomalias no seu metabolismo. Alguns exemplos encontram-se listados abaixo.