A cinética enzimática é o estudo das taxas de reações catalisadas por enzimas e quais os fatores que afetam a velocidade das reações enzimáticas. Estes parâmetros muitas vezes incluem a temperatura, o pH e a concentração de substrato. A relação destes parâmetros com a velocidade da reação pode ser modelada matematicamente permitindo compreender quais as condições ideiais para uma reação enzimática particular e potenciais mecanismos de controlo fisiológicos.
Última atualização: Apr 23, 2025
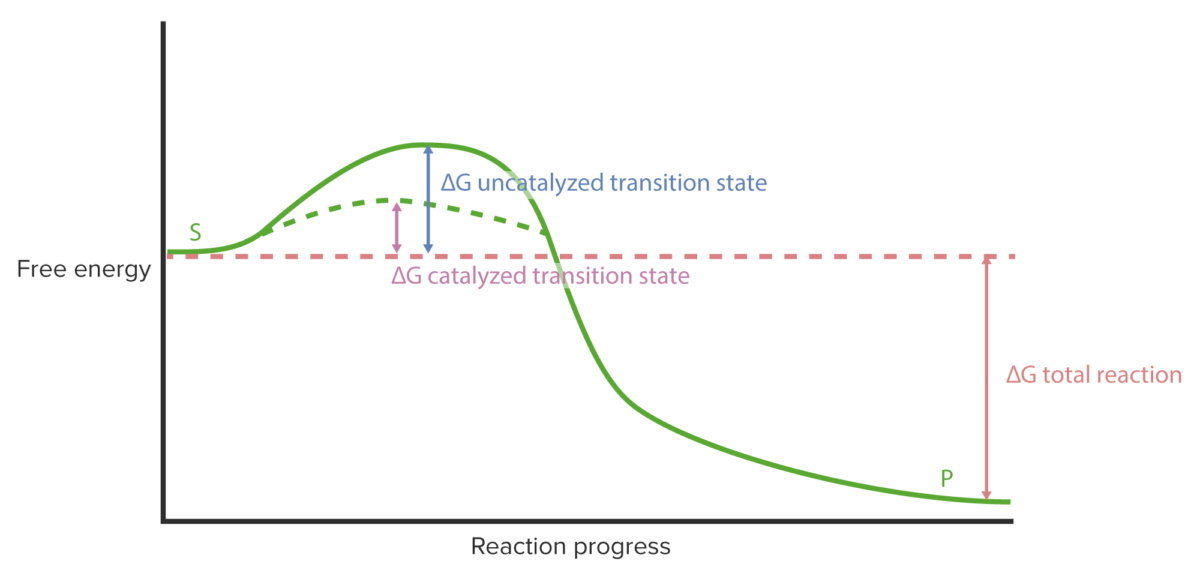
Cinética enzimática: curva de progresso da reação
Imagem por Lecturio.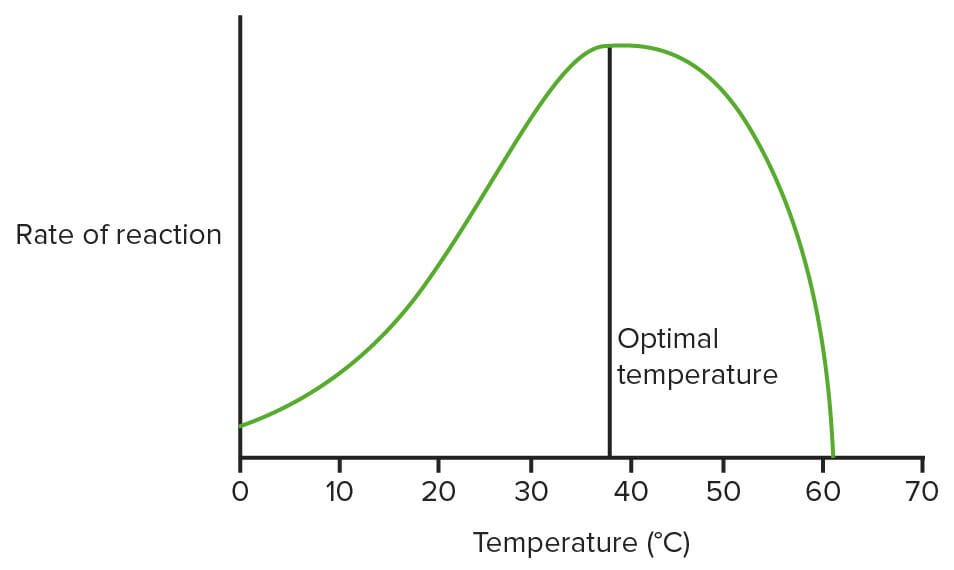
Gráfico que mostra o efeito da temperatura sobre as enzimas:
Não usa dados reais, apenas um diagrama para mostrar qual é o padrão geral. (Temperatura ideal = 37.5°C aqui)
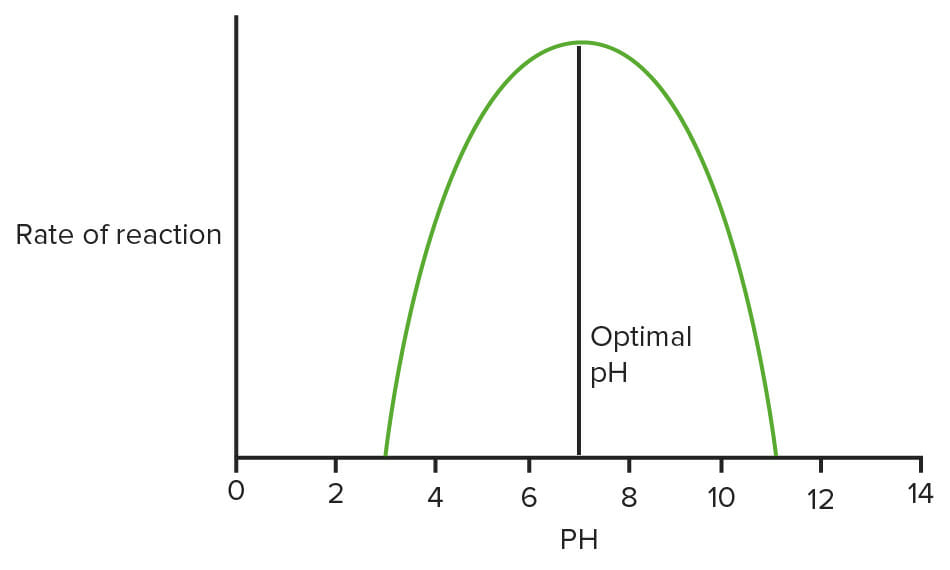
Gráfico que mostra o efeito do pH nas enzimas
Imagem: “Effect of temperature on enzymes” por domdomegg. Licença: CC BY 4.0, editada por Lecturio.Condições de estado estacionário
Variações precoces nas concentrações de S, enzima (E), complexo enzima-substrato (ES) e P mudam drasticamente e são difíceis de medir. O estado estacionário ocorre quando as variações em E e ES são relativamente pequenas.
Taxa de reação inicial (V o )
A velocidade inicial da reação é usada para evitar a medição da reação inversa, uma vez que tenha sido feito produto suficiente.
Gráfico Michaelis-Menten
Traçar a taxa de reação inicial (V 0 ) no eixo y contra a concentração de substrato no eixo x num gráfico resulta numa curva hiperbólica, que se aproxima da velocidade máxima V max em altas concentrações de substrato devido à saturação da enzima com substrato.
Constante de Michaelis-Menten (K M )
K M é a concentração de substrato na qual é alcançada metade da velocidade máxima (½ V max ) (K M é medido no eixo x enquanto ½ V max é medido no eixo y).
Trama Lineweaver-Burke
É traçado 1/V 0 no eixo y e 1 / [S] no eixo x, que resulta num gráfico linear dos mesmos dados usados na cinética de Michaelis-Menten.
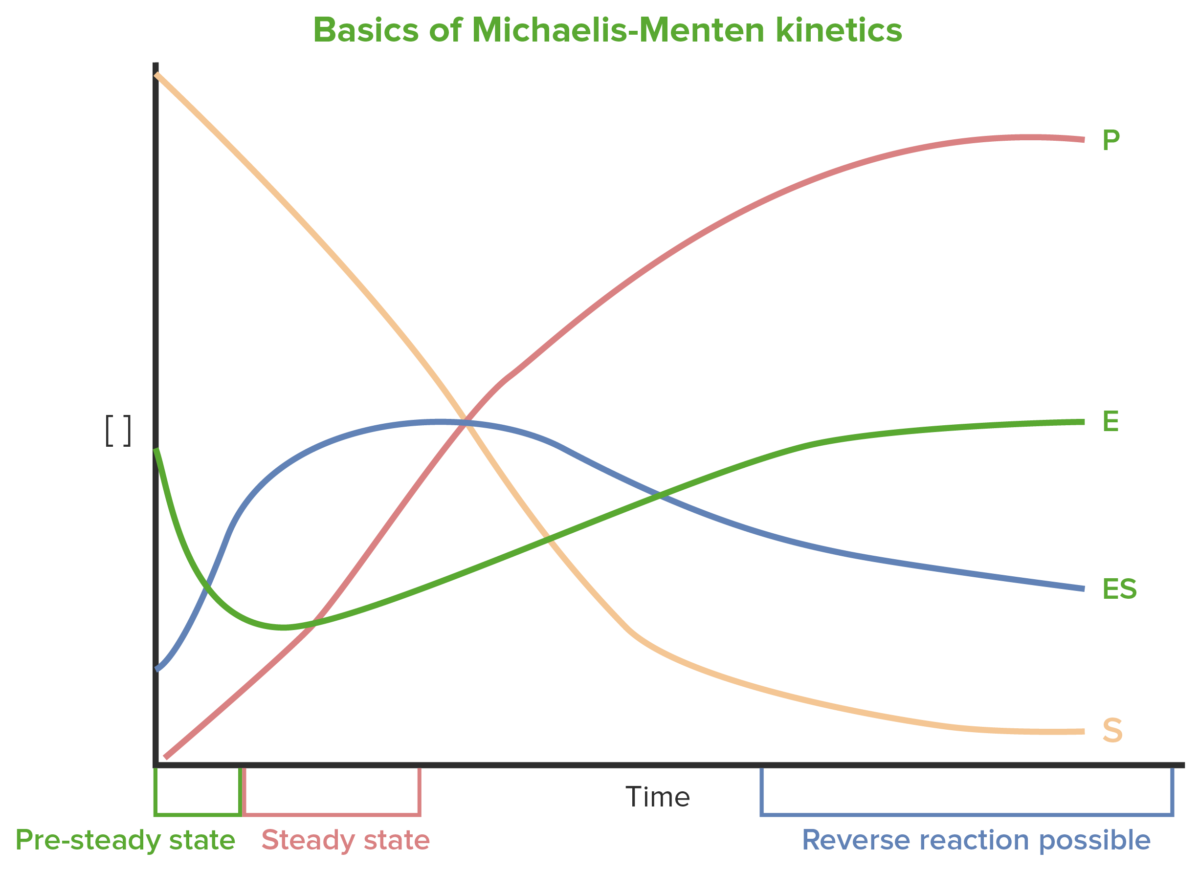
Bases da cinética de Michaelis-Menten
Imagem por Lecturio.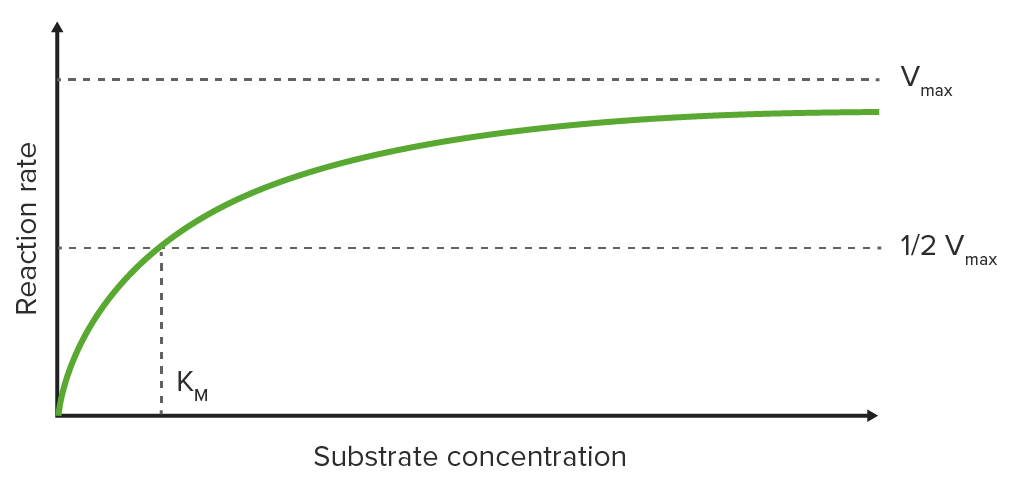
Curva de saturação para uma reação enzimática que mostra a relação entre a concentração do substrato e a taxa de reação
Imagem: “Michaelis Menten curve 2” por Thomas Shafee. Licença: CC BY 4.0, editada por Lecturio.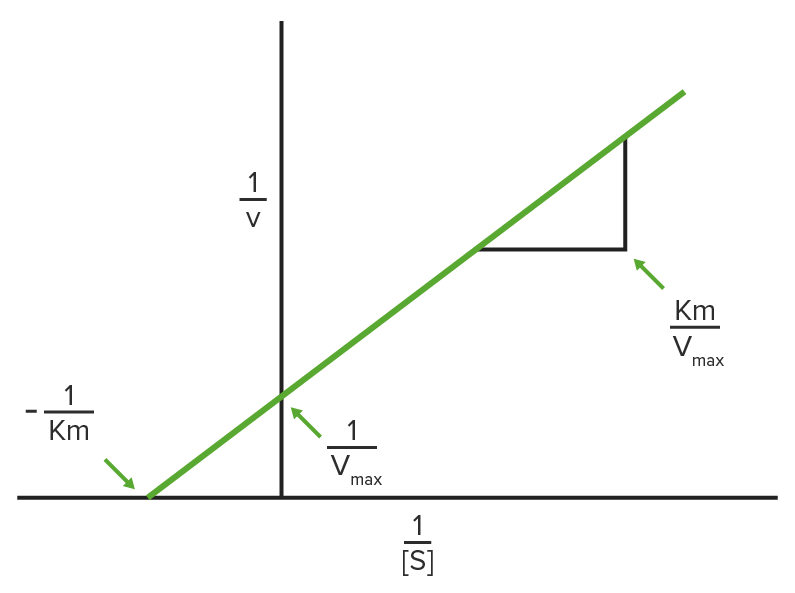
Bases da cinética de Michaelis-Menten
Imagem por Lecturio.