La cinética enzimática es el estudio de las velocidades de reacción catalizadas por enzimas y de los factores que afectan a las velocidades de reacción enzimática. Estos parámetros suelen incluir la temperatura, el pH y la concentración de sustrato. La relación de estos parámetros con la velocidad de reacción puede modelarse matemáticamente, lo que permite conocer las condiciones ideales para una determinada reacción enzimática y los posibles mecanismos de control fisiológico.
Última actualización: Abr 23, 2025
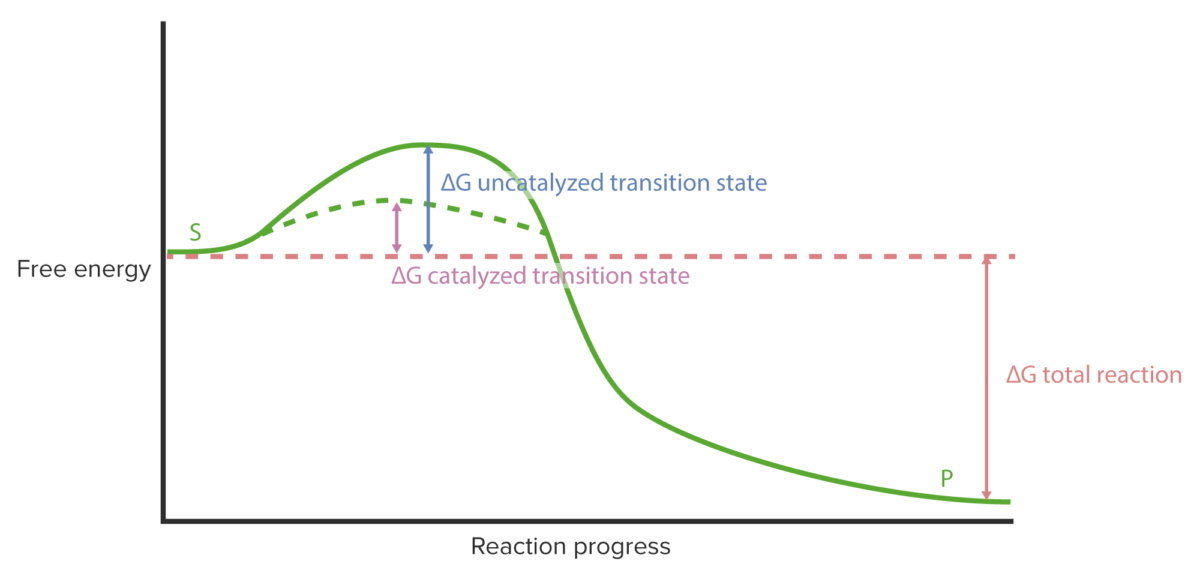
Cinética enzimática: curva de progreso de la reacción
Imagen por Lecturio.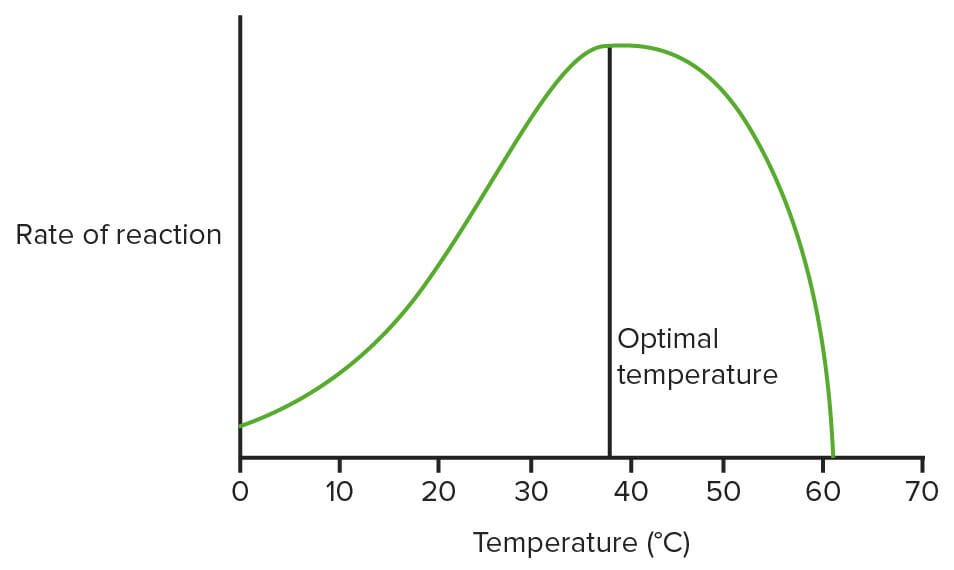
Gráfico que muestra el efecto de la temperatura sobre las enzimas:
Este no está utilizando datos reales, solo un diagrama para mostrar cuál es el patrón general. (Temperatura óptima = 37,5°C aquí)
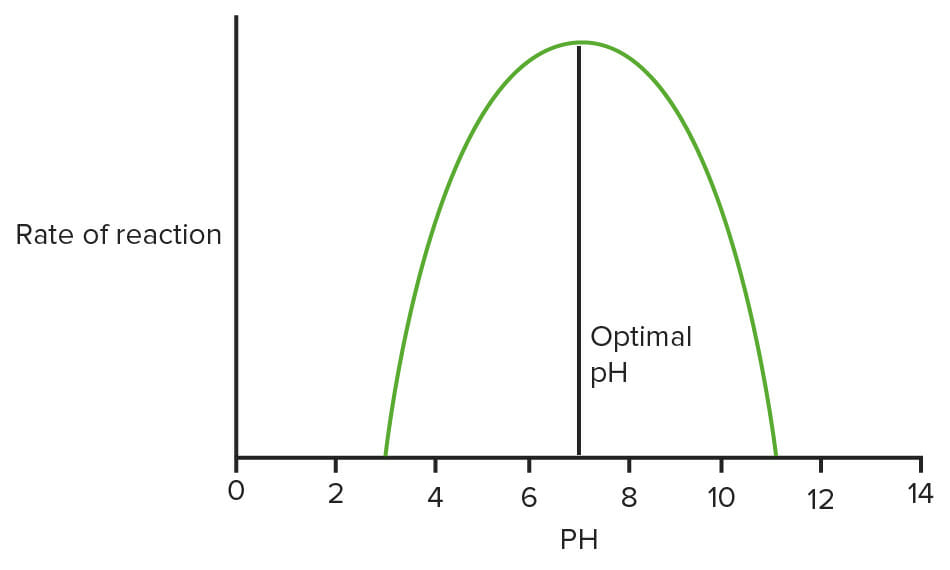
Gráfico que muestra el efecto del pH sobre las enzimas
Imagen: “Effect of temperature on enzymes” por domdomegg. Licencia: CC BY 4.0, editado por Lecturio.Condiciones de estado estable
Los primeros cambios en las concentraciones de sustrato, enzima, complejo enzima-sustrato y el producto ocurren drásticamente y son difíciles de medir. El estado estacionario ocurre cuando los cambios en la enzima y complejo enzima-sustrato son relativamente pequeños.
Velocidad de reacción inicial (Vo)
La velocidad inicial de la reacción se usa para evitar la medición de la reacción inversa una vez que se ha obtenido suficiente producto.
Gráfico de Michaelis-Menten
Trazar la velocidad de reacción inicial (V0) en el eje y opuesto a la concentración de sustrato en el eje x en un gráfico da como resultado una curva hiperbólica, que se acerca a la velocidad máxima Vmax a altas concentraciones de sustrato debido a la saturación de la enzima con sustrato
Constante de Michaelis-Menten (KM)
KM es la concentración de sustrato a la que se alcanza la mitad de la velocidad máxima (½ Vmáx ) (KM se mide en el eje x mientras que ½ Vmáx se mide en el eje y).
Diagrama de Lineweaver-Burke
1/V0 se traza en el eje y, y 1/[S] se traza en el eje x, lo que da como resultado un gráfico lineal de los mismos datos utilizados en la cinética de Michaelis-Menten.
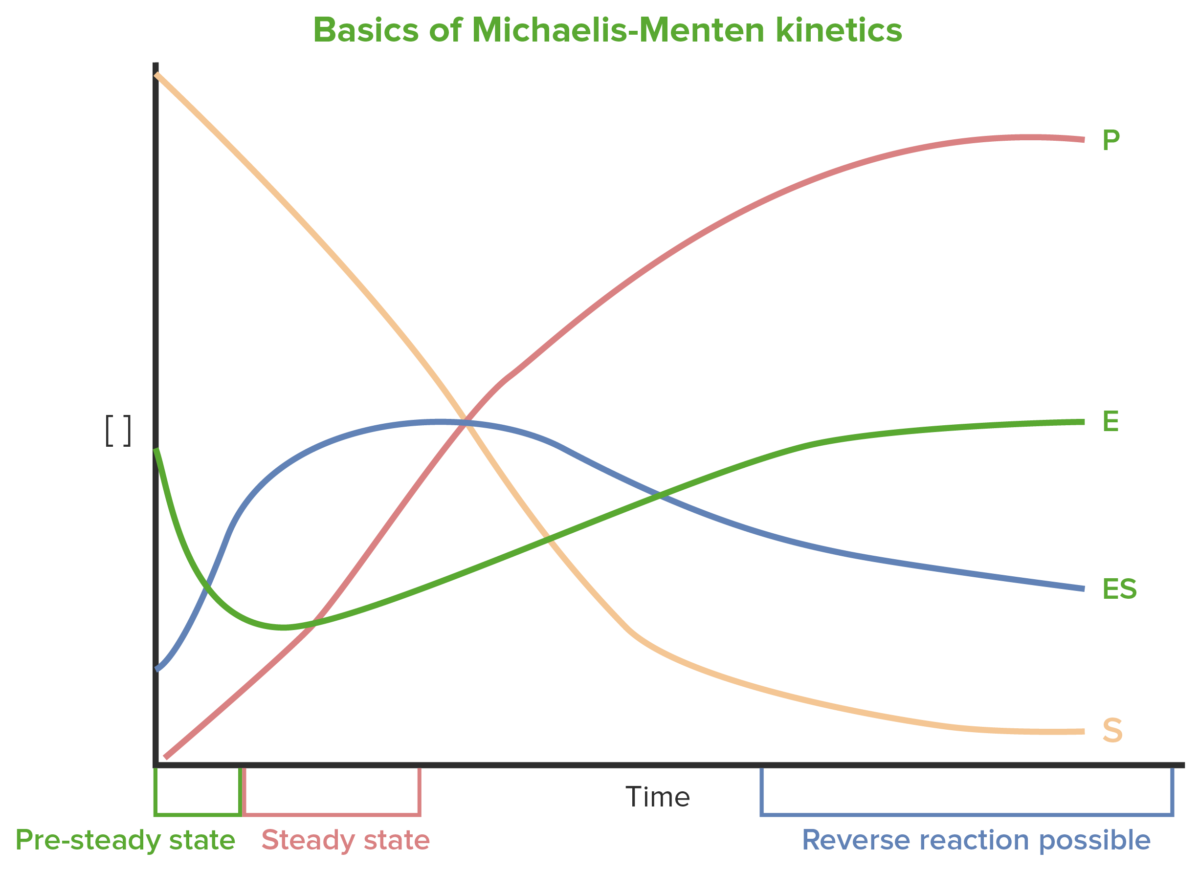
Básicos de la cinética de Michaelis-Menten
Imagen por Lecturio.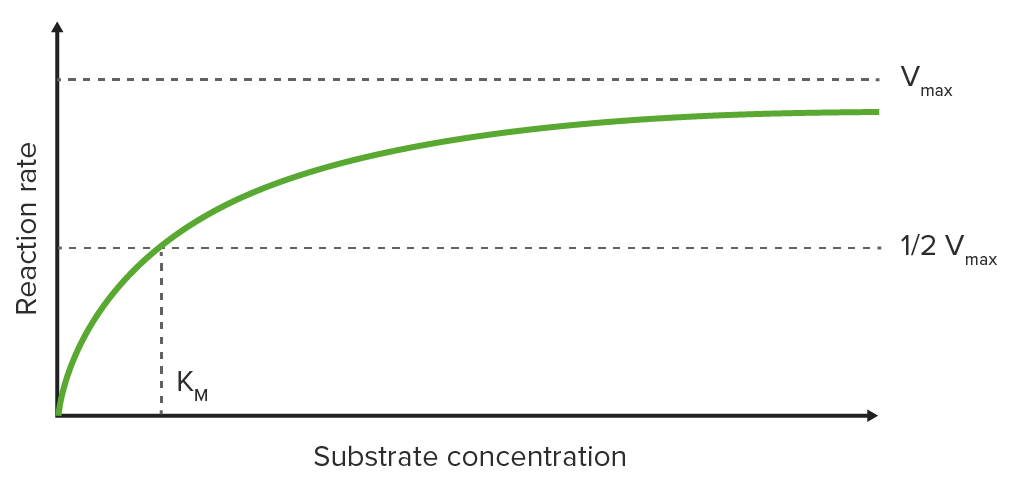
Curva de saturación para una reacción enzimática que muestra la relación entre la concentración de sustrato y la velocidad de reacción
Imagen: “Michaelis Menten curve 2” por Thomas Shafee. Licencia: CC BY 4.0, editado por Lecturio.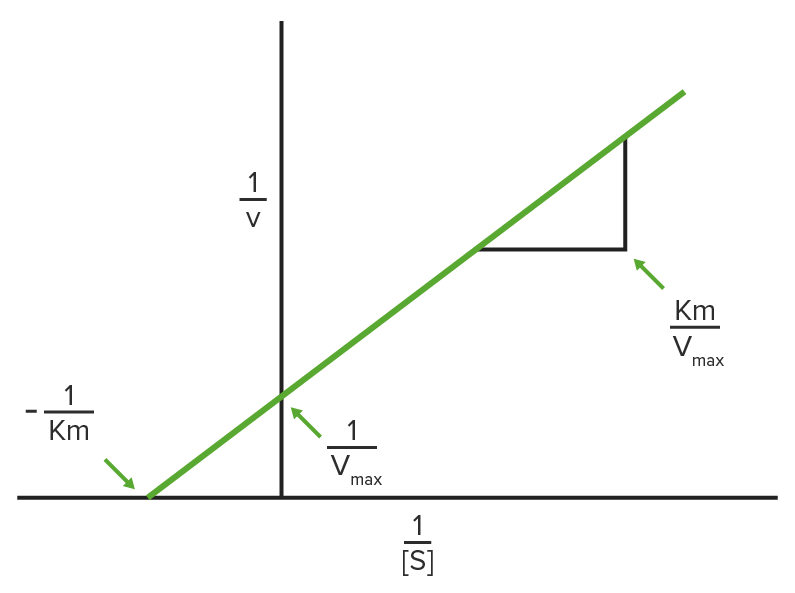
Básicos de la cinética de Michaelis-Menten
Imagen por Lecturio.