O cancro gástrico é a 3.ª causa mais comum de mortes relacionadas com cancro em todo o mundo. A maioria dos casos são adenocarcinomas. Os fatores de risco modificáveis incluem infeção por Helicobacter pylori, tabagismo e dietas ricas em nitratos. Os síndromes hereditários, anemia perniciosa e gastrectomia parcial prévia estão entre os fatores de risco endógenos. Quando ocorrem sintomas como desconforto e plenitude epigástrica, vómitos e perda de peso, é provável que o cancro já esteja num estádio avançado. O diagnóstico é confirmado com esofagogastroduodenoscopia e biópsia da lesão. Os estudos de imagem e a laparoscopia auxiliam na determinação do estádio do tumor. Consequentemente, o estádio dita a abordagem de tratamento. Este consiste na realização de uma gastrectomia e uso de quimiorradioterapia. A maioria dos casos são diagnosticados em fases tardias, o que geralmente confere um mau prognóstico.
Última atualização: Jul 5, 2022
Fatores de risco endógenos:
Fatores de risco exógenos:
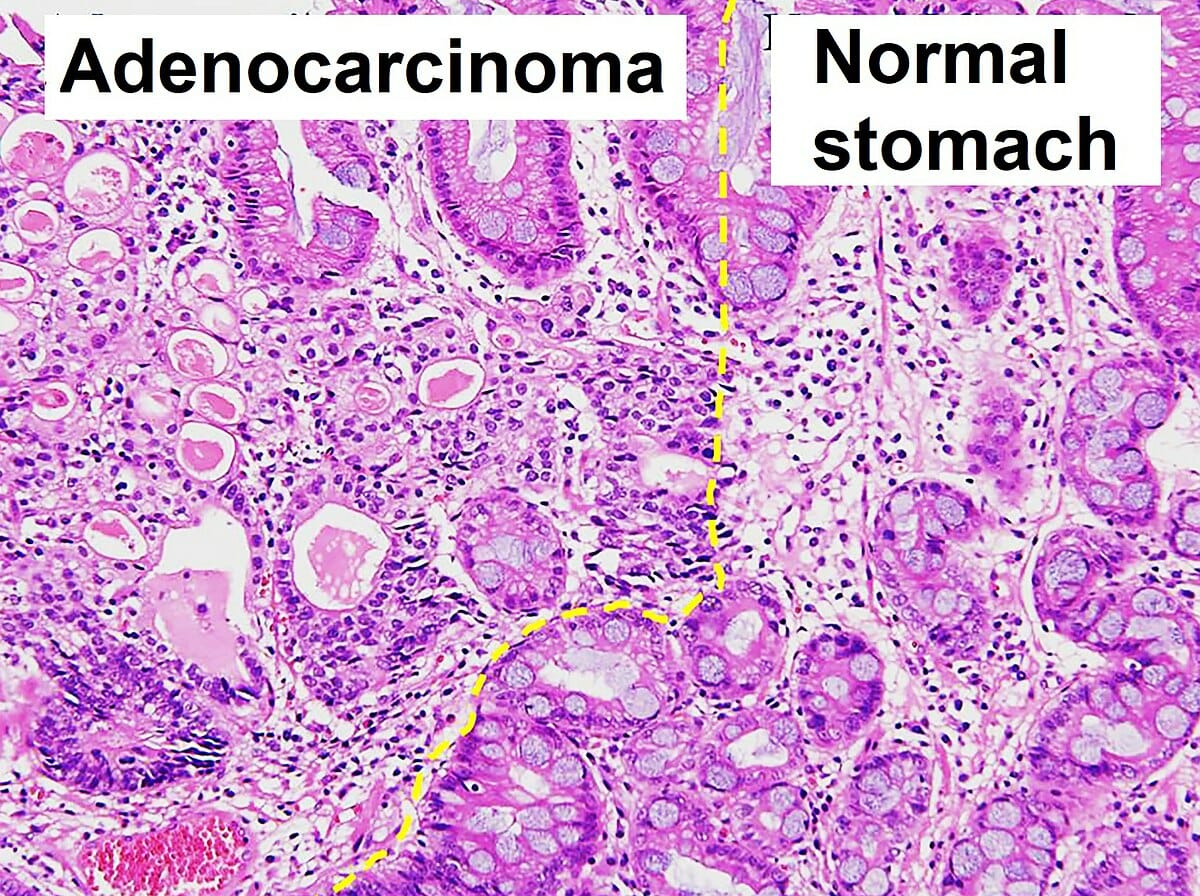
Histopatologia do adenocarcinoma gástrico e histologia normal
Imagem: “Histopathology of gastric adenocarcinoma and normal histology” por Ji Min Choi et al. Licença: CC BY 4.0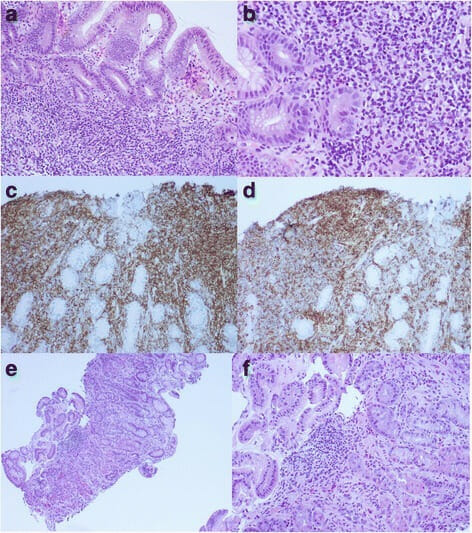
Linfoma gástrico de tecido linfoide associado à mucosa (MALT, pela sigla em inglês) e infeção por Helicobacter pylori:
a. A biópsia gástrica mostra infiltrado linfocítico intralaminar pequeno com características monótonas (coloração H&E, ampliação 100x).
b. Focos de lesão linfoepitelial (coloração H&E, ampliação 200x)
c. Camadas de pequenas células B CD20+ vistas em imunohistoquímica para CD20 (ampliação 200x)
d. A imunohistoquímica também revela expressão aberrante de CD43 (ampliação 200x).
e. A repetição da biópsia gástrica 6 meses após a erradicação de H. pylori mostra escassos infiltrados intralaminares de pequenos linfócitos, plasmócitos e alguns pequenos agregados linfoides soltos, indicando remissão completa (coloração H&E, amplificação 100x).
f. Vêem-se os mesmos achados numa ampliação 200x (coloração H&E).
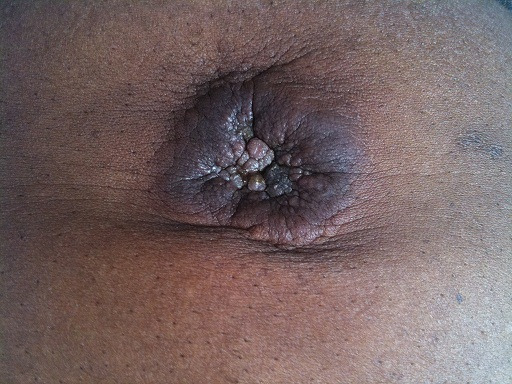
Nódulo Sister Mary Joseph em doente com cancro metastizado do trato gastrointestinal
Imagem: “Sister Mary Joseph nodule” por Touré PS, Tall CT, Dioussé P, Berthé A, Diop MM, Sarr MM, Diop B, Léye YM, Diop BM, Ka MM. License: CC BY 2.0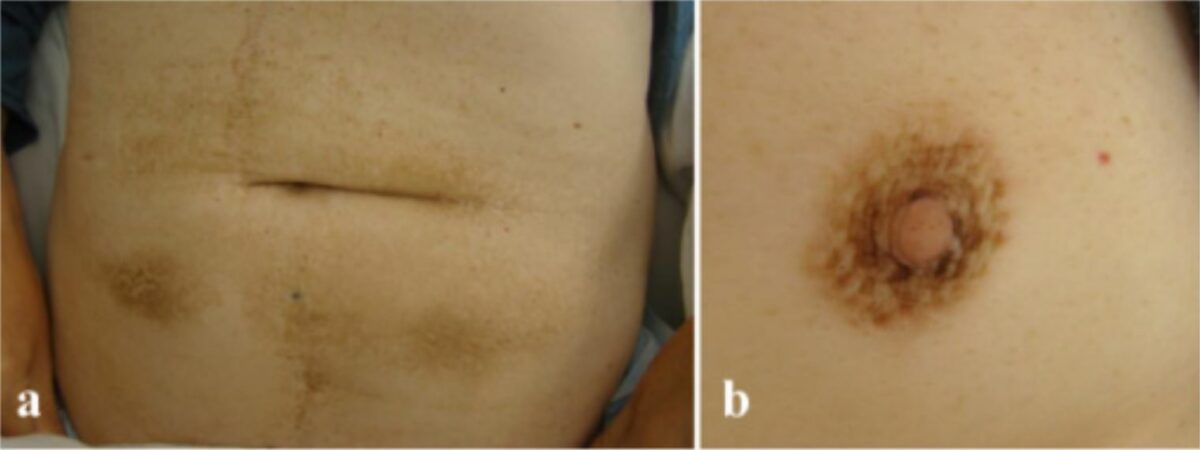
Acantose nigricans no a) abdómen e b) aréola
Imagem: “Malignant acanthosis nigricans associated with prostate cancer” por Kubicka-Wołkowska J, Dębska-Szmich S, Lisik-Habib M, Noweta M, Potemski P. License: CC BY 4.0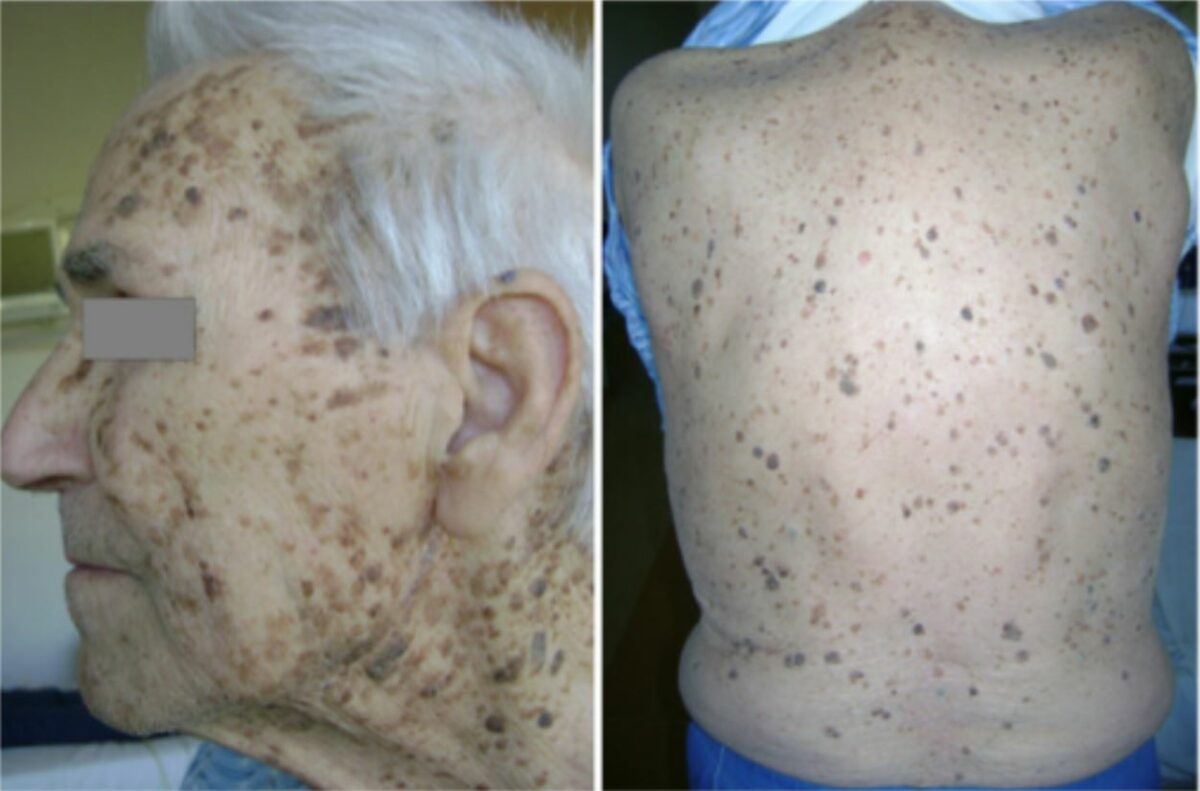
Doente com adenocarcinoma gástrico oculto: inúmeras queratoses seborreicas concentradas na face, pescoço, costas e tórax.
“Leser-Trélat syndrome” por Ponti G, Luppi G, Losi L, Giannetti A, Seidenari S. License: CC BY 2.0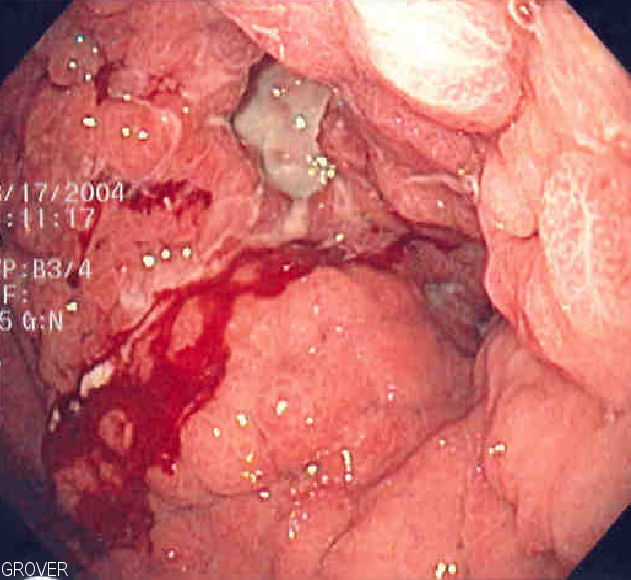
Imagem endoscópica de linitis plastica, onde todo o estômago é invadido por cancro, levando a uma aparência em “garrafa de couro”
Imagem: “Linitis plastica” por Samir. License: Public Domain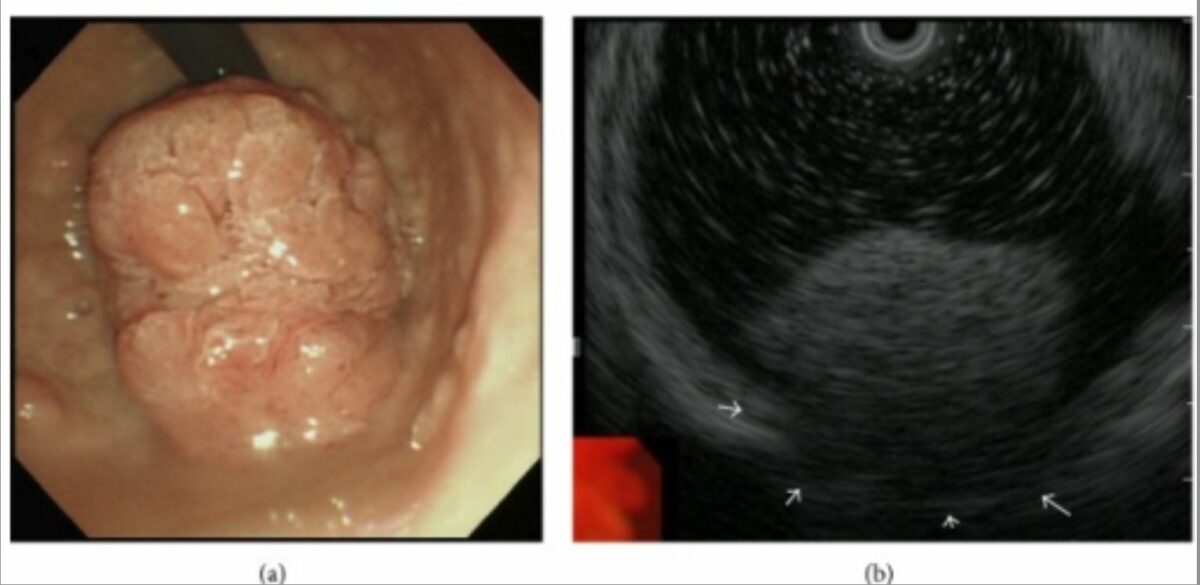
Tumor polipoide que se expressa no anel pilórico:
a: A endoscopia digestiva alta revela um tumor tipo polipoide gigante que se estende do bulbo duodenal até ao anel pilórico.
b: A ecoendoscopia sugere invasão tumoral da túnica muscular (setas brancas).
| T (tumor primário) | N (gânglios afetados) | M (metástases distantes) | |||
|---|---|---|---|---|---|
| TX | Não pode ser avaliado | N0 | Sem gânglios regionais | M0 | Sem metástases distantes |
| T0 | Sem evidência de tumor | N1 | 1–2 gânglios regionais | M1 | Metástases confirmadas |
| Tis | Carcinoma in situ | N2 | 3–6 gânglios regionais | ||
| T1 | Invasão até à submucosa | N3 | 7 ou mais gânglios regionais | ||
| T2 | Invasão da muscular própria | ||||
| T3 | Invasão da serosa | ||||
| T4a | Perfura a serosa | ||||
| T4b | Estruturas adjacentes afetadas | ||||
| Estádio | TNM | Características |
|---|---|---|
| 0 | TisN0M0 | Gânglios negativos; limitado à mucosa |
| 1 | T1-2N0M0 | Gânglios negativos; invasão da submucosa até à muscular própria |
| 2a | T1N1-3M0 T2N1-3M |
Gânglios positivos; invasão da muscular própria |
| 2b | T3N0M0 T4aN0M0 |
Gânglios negativos; invasão até à serosa |
| 3 | T3,N1-3,M0 T4a,N1-3, M0 |
Gânglios positivos; invasão até à serosa |
| 4a | T4b, qualquer N, M0 | Gânglios positivos; além da serosa, até estruturas adjacentes |
| 4b | Qualquer T, N, M1 | Metástases à distância |
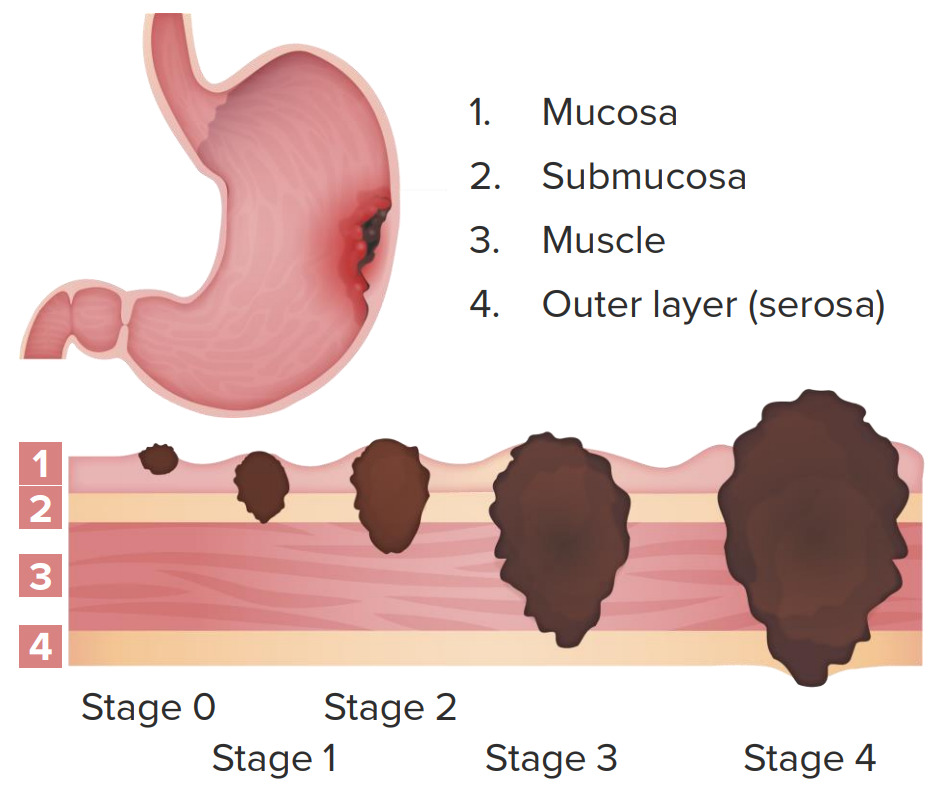
Estadiamento clínico do cancro gástrico:
Estádio 0: gânglios negativos; limitado à mucosa
Estádio 1: gânglios negativos; invasão da submucosa e parte da muscular própria
Estádio 2: gânglios negativos com invasão até à serosa ou gânglios positivos com invasão até à muscular própria
Estádio 3: gânglios positivos; invasão da serosa
Estádio 4: gânglios positivos; invasão até estruturas adjacentes com ou sem metástases à distância