O sistema renal é responsável pela eliminação da carga diária de ácidos não voláteis, que é de aproximadamente 70 milimoles por dia. Esta carga diária provém principalmente do metabolismo anaeróbio, da absorção de ácidos e da excreção de bases do sistema GI. A acidose metabólica ocorre quando há um aumento dos níveis de ácidos não voláteis (por exemplo, ácido lático), perda renal de HCO3-, ou ingestão de álcoois tóxicos. A compensação respiratória ocorre muito rapidamente (em minutos) e atenua as alterações no pH. No período agudo, os distúrbios metabólicos podem causar sintomas graves. O tratamento tem como objetivo corrigir a etiologia subjacente.
Última atualização: Nov 23, 2022
Acidose metabólica é o processo que resulta no ganho de iões de hidrogénio (H+) ou na perda de HCO3–. Na acidose metabólica primária, a gasimetria arterial vai revelar:
Os distúrbios ácido-base são classificadas de acordo com o distúrbio primário (respiratório ou metabólico) e a presença ou ausência de compensação.
Considerar o pH, a PCO2, e o HCO3– para determinar o distúrbio primário.
Quando um paciente desenvolve acidose ou alcalose, o corpo tentará compensar. Muitas vezes, a compensação resultará num pH normal.
A acidose metabólica é causada por 1 de 3 processos primários, nomeadamente, um aumento da produção de ácido, uma perda de bases, ou uma excreção ácida deficiente.
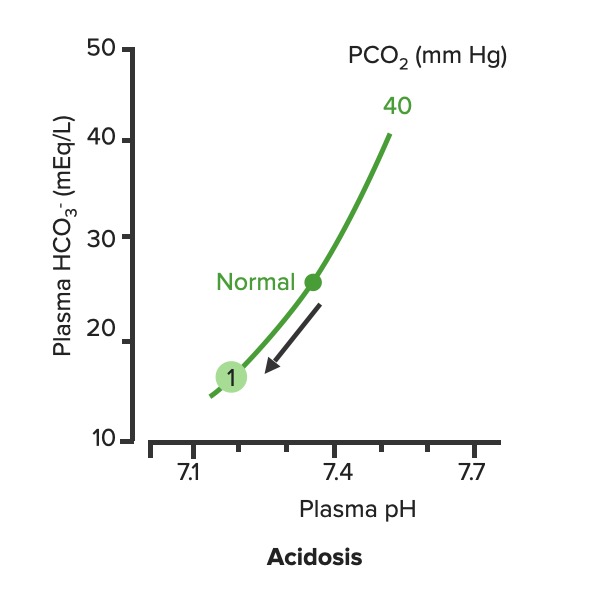
Relação entre pH plasmático e HCO3– plasmático na acidose metabólica não compensada (1):
Observe como a diminuição do HCO3– reduz a PCO2.
Ocorre alcalose respiratória compensatória em resposta à acidose metabólica.
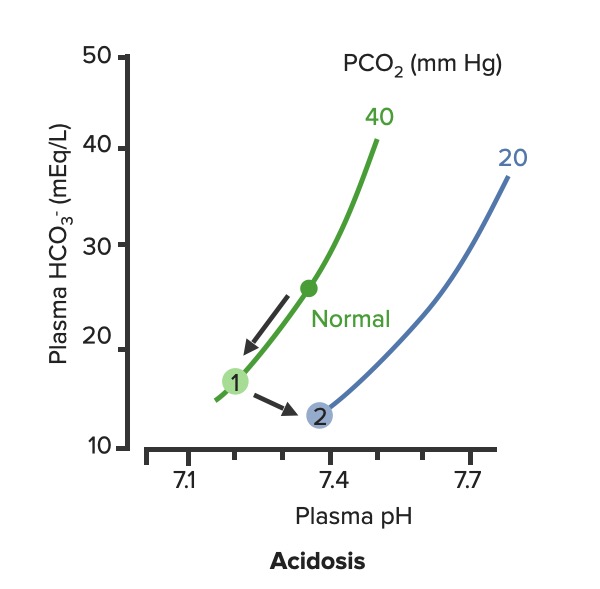
Compensação respiratória da acidose metabólica:
À medida que a PCO2 diminui, a curva desloca-se para baixo e para a direita ao longo da “linha do tampão de sangue” (2). À medida que a curva se desloca, o pH aumenta em direção ao normal.
A apresentação clínica depende da etiologia subjacente. Os sintomas podem incluir:
A acidose metabólica tem uma longa lista de potenciais etiologias, muitas das quais podem estar presentes em simultâneo. Os conceitos de anion gap (AG) e osmolal gap são úteis quando o diagnóstico não é evidente apenas pela história.
O AG pode ser usado para reduzir a lista de diagnósticos diferenciais.
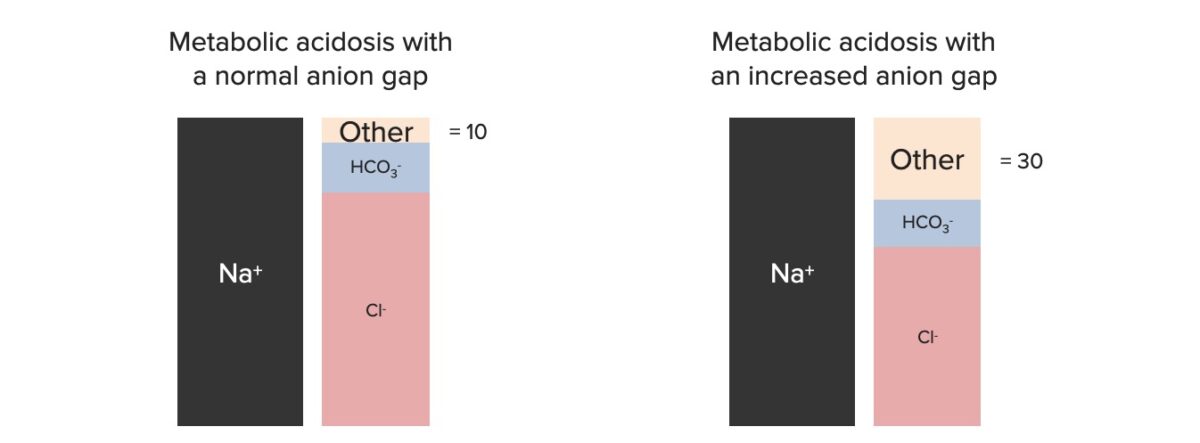
Componentes do anion gap
Imagem por Lecturio.| Anion gap aumentado |
|
|---|---|
| Anion gap normal (hipercloremia) |
|