A síndrome do coração esquerdo hipoplásico (SCEH) é uma cardiopatia congénita que consiste no subdesenvolvimento, ou hipoplasia, do lado esquerdo do coração em vários graus. A característica mais evidente da SCEH é o tamanho e a funcionalidade reduzidos do ventrículo esquerdo (VE). Além disso, a SCEH está associada à estenose, hipoplasia ou atresia dos vasos ou das válvulas atrioventriculares do lado esquerdo do coração. A SCEH é causada por uma mistura de fatores genéticos e da alteração do fluxo sanguíneo fetal. A síndrome do coração esquerdo hipoplásico apresenta-se quando o canal arterial se fecha fisiologicamente, com taquipneia, cianose, insuficiência cardíaca e choque cardiogénico. O diagnóstico pode ser feito no período pré- ou pós-natal através de ecocardiograma. Uma vez detetado, o tratamento cirúrgico é a terapêutica de 1ª linha, feita em 3 etapas.
Última atualização: Jul 11, 2023
A síndrome do coração esquerdo hipoplásico (SCEH) é caracterizada pelo subdesenvolvimento do lado esquerdo do coração. Os componentes da SCEH incluem:
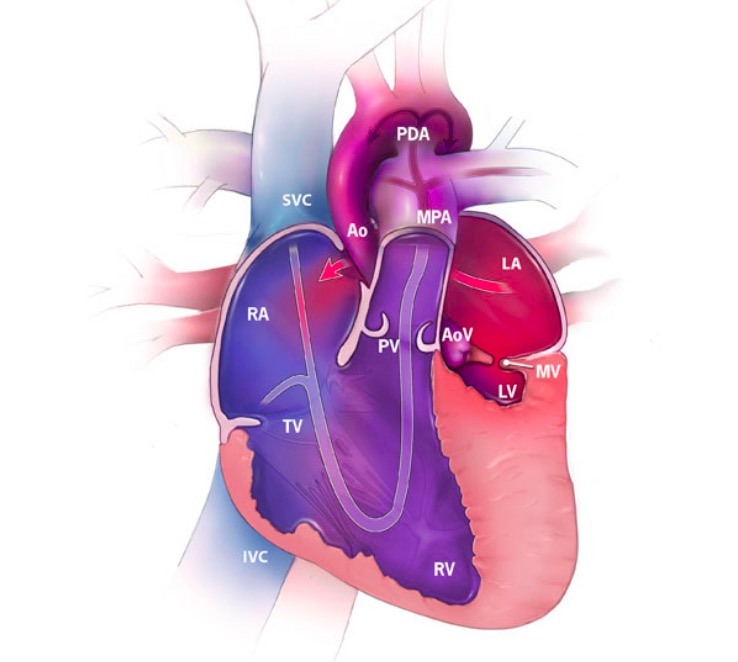
Síndrome do coração esquerdo hipoplásico (SCEH) com a direção do fluxo sanguíneo (setas) e a oxigenação do sangue:
O vermelho representa sangue oxigenado, o azul mostra sangue desoxigenado e o roxo mostra sangue misto.
RA: aurícula direita
RV: ventrículo direito
LA: aurícula esquerda
LV: ventrículo esquerdo
SVC: veia cava superior
IVC: veia cava inferior
MPA: artéria pulmonar principal
Ao: aorta
PDA: canal arterial patente
TV: válvula tricúspide
MV: válvula mitral
PV: válvula pulmonar
AoV: válvula aórtica
Existem 3 tipos de SCEH baseados na morfologia das válvulas cardíacas:
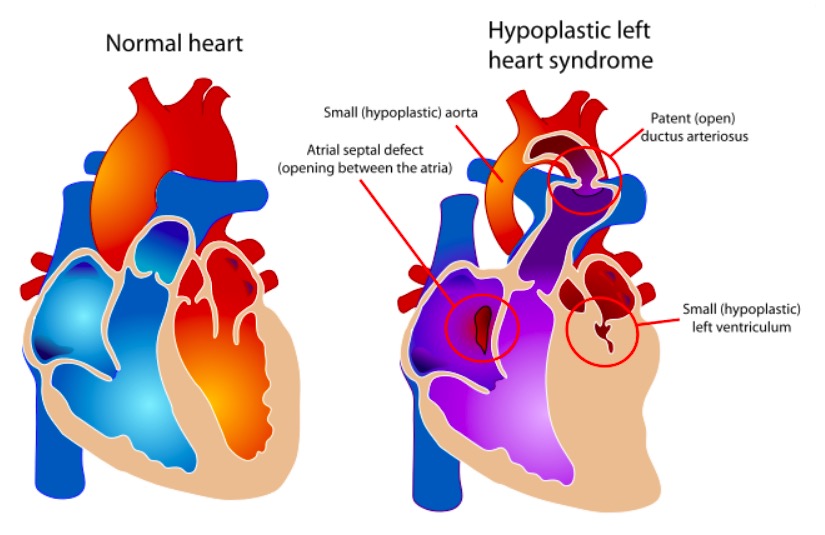
Os componentes da SCEH vs. um coração normal
Imagem: “Hypoplastic left heart syndrome” por Mariana Ruiz. Licença: Public Domain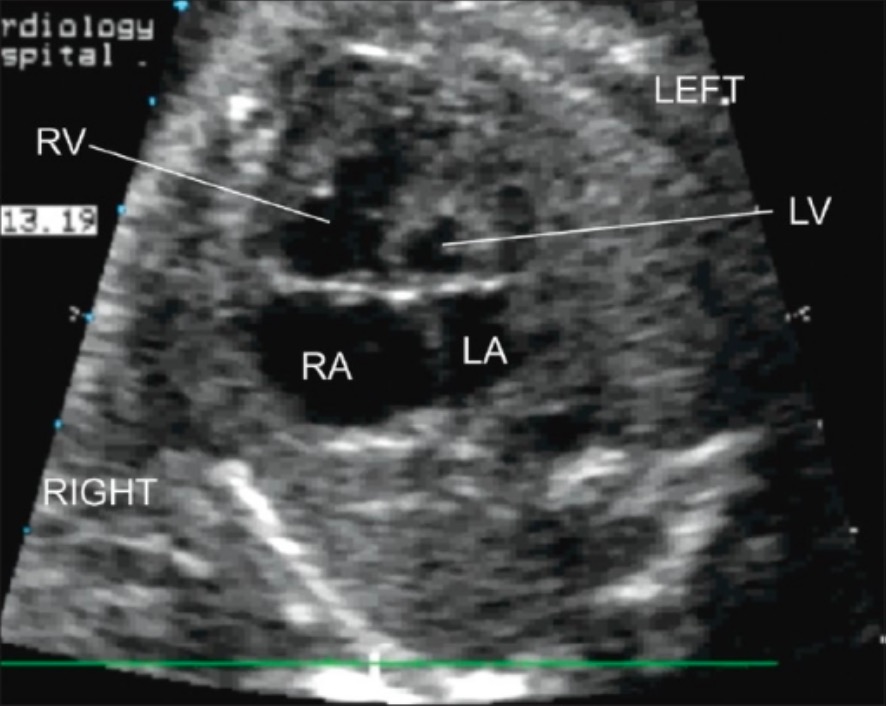
Ecocardiograma transtorácico pós-natal (vista de 4 câmaras):
Observa-se hipoplasia grave do VE com hipoplasia da AE.
LA: aurícula esquerda
LV: ventrículo esquerdo
RA: aurícula direita
RV: ventrículo direito
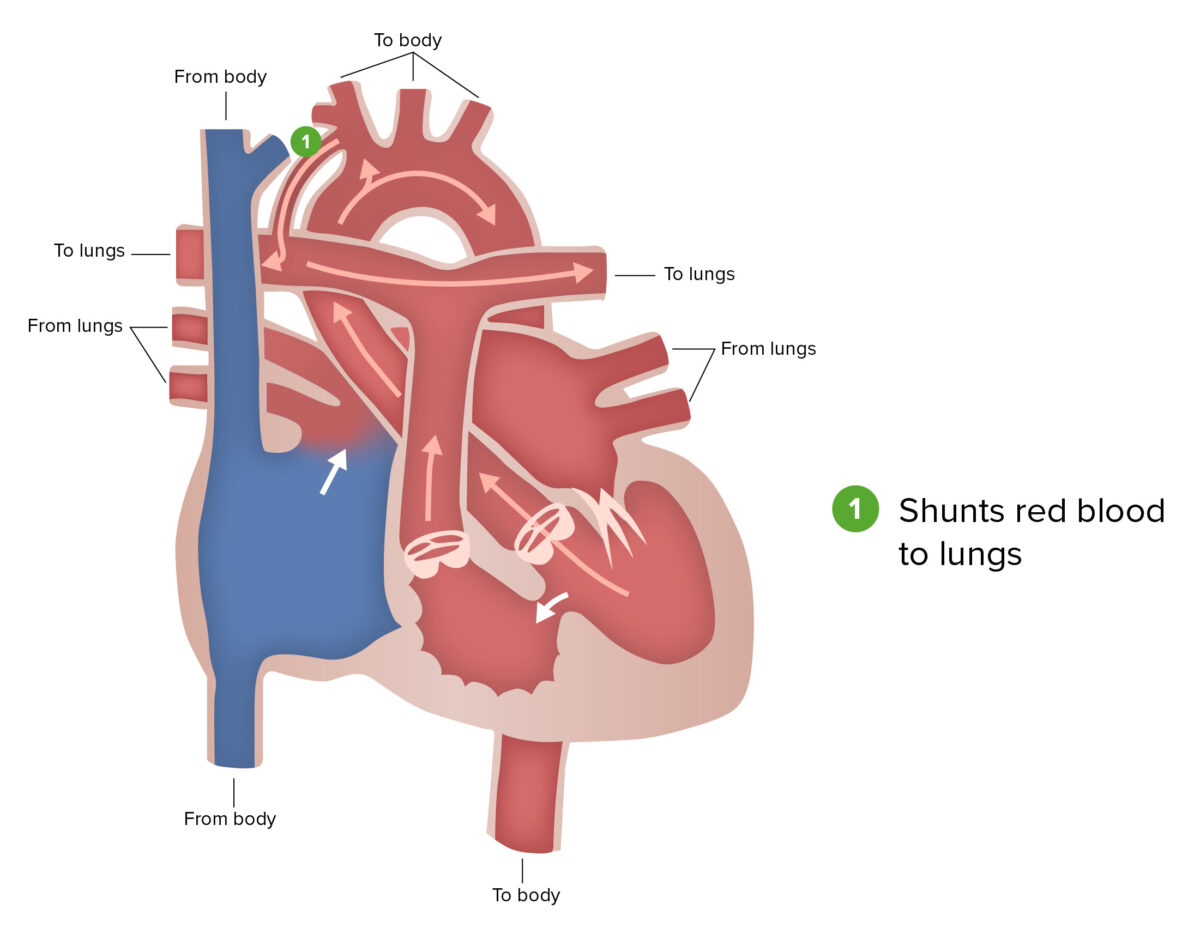
Shunt de Blalock-Taussig:
O shunt de Blalock-Taussig, parte do primeiro estádio da correção cirúrgica realizada em pacientes com síndrome do coração esquerdo hipoplásico, envolve a conexão de um ramo da artéria subclávia ou carótida com a artéria pulmonar.
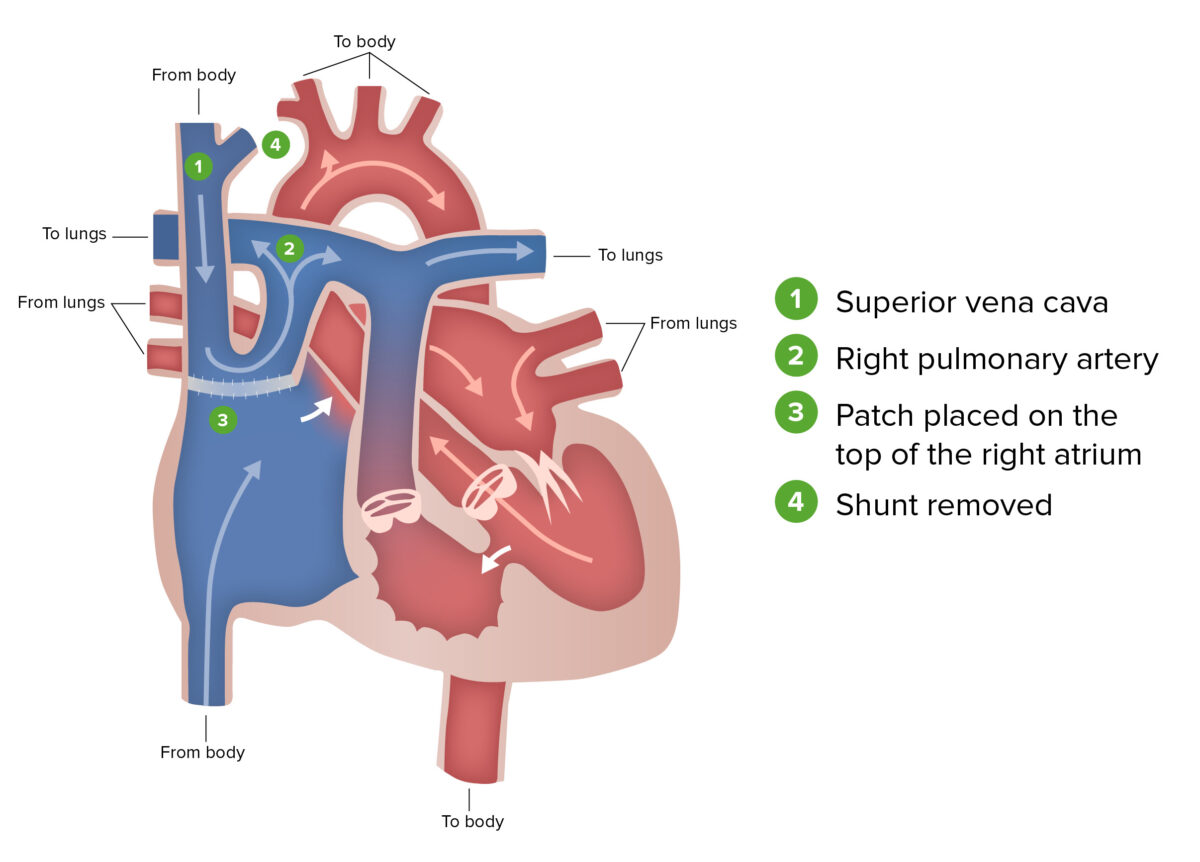
Procedimento de Glenn:
O procedimento de Glenn, segundo estádio da correção cirúrgica realizada em pacientes com síndrome do coração esquerdo hipoplásico, envolve a ligação da veia cava superior ao coração e a sua conexão à circulação pulmonar. Durante esta fase, o shunt de Blalock-Taussig é removido.
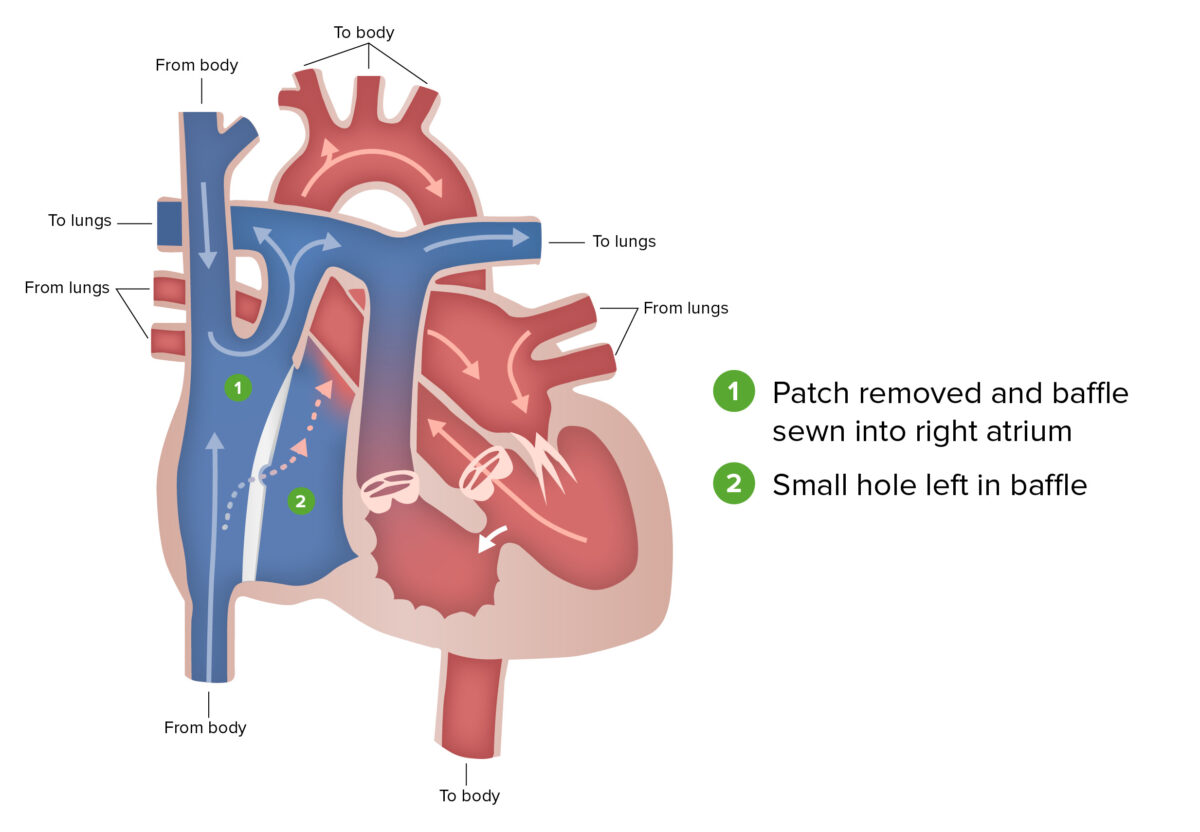
Procedimento de Fontan:
O procedimento de Fontan, etapa final da correção cirúrgica realizada em pacientes com síndrome do coração esquerdo hipoplásico, envolve o redirecionamento do sangue venoso da metade inferior do corpo, através da veia cava inferior e para a artéria pulmonar.
As seguintes síndromes genéticas estão associadas ao desenvolvimento de SCEH:
As seguintes malformações são diagnósticos diferenciais de SCEH: