A síndrome de Peutz-Jeghers (SPJ) é uma doença hereditária autossómica dominante caracterizada por pólipos gastrointestinais e máculas mucocutâneas pigmentadas. A síndrome de Peutz-Jeghers é uma das síndromes de polipose, um grupo de doenças hereditárias ou adquiridas caracterizadas pelo crescimento de pólipos no trato GI e associadas a outras características extracólicas. São causadas por mutações em genes específicos associados à supressão tumoral ou à regulação do ciclo celular. A síndrome de Peutz-Jeghers é causada por ruturas no gene STK11 e está associada ao carcinoma do cólon (colorretal) e outros não relacionados com o cólon (pancreático, gástrico, mama, uterino, cervical, pulmonar, ovariano e testicular). O tratamento é feito através de vigilância apertada e cirurgia.
Última atualização: Jan 11, 2024
A síndrome de Peutz-Jeghers (SPJ) é uma doença hereditária autossómica dominante caracterizada por pólipos gastrointestinais, hamartomatosos e máculas de melanina na pele/mucosa.
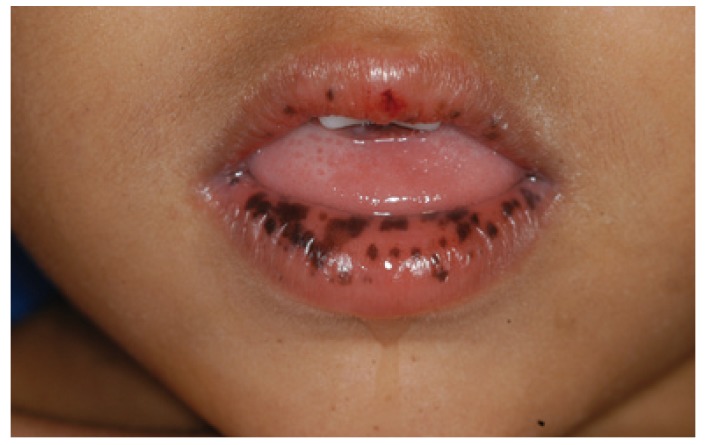
Máculas pigmentares mucocutâneas em doente jovem
Imagem: “Peutz-Jeghers syndrome: black spots localized in the perioral area” por Rogério O. Gondak, et al. Licença: CC BY 4.0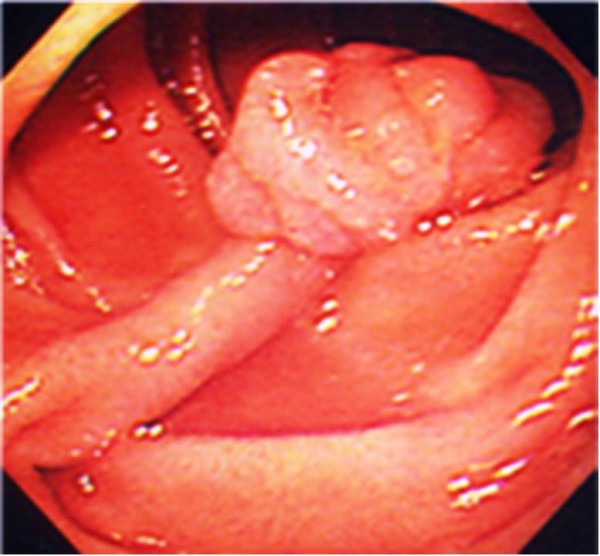
Pólipos hamartomatosos solitários típicos da síndrome de Peutz-Jeghers
Imagem: “Pedunculated duodenal polyp measuring 15 mm in diameter in the second part of the duodenum” por Yusuke Sekino, et al. Licença: CC BY 2.0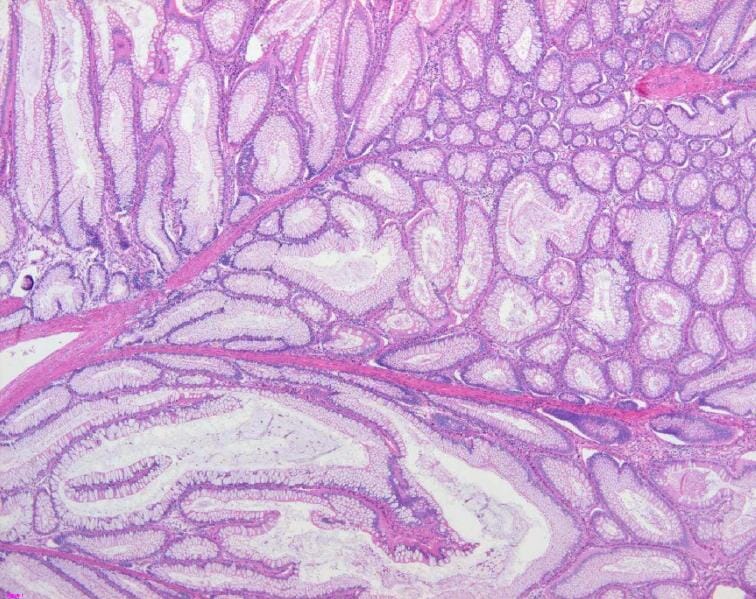
Achados patológicos de um pólipo Peutz-Jeghers: O pólipo intestinal apresenta hiperplasia do epitélio da mucosa e músculo liso com um padrão arborizado, consistente com um pólipo hamartomatoso (coloração H&E, 200x).
Imagem: “Colon histology with Peutz-Jeghers polyp” por Jong-Ha Yoo et al. Licença: CC BY 2.0