O potássio é o principal catião intracelular em todas as células e está distribuído de forma desigual entre o fluido intracelular (98%) e extracelular (2%). Esta grande disparidade é necessária para manter o potencial de membrana de repouso das células, e explica porque é que o equilíbrio do K+ é regulado de forma rigorosa. O trato gastrointestinal secreta 5%–10% do K+ absorvido diariamente; contudo, os rins são responsáveis por 90%–95% da regulação geral do K+. Enquanto a maioria do K+ é reabsorvida nos túbulos proximais, a maior parte da regulação ocorre nas células principais e nas células α-intercaladas dos dutos coletores. Os mecanismos reguladores mais importantes incluem a aldosterona, a concentração plasmática de K+, o fluxo urinário distal, e a entrega distal de Na+ e água. A hipercaliemia e a hipocaliemia podem resultar de uma regulação de K+ anormal.
Última atualização: Feb 24, 2022
Distribuição de potássio:
Mecanismos de equilíbrio do K+:
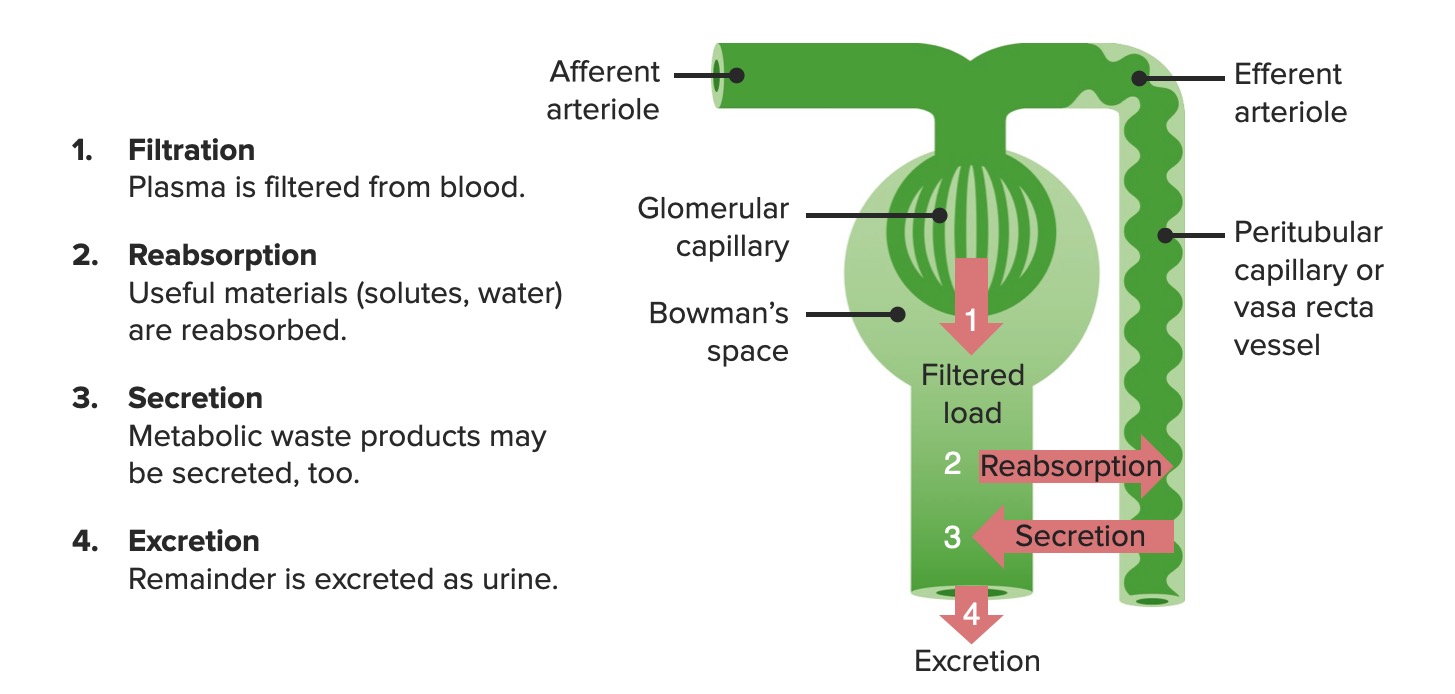
Funções renais primárias
Imagem por Lecturio. Licença: CC BY-NC-SA 4.0Os nefrónios são as unidades funcionais do rim.
Segmentos do nefrónio (na ordem pela qual o filtrado flui):
Tipos de nefrónios:
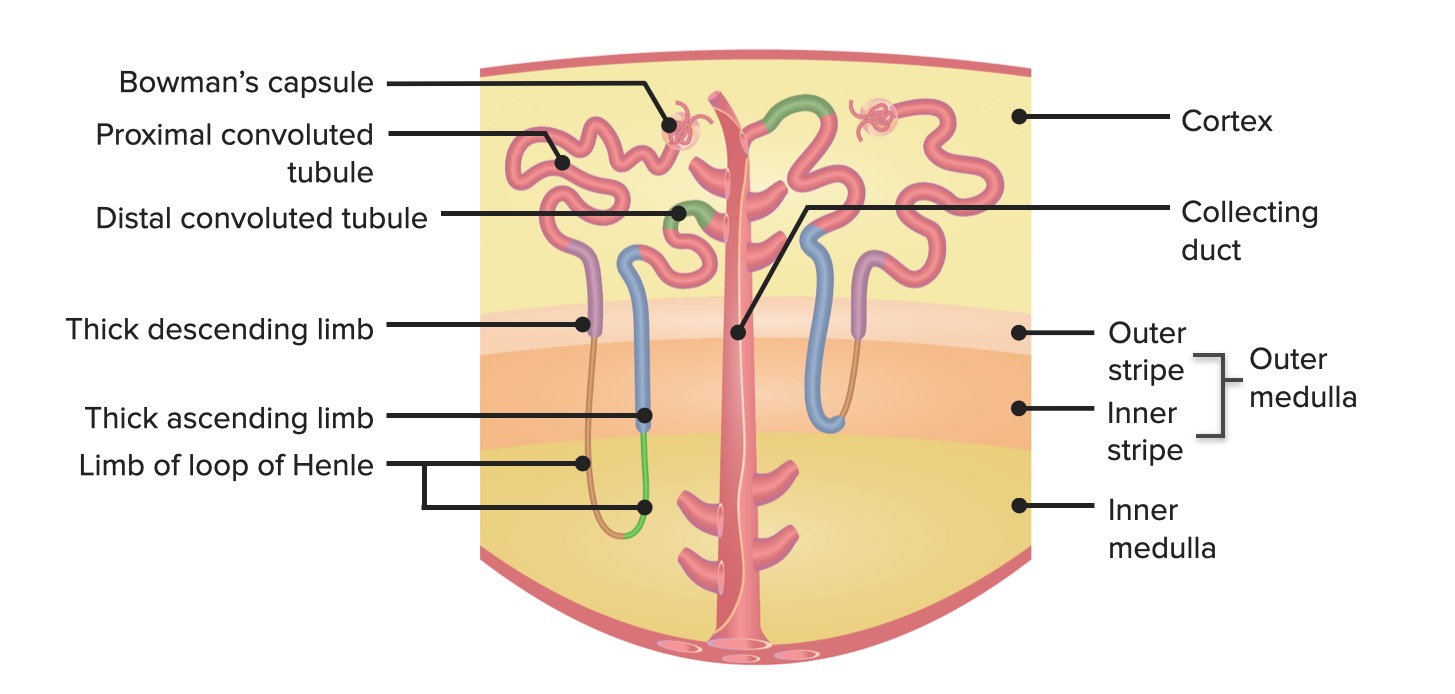
Anatomia do nefrónio
Imagem por Lecturio. Licença: CC BY-NC-SA 4.0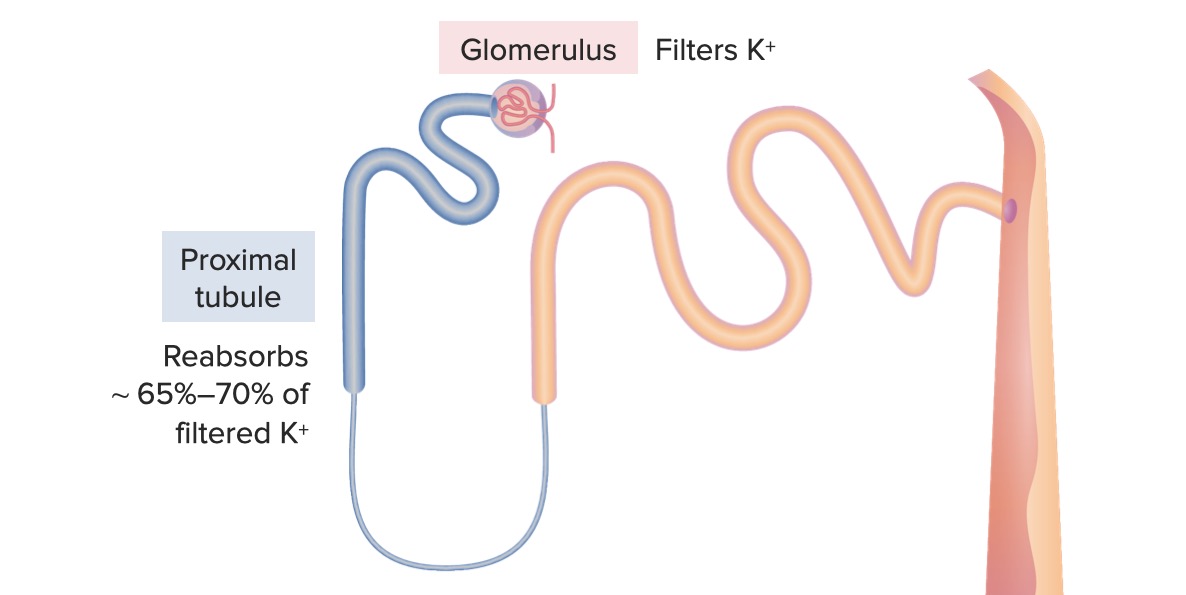
Segmentos iniciais do nefrónio (glomérulo e túbulo proximal)
Imagem por Lecturio. Licença: CC BY-NC-SA 4.0As células do túbulo contornado proximal têm a maior capacidade de absorção de todo o nefrónio. Toda a glicose, aminoácidos e cerca de 65% do Na+ e água são reabsorvidos no túbulo proximal, além da maioria do K+.
Lembre-se dos 3 Ps:
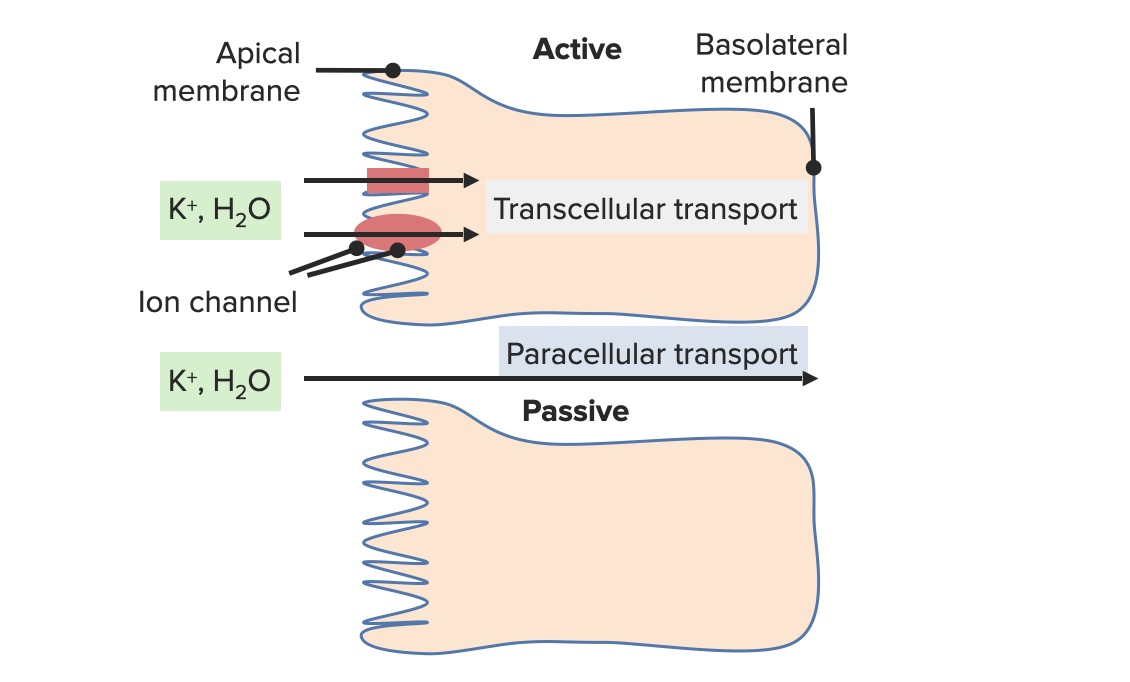
Transporte paracelular de K+ no túbulo proximal
Imagem por Lecturio. Licença: CC BY-NC-SA 4.0Cerca de 10%–25% do K+ filtrado é reabsorvido na ansa de Henle. A reabsorção envolve as seguintes 2 proteínas de transporte na membrana luminal:
Movimento do K+ na porção ascendente espessa da ansa de Henle
Imagem por Lecturio. Licença: CC BY-NC-SA 4.0Embora as maiores quantidades de K+ sejam reabsorvidas nos túbulos contornados proximais, os locais primários de regulação significativa de K+ ocorrem nos ductos colectores, dentro das células principais e das células α-intercaladas.
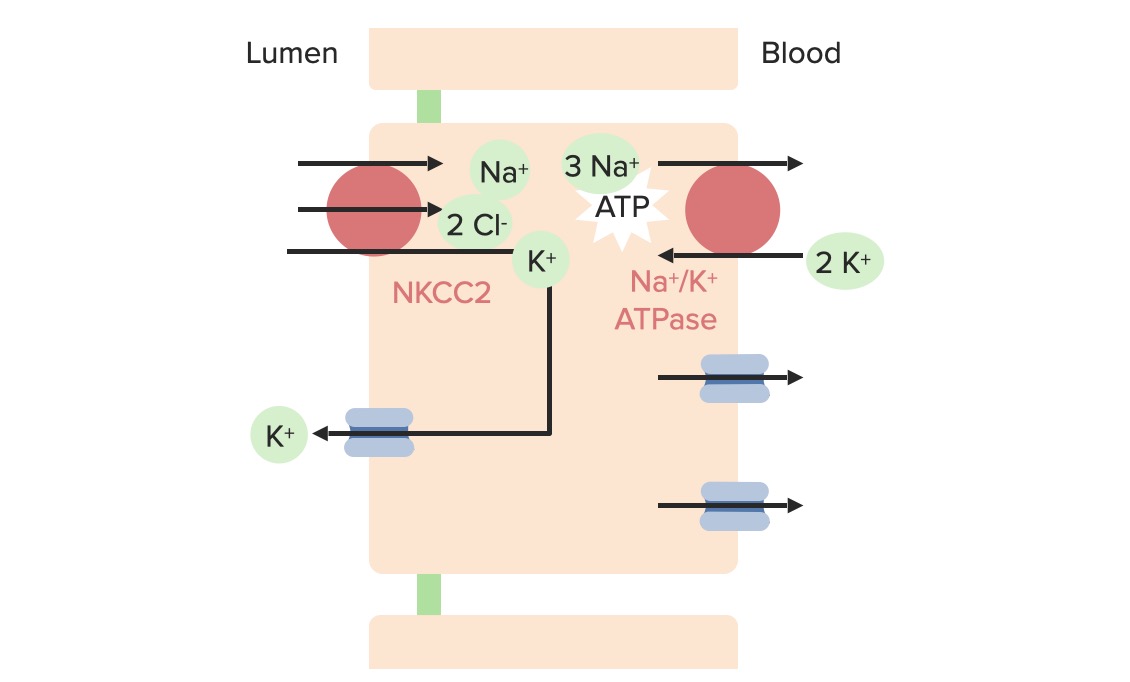
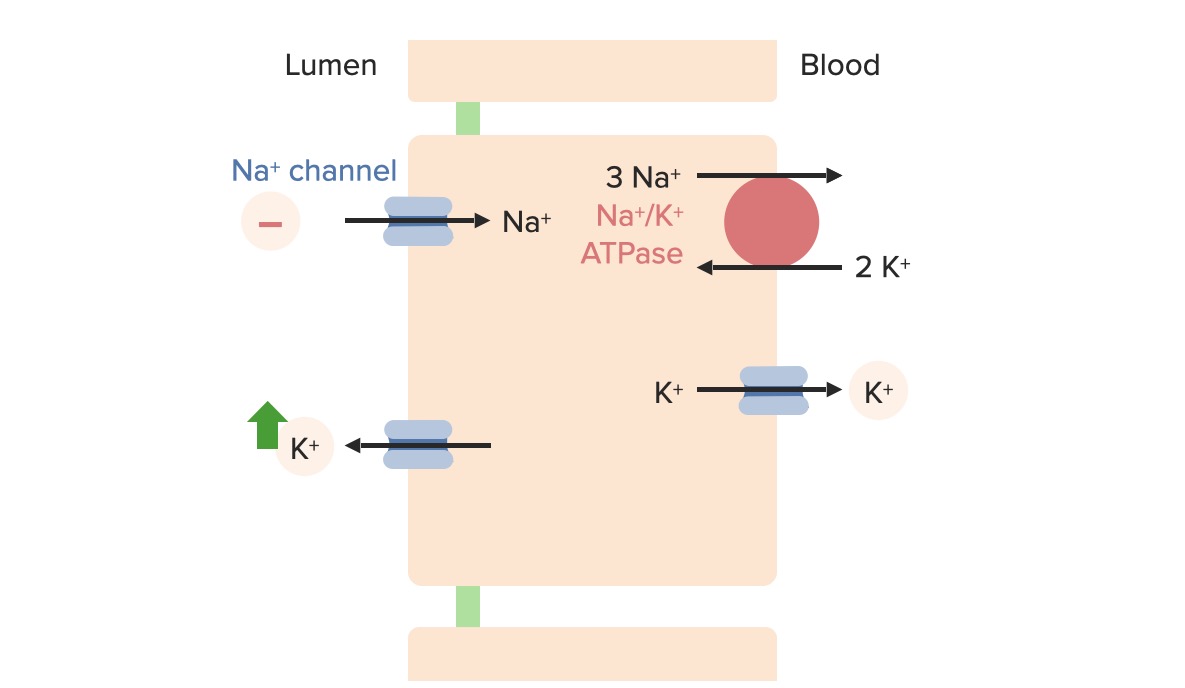
Movimento de potássio na célula principal
Imagem por Lecturio. Licença: CC BY-NC-SA 4.0O potássio sai para o lúmen através dos canais ROMK, que são controlados por fatores que afetam o transporte passivo:
Existem 4 fatores primários que regulam a excreção de K+ ao nível das células principais:
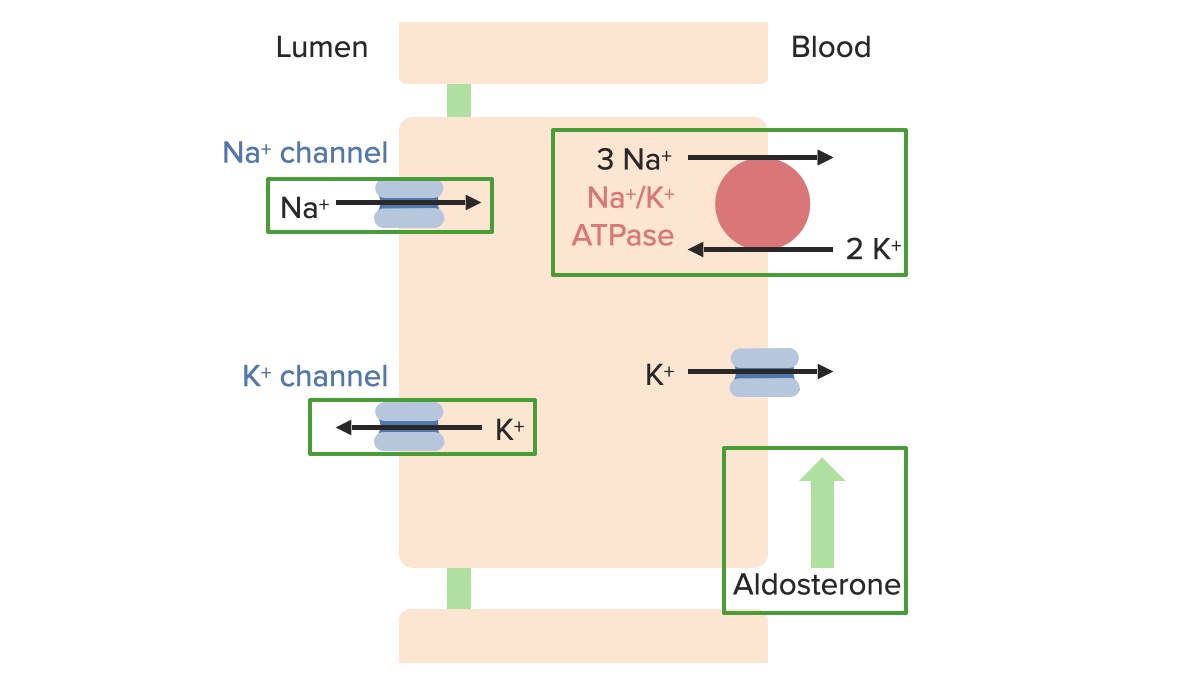
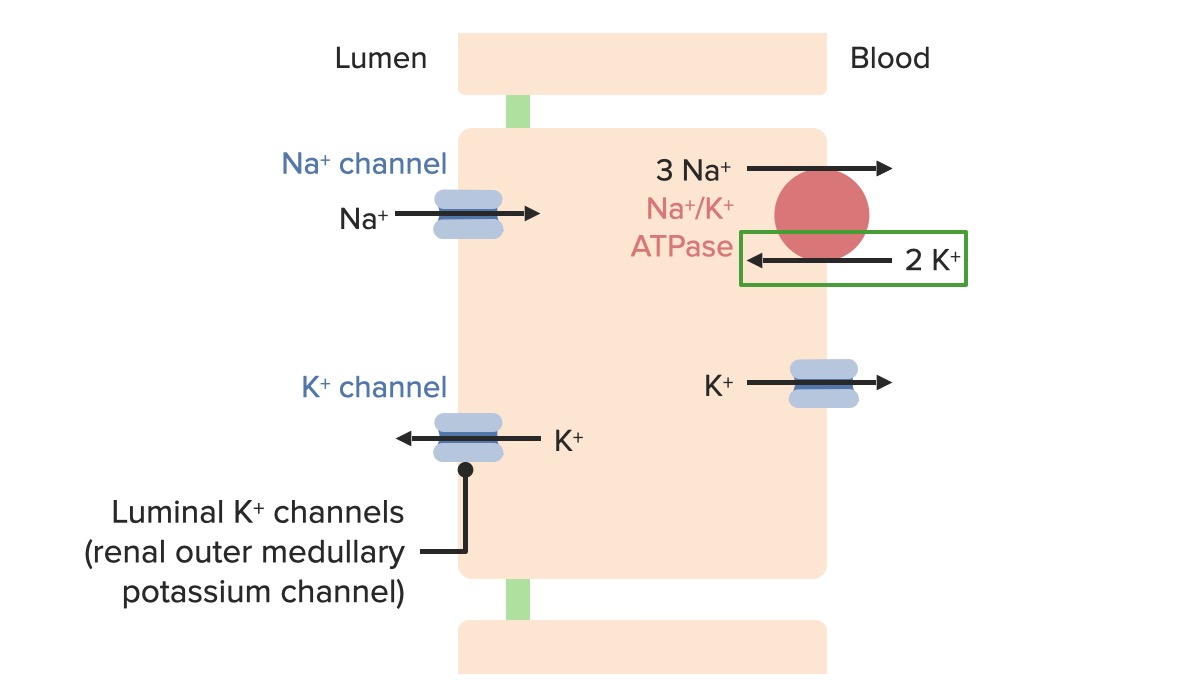
Efeitos da aldosterona e do aumento da concentração plasmática de K+ nas proteínas reguladoras de transporte nas células principais
Imagem por Lecturio. Licença: CC BY-NC-SA 4.0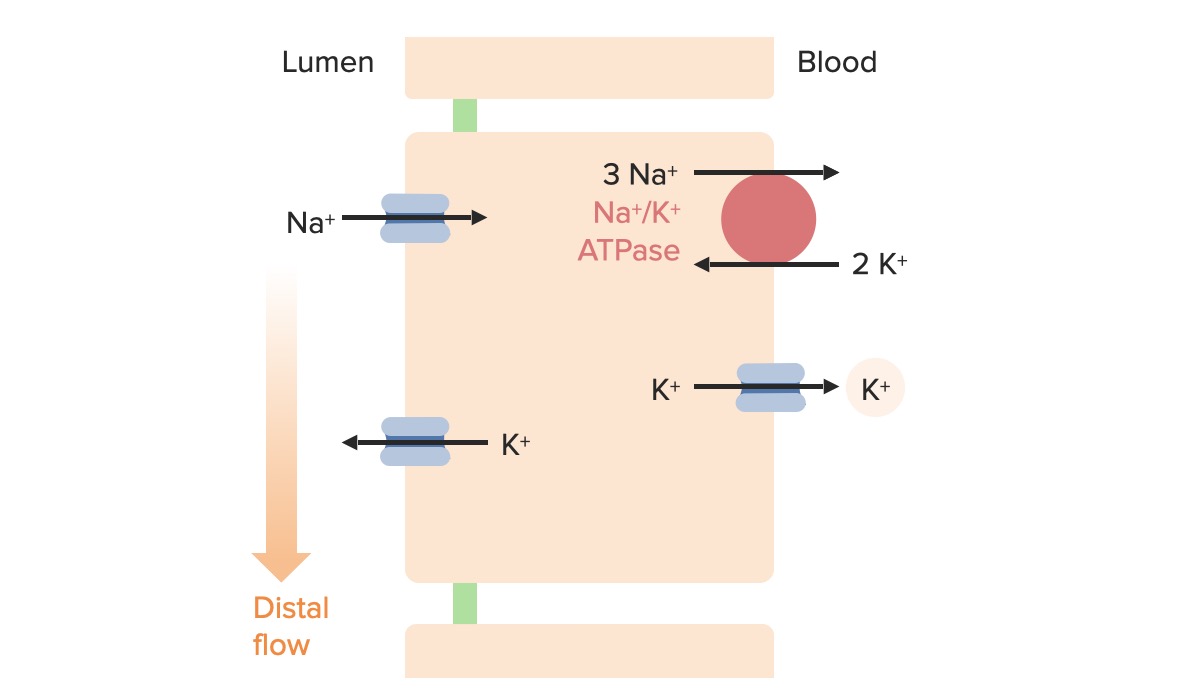
Efeitos do fluxo tubular na excreção de K+:
Uma taxa de fluxo mais rápida afasta o K+ dos canais renais de potássio da medula externa (ROMK) mais rapidamente, mantendo um maior gradiente de difusão. Um fluxo mais lento mantém o K+ mais próximo dos canais ROMK, diminuindo o gradiente de difusão e diminuindo a excreção de K+.
Efeitos da entrega distal de sódio sobre a excreção de K+:
À medida que mais Na+ é entregue às células principais nos ductos coletores, mais Na é trazido através dos canais ENaC. Este fenómeno aumenta a carga eletronegativa do lúmen, aumentando o gradiente elétrico para que o K+ flua para o lúmen.
As células α-intercaladas permitem o ajuste ótimo da excreção de K+ urinário.
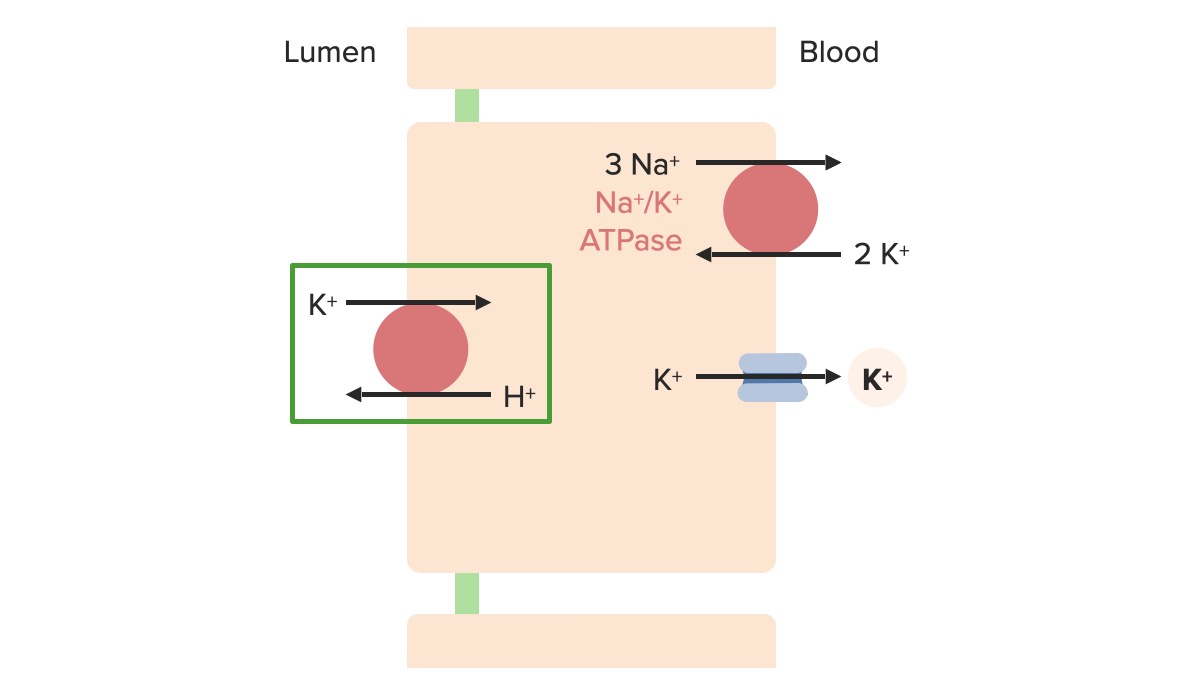
Regulação de potássio nas células α-intercaladas
Imagem por Lecturio. Licença: CC BY-NC-SA 4.0Uma dieta ocidental normal contém aproximadamente 40-120 mmol K+ por dia. A resposta normal ao K+ ingerido ocorre da seguinte forma:
| Alimentos | Tamanho da porção | mmol K+ |
|---|---|---|
| Abacate | 1, médio | 38 |
| Bife de vaca do lombo | 8 oz (226 g) | 23 |
| Sumo de laranja | 8 oz (226 g) | 12 |
| Batata, cozida | 7 oz (198 g) | 22 |
| Passas de uva | ⅔ taça | 19 |
| Pasta de tomate | ½ taça | 31 |
| Banana | 1, média | 12 |
Várias causas comuns de aumento das perdas urinárias de K+, levando à hipocalemia, incluem:
Várias causas comuns de diminuição das perdas urinárias de K+, levando à hipercaliemia, incluem: