As enzimas são biocatalisadores de proteínas complexas que aceleram reações químicas sem serem consumidas por elas. Devido às constantes necessidades metabólicas do corpo, a ausência de enzimas tornaria a vida insustentável, pois as reações ocorreriam muito lentamente sem essas moléculas. As enzimas têm muitas funções, incluindo degradação e síntese de macromoléculas (catabolismo e anabolismo), transdução de sinal, geração de energia (trifosfato de adenosina[ATP] ), bombas iônicas/transporte ativo, reações de defesa e depuração (oxidação, redução, hidrólise), regulação celular, movimento (miosina ATPase, transporte de substâncias intracelulares) e respostas imunes.
Última atualização: Apr 23, 2025
Uma enzima é uma proteína que apresenta sítios ativos que realizam reações diminuindo a energia de ativação dessa reação.
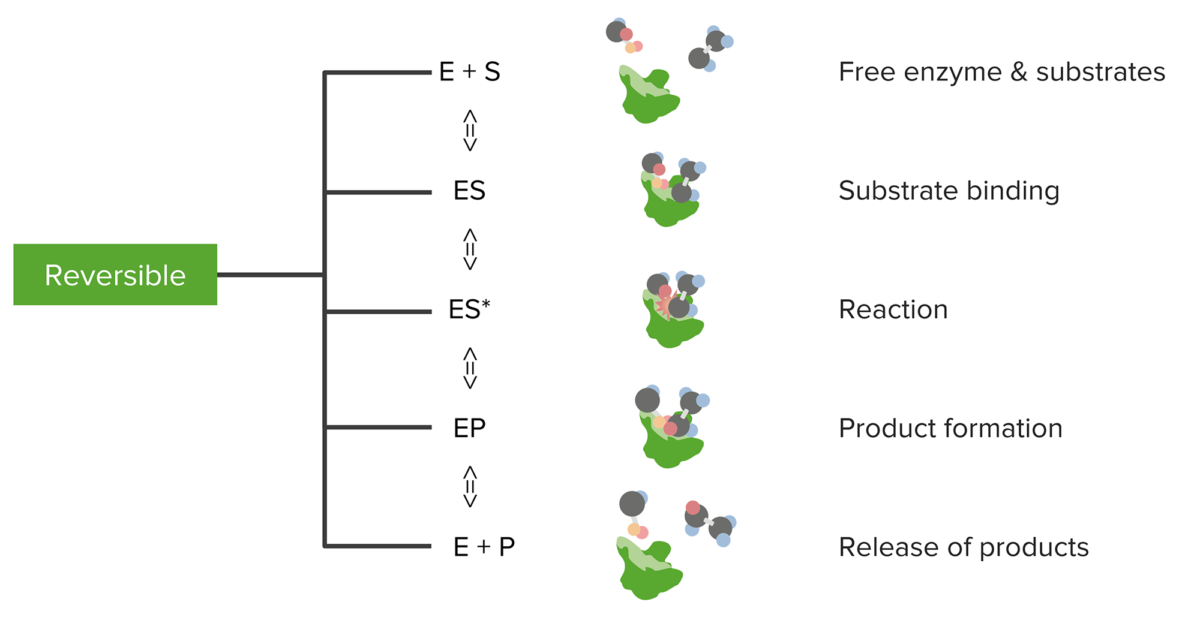
Relação entre substratos e enzimas, a reação enzimática reversível e a formação e liberação do produto
Imagem por Lecturio.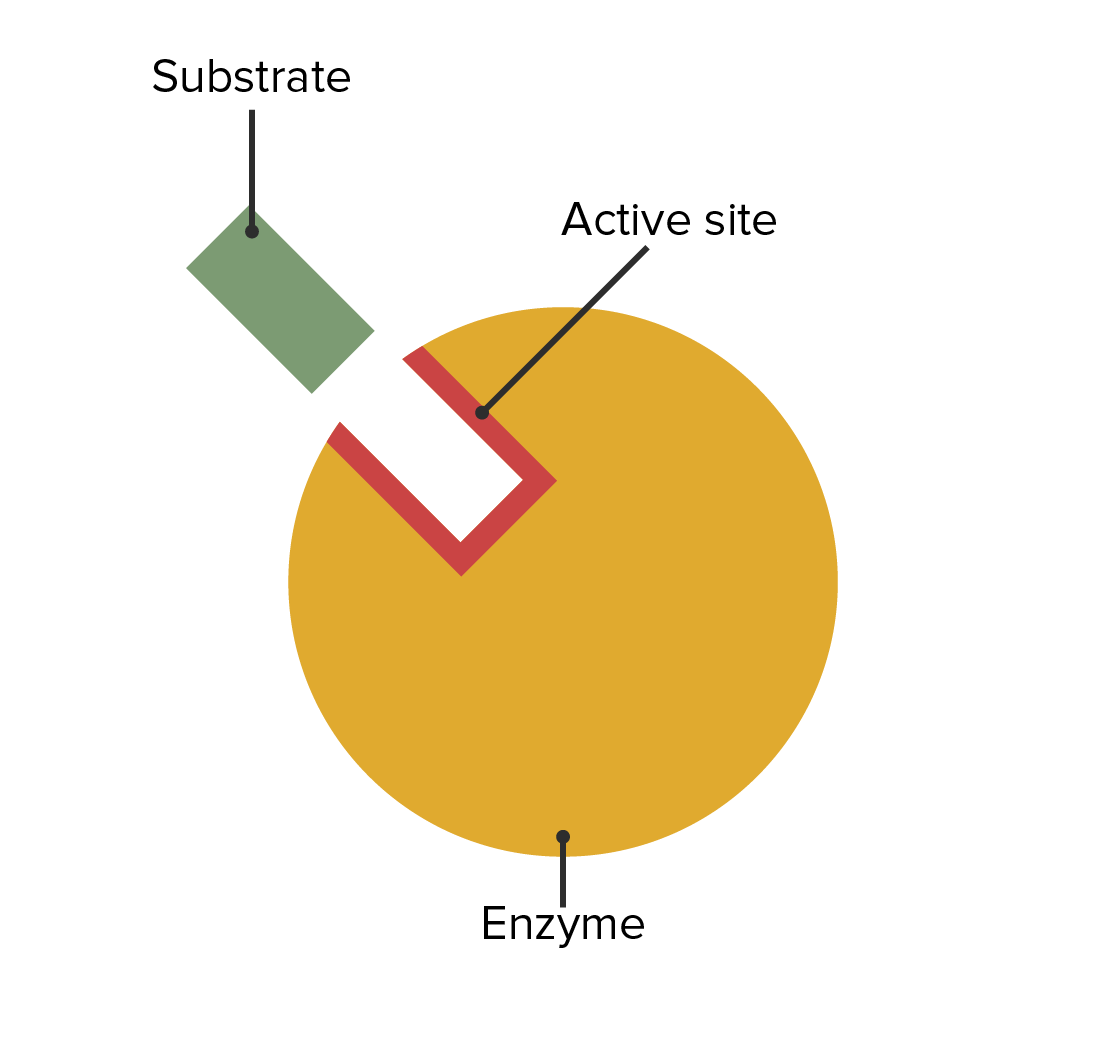
A localização do sítio ativo enzimático e sua relação com o substrato
Imagem por Lecturio.A primeira parte do nome descreve o substrato. A última parte descreve a função da enzima. A primeira parte descreverá o produto se o seguinte for verdadeiro:
| Grupo principal | Reação catalítica | Subclasses importantes (exemplos) |
|---|---|---|
| Oxirredutases | Transferência de equivalentes de redução (1 mol de elétrons); o doador de elétrons é oxidado e aumenta sua carga, o aceptor de elétrons é reduzido e diminui sua carga | Desidrogenases (álcool desidrogenase), oxidases (xantina oxidase), redutases (glutationa redutase) |
| Transferases | Transferência de grupos inteiros (por exemplo, grupos amino) |
|
| Hidrolases | Fissão molecular com adição de água = fissão hidrolítica |
|
| Liases | Quebra ligações entre 2 carbonos, ou um átomo de carbono e oxigênio, ou carbono e enxofre |
|
| Isomerases | Conversão de moléculas isoméricas umas nas outras sem alterar a fórmula molecular | Cis-trans isomerases (peptidil-prolil cis-trans isomerase, fosfoglucoisomerase) |
| Ligases | Também chamadas de sintetases, ligação de compostos dependente de energia (por exemplo, dependente de ATP) |
|
As enzimas podem ser modificadas de maneiras comuns para permitir que diferentes órgãos tenham as mesmas atividades ou que substâncias fora da sequência de substrato/enzima/produto influenciem as enzimas.
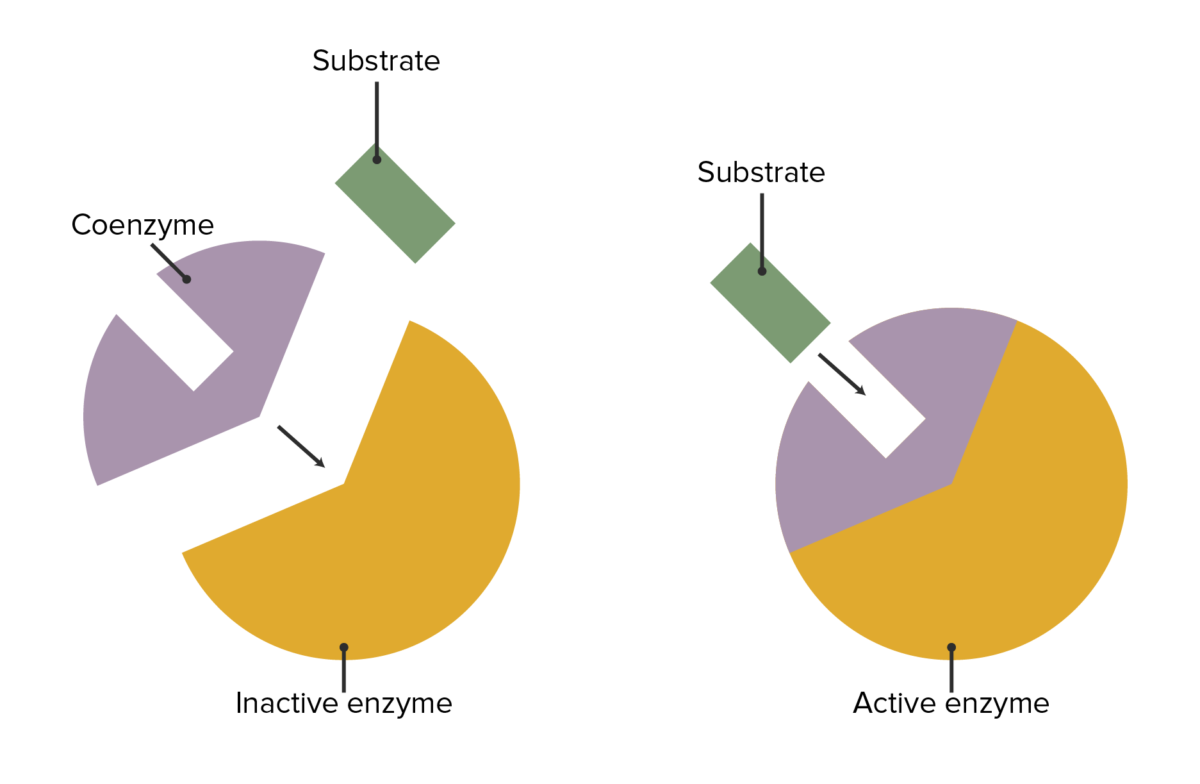
A interação entre enzimas, coenzimas e fixação do substrato
Imagem por Lecturio.| Coenzima | Vitamina associada | Tipo de reação | Exemplos de enzimas |
|---|---|---|---|
| Pirofosfato de tiamina | B1 | Descarboxilação oxidativa |
|
| FAD/FADH 2 | B2 | Transferência de elétrons | Succinato desidrogenase |
| NAD + /NADP + | B3 | Transferência de elétrons | Muitas desidrogenases |
| Lipoamida | B4 | Descarboxilação oxidativa | Piruvato desidrogenase |
| Coenzima A (CoA) | B5 | Transferência de grupo acil | α-cetoglutarato desidrogenase |
| Fosfato de piridoxal | B6 | Transaminação | Alanina transaminase (ALT) |
| Biotina | B7 | Transferência de grupo carboxila | Piruvato carboxilase |
| Tetrahidrofolato (THF) | B9 | Transferência de grupos C1 |
|
| 5-desoxiadenosil cobalamina | B12 | Rearranjos intramoleculares |
|
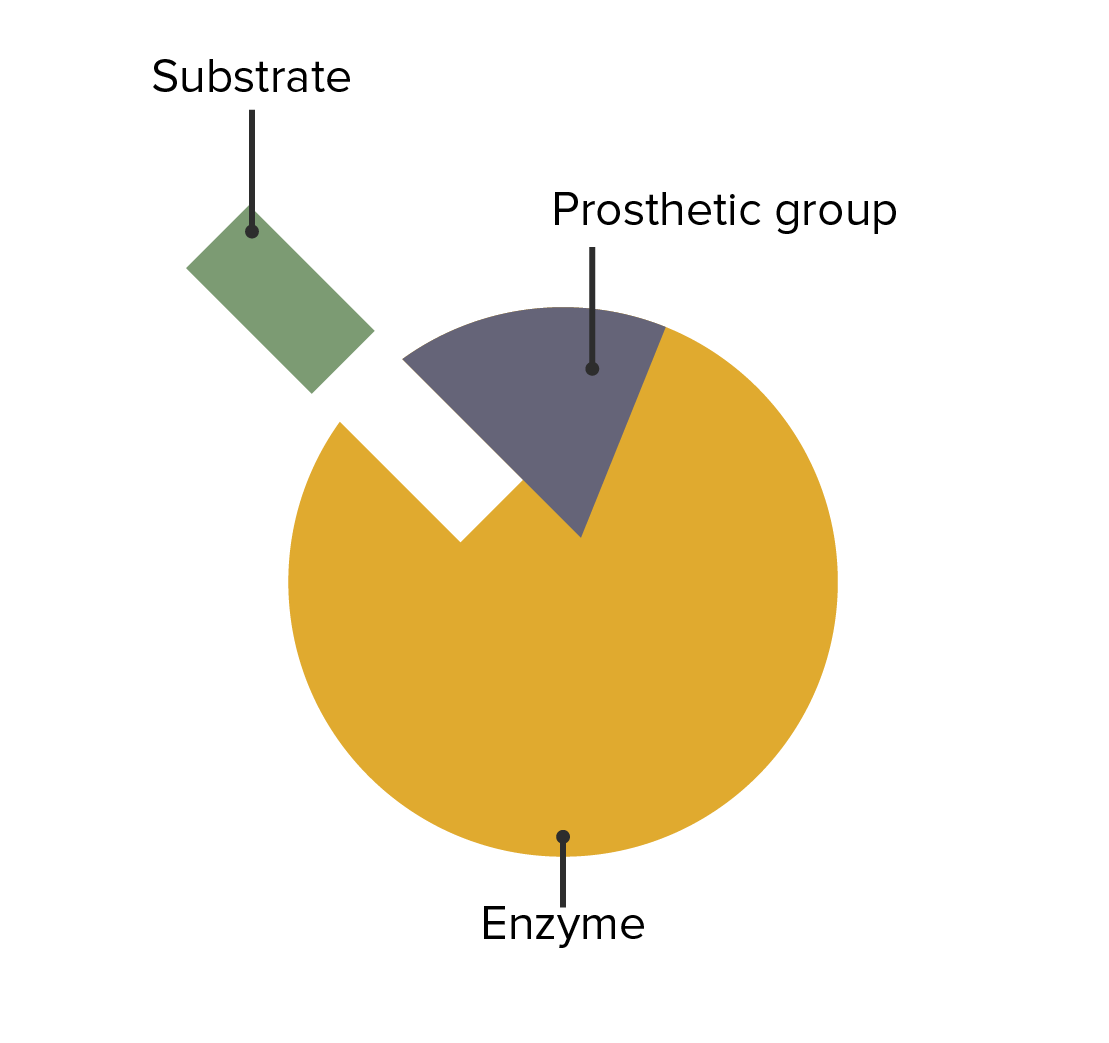
A interação entre enzimas, grupos prostéticos e fixação do substrato
Imagem por Lecturio.As seguintes condições são causadas por uma deficiência enzimática: