Las enzimas son complejos biocatalizadores proteicos que aceleran las reacciones químicas sin consumirse. Debido a las constantes necesidades metabólicas del organismo, la ausencia de enzimas haría insostenible la vida, ya que las reacciones se producirían con demasiada lentitud sin estas moléculas. Las enzimas tienen muchas funciones, como la degradación y la síntesis de macromoléculas (catabolismo y anabolismo), la transducción de señales, la generación de energía (adenosina trifosfato), las bombas de iones/transporte activo, las reacciones de defensa y degradación (oxidación, reducción, hidrólisis), la regulación celular, el movimiento (miosina ATPasa, transporte de sustancias intracelulares) y las respuestas inmunitarias.
Última actualización: Nov 2, 2022
Una enzima es una proteína que presenta sitios activos que realizan reacciones disminuyendo la energía de activación de esa reacción.
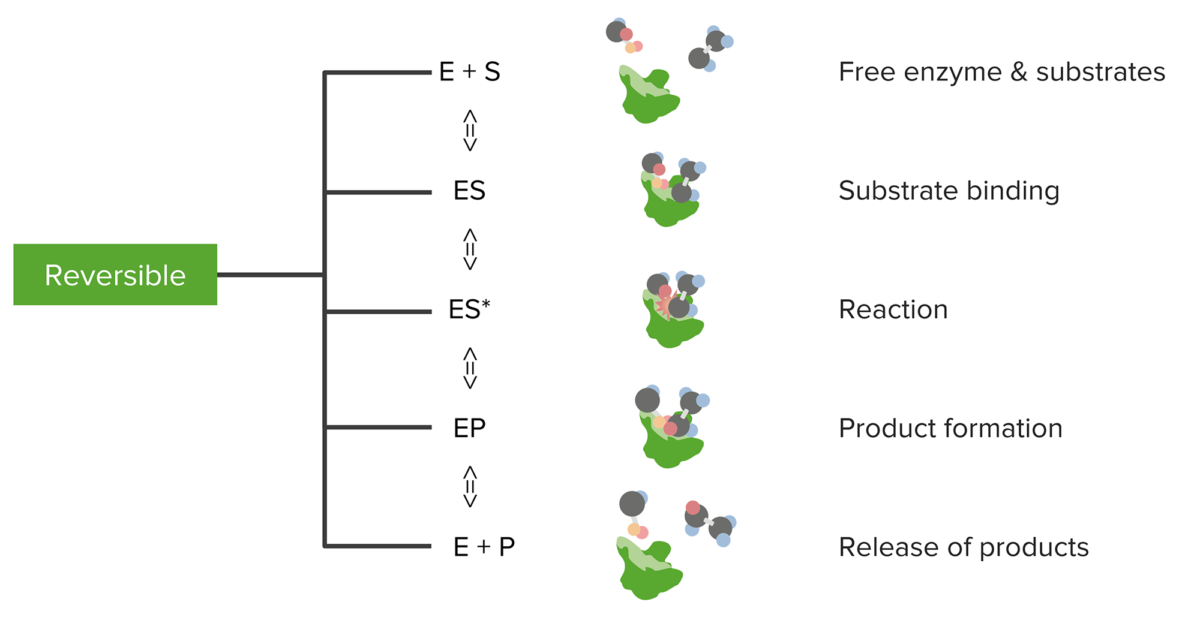
Relación entre sustratos y enzimas, la reacción enzimática reversible y la formación y liberación de productos
Imagen por Lecturio.La primera parte del nombre describe el sustrato. La última parte describe la función de la enzima. La primera parte describirá el producto si se cumple lo siguiente
| Grupo principal | Reacción catalítica | Subclases importantes (ejemplos) |
|---|---|---|
| Oxidoreductasas | Transferencia de equivalentes de reducción (1 mol de electrones); el donante de electrones se oxida y aumenta su carga, el receptor de electrones se reduce y disminuye su carga | Deshidrogenasas (alcohol deshidrogenasa), oxidasas (xantina oxidasa), reductasas (glutatión reductasa) |
| Transferasas | Transferencia de grupos enteros (e.g., grupos aminos) |
|
| Hidrolasas | Escisión molecular con adición de agua = escisión hidrolítica |
|
| Liasas | Romper enlaces entre 2 carbonos, o un átomo de carbono y oxígeno, o carbono y azufre |
|
| Isomerasas | Conversión de moléculas isoméricas entre sí sin cambiar la fórmula molecular | Cis-trans isomerasas (peptidil-prolil cis-trans isomerasa, fosfoglucoisomerasa) |
| Ligasas | También llamadas sintetasas, enlace de compuestos dependiente de la energía (e.g., dependiente del adenosín trifosfato) |
|
Las enzimas pueden modificarse de forma común para que diferentes órganos tengan las mismas actividades o para que sustancias ajenas a la secuencia sustrato/enzima/producto influyan en las enzimas.
| Coenzima | Vitamina asociada | Tipo de reacción | Ejemplos de enzimas |
|---|---|---|---|
| Pirofosfato de tiamina | B1 | Descarboxilación oxidativa |
|
| FAD/FADH2 | B2 | Transferencia de electrones | Succinato deshidrogenasa |
| NAD+/NADP+ | B3 | Transferencia de electrones | Muchas deshidrogenasas |
| Lipoamida | B4 | Descarboxilación oxidativa | Piruvato deshidrogenasa |
| Coenzima A (CoA) | B5 | Transferencia de grupos acílicos | α-cetoglutarato deshidrogenasa |
| Fosfato de piridoxal | B6 | Transaminación | Transaminasa de alanina |
| Biotina | B7 | Transferencia del grupo carboxilo | Piruvato carboxilasa |
| Tetrahidrofolato | B9 | Transferencia de grupos C1 |
|
| 5-deoxiadenosil cobalamina | B12 | Reordenamientos intramoleculares |
|
Las siguientes condiciones son causadas por una deficiencia enzimática: