As modificações pós-transcripcionais (PTMs, pela sigla em inglês) são processos que facilitam a produção de RNA maturado e funcional. Estes mecanismos regulatórios de resposta rápida permitem que diferentes proteínas sejam produzidas a partir de um gene e atuam como reguladores do fenótipo e da taxa de proliferação. Estas modificações também podem desempenhar um papel em algumas formas de cancro e em doenças neurodegenerativas. O RNA pré-mensageiro (mRNA), chamado RNA nuclear heterogéneo (hnRNA), é modificado pela adição de um cap 7-metillguanosina na extremidade 5' e uma cauda poli-A (poliadenilato) na extremidade 3' para estabilidade e proteção. Além disso, o hnRNA que contém intrões (sequências não codificantes) entre as sequências expressas, ou exões, sofre reparações (splicing). Este processo remove intrões para produzir um mRNA maturado com a sequência de codificação para tradução. O splicing alternativo, por outro lado, também exclui os intrões, mas formam-se várias combinações de exões, produzindo proteínas diferentes do mRNA original. Na edição de RNA, a sequência de mRNA é alterada e difere do modelo de DNA transcrito. O RNA transportador e o RNA ribossomal começam a partir de moléculas precursoras mais longas e passam por etapas que incluem metilação, cortes e adição de nucleótidos.
Última atualização: Apr 25, 2025
A informação genética do DNA é copiada para o RNA mensageiro (mRNA).
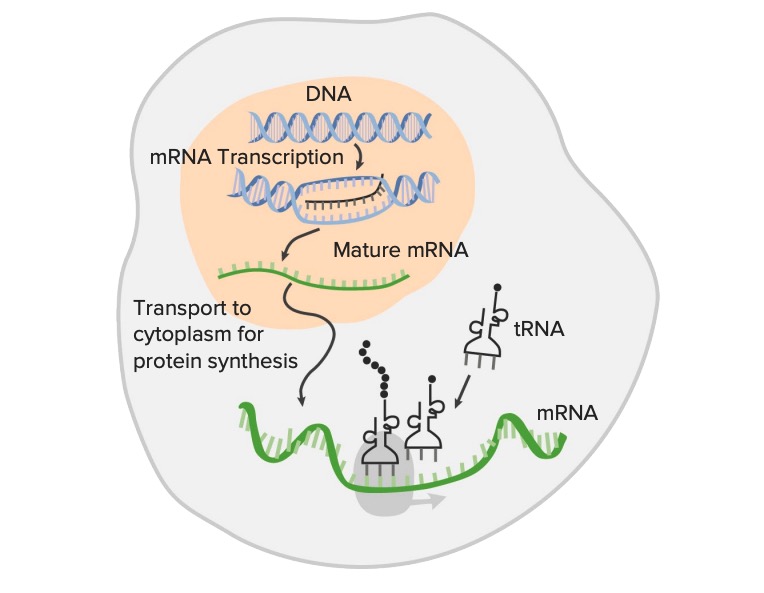
A expressão génica do DNA, a sequência genética, é transcrita para RNA (transcrição):
A transcrição da informação genética é o primeiro passo na expressão génica e é o processo pelo qual uma região codificante do DNA (estrutura de dupla cadeia) é usada como modelo para a síntese de RNA mensageiro (mRNA). O mRNA maturado é traduzido em aminoácidos, formando proteínas (tradução) com a ajuda do RNA ribossomal e RNA de transferência (tRNA). Esta imagem mostra a transcrição sem modificações pós-transcritas do RNA.
As transcrições primárias, ou produtos imediatos da transcrição, sofrem alterações para se tornarem biologicamente funcionais.
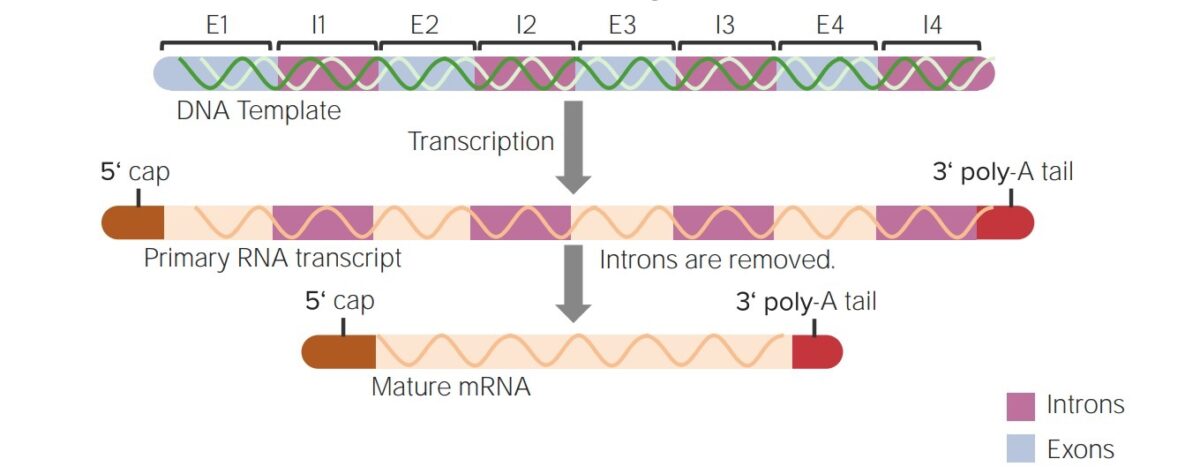
Resumo das modificações pós-transcricionais desde um hnRNA até um mRNA maduro:
A adição do cap 5′ e da cauda 3′ de poli-A e splicing (remoção das sequências intervenientes ou intrões)
7-Metilguanosina (resíduo de guanilil metilado) é adicionado à extremidade 5′ do hnRNA via:
Funções:
50 a 250 resíduos de adenilil (AMP pela sigla em inglês) são adicionados à extremidade 3′ do hnRNA via:
Função:
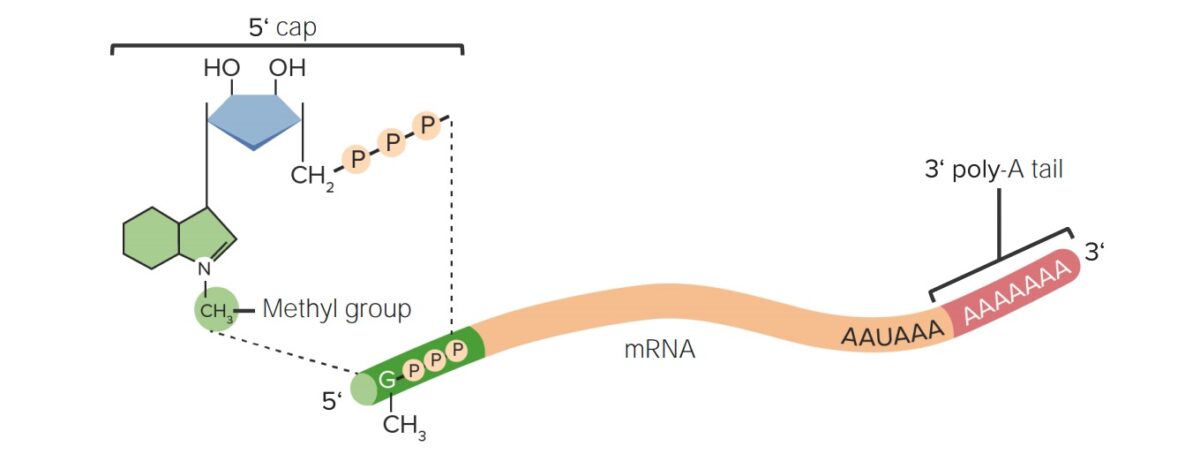
Modificações pós-transcricionais do RNA:
As modificações do cap 5′ (7-metilguanosina) e da cauda 3′ de poli-A evitam a degradação do mRNA no citosol.
RNA heterogéneo nuclear (pré-mRNA) contém:
Processamento:
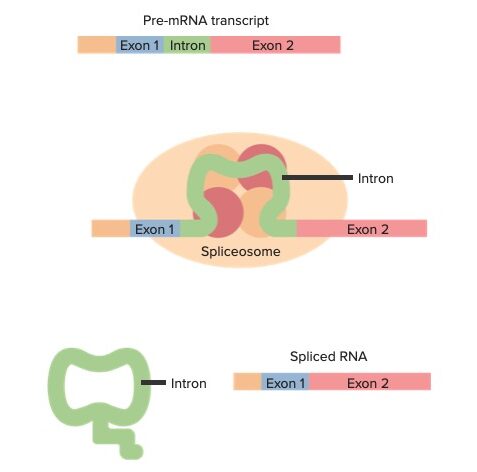
Exões e intrões pré-mRNA com um resumo do splicing (de cima para baixo):
A transcrição pré-mRNA contém exões e intrões. O transcrito interage com pequenas ribonucleoproteínas nucleares e outras proteínas, formando um spliceossoma em certas junções do transcrito. São feitos cortes nos locais de splicing e o intrão é libertado. Após sofrer splicing, o RNA passa a ter apenas exões, que contêm a sequência de codificação.
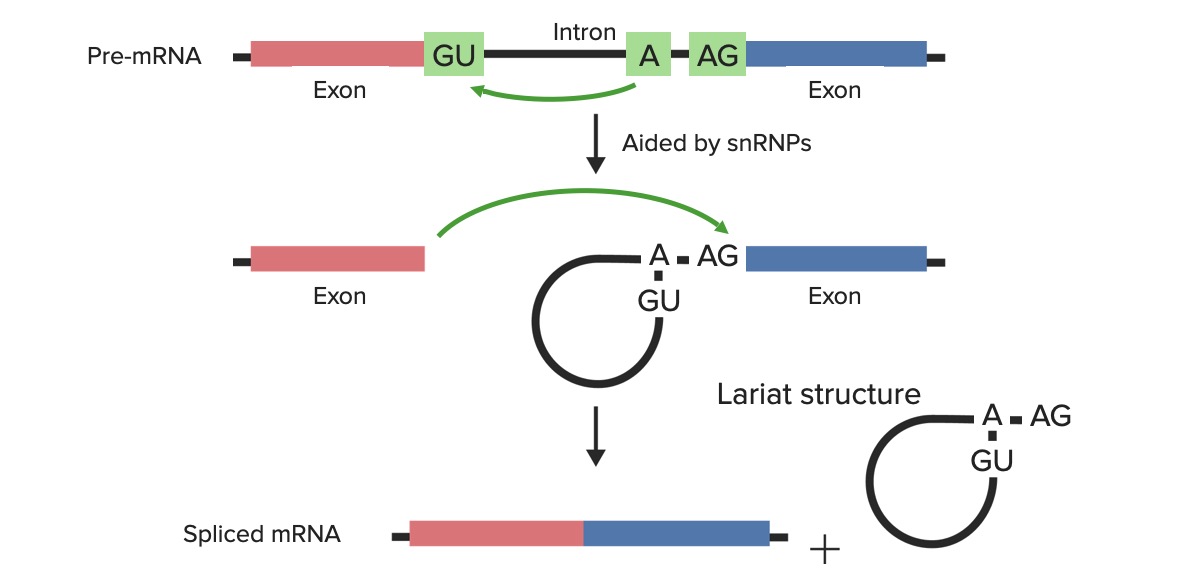
Aspetos técnicos do splicing:
Os pré-mRNA/hnRNA são compostos por exões e intrões. Pequenas ribonucleoproteínas nucleares + outras proteínas reconhecem o local da ramificação e as junções exão–intrão onde fazer o corte: o sítio dador 5′ (contendo a sequência GU invariável) e o sítio aceitador 3′ (contendo a sequência AG invariável). O transcrito de hnRNA + pequenas ribonucleoproteínas nucleares + outras proteínas combinam-se nestes locais e formam o spliceossoma.
Imagem de cima: Através da ajuda de pequenas ribonucleoproteínas nucleares (snRNPs), o primeiro corte é feito pelo resíduo adenilil (no local da ramificação) através de um ataque nucleofílico no local dador 5′.
Imagem do centro: O terminal 5′ livre forma então uma ligação com o local da ramificação (fazendo a estrutura em laço).
Imagem de baixo: O segundo corte é feito no local 3′ do intrão e os exões são unidos.
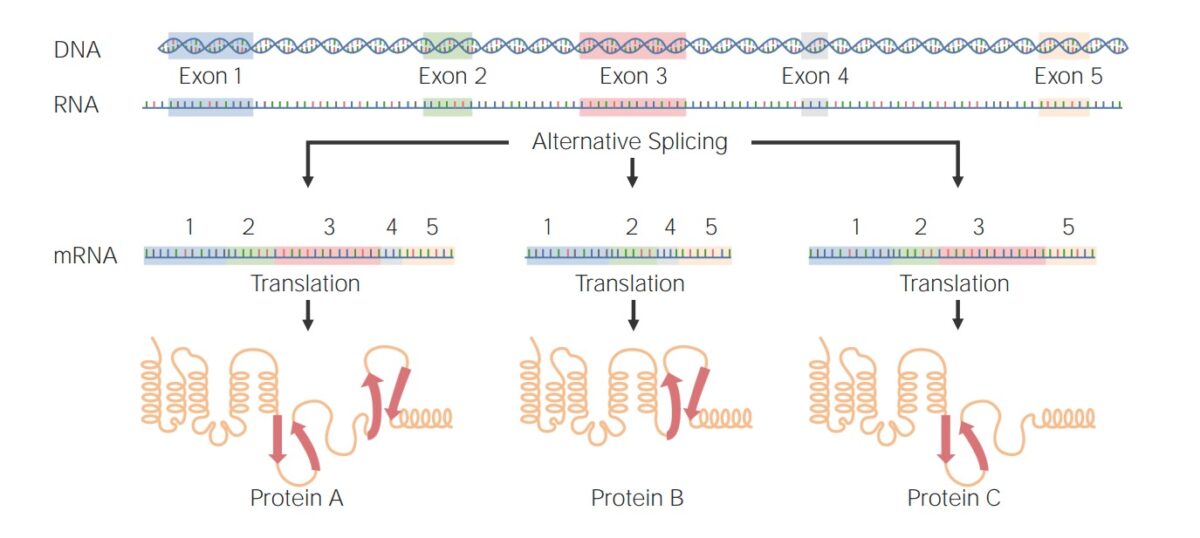
Exemplos de splicing alternativo:
Proteína A: Exões 1-5 foram unidos após splicing de intrões.
Proteínas B e C: Um exão foi seletivamente excluído para formar uma proteína diferente.
Geralmente, a sequência de DNA é refletida no mRNA maturado. A alteração da sequência ou edição do RNA é uma exceção.
Edição “C-para-U”:
Edição “A-para-I”:
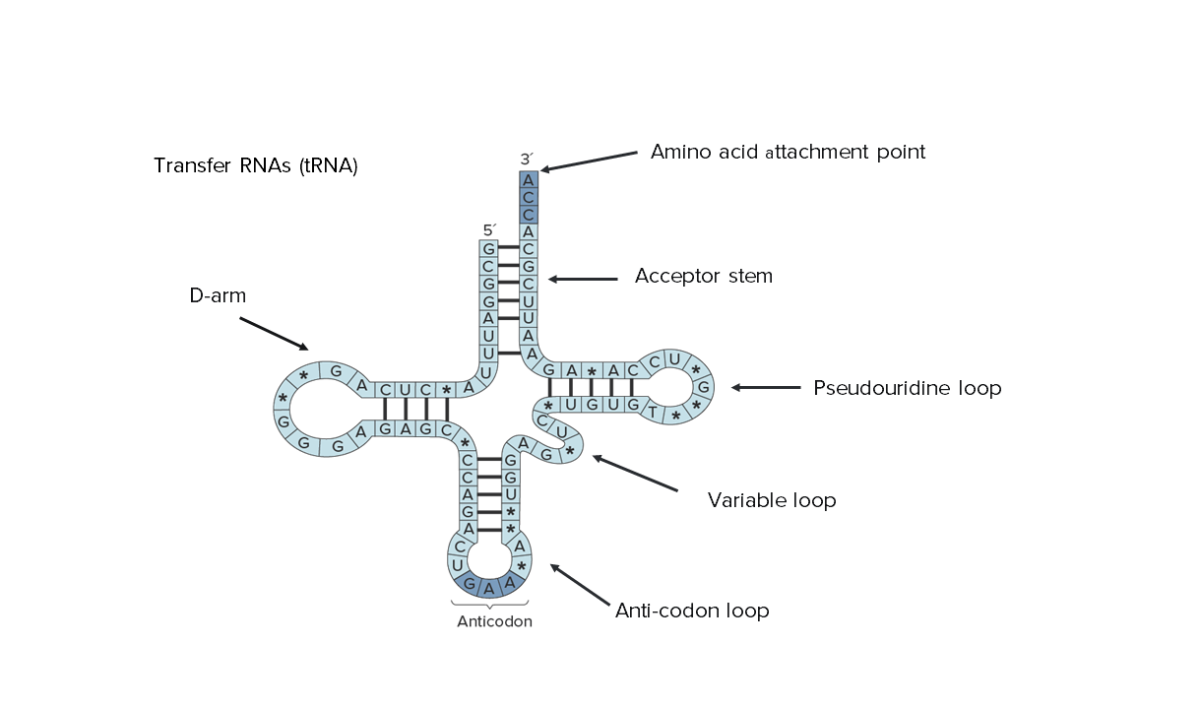
Estrutura secundária de RNA de transferência (tRNA). Note que toda a sua sequência pode ser vista, destacando o seu tamanho reduzido.
Imagem de Lecturio.