A mielofibrose primária (MFP) é uma neoplasia mieloproliferativa caracterizada por mieloproliferação crónica com deposição fibroblástica não clonal, resultando em fibrose da medula óssea. A alteração decorre de mutações genéticas das células estaminais hematopoiéticas (tipicamente, mutação JAK2). Os sintomas primários são a anemia e a hematopoiese extramedular, que incluem fadiga severa, perda de peso e hepatoesplenomegalia. Os achados laboratoriais incluem anemia (e outras citopenias) e a biópsia da medula óssea revela fibrose extensa. O tratamento é realizado através de transplante de células estaminais hematopoiéticas e intervenções direcionadas aos sintomas.
Última atualização: Jun 14, 2022
A mielofibrose primária (MFP) é uma neoplasia mieloproliferativa crónica caracterizada pela proliferação de células mieloides, com proliferação e hiperatividade de fibroblastos não clonais, resultando em fibrose medular obliterativa. Outros nomes incluem mielofibrose idiopática crónica e metaplasia mieloide agnogénica.
A hematopoiese começa com a célula estaminal hematopoiética, que é estimulada a dividir-se e diferenciar-se com estímulos químicos apropriados (fatores de crescimento hematopoiéticos)
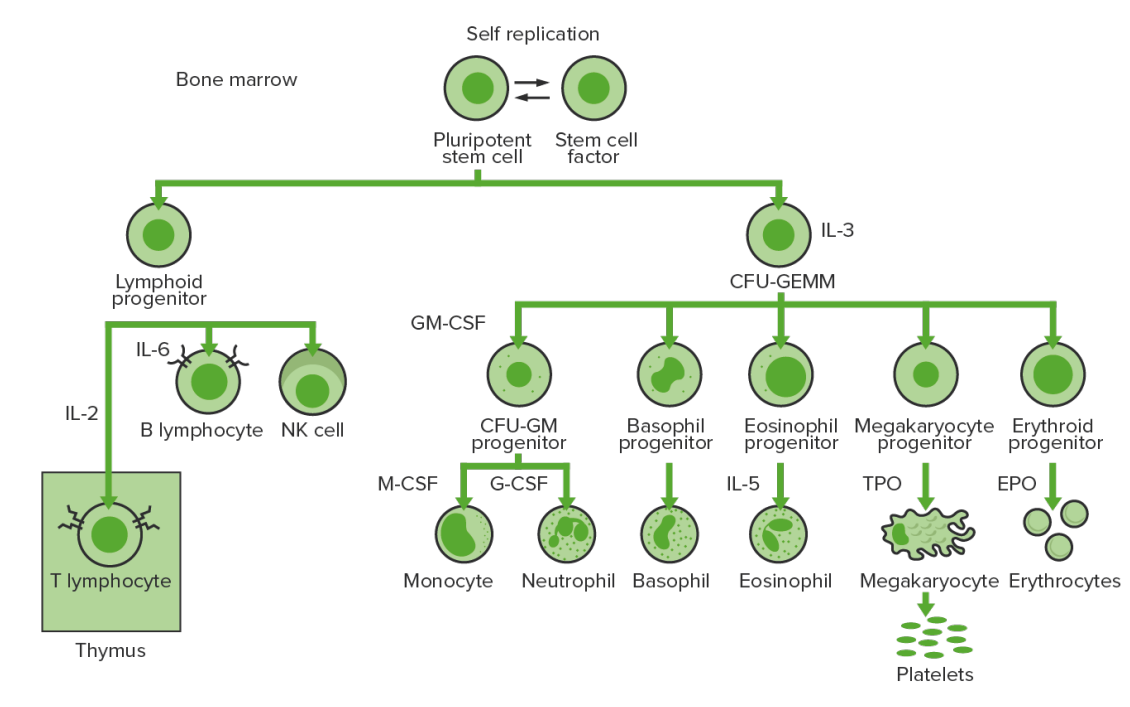
Hematopoiese na medula óssea: proliferação e diferenciação dos elementos figurados sanguíneos.
CFU-GEMM, pela sigla em inglês: unidade formadora de colónias de granulócitos, eritrócitos, monócitos, megacariócitos
CFU-GM, pela sigla em inglês: unidade formadora de colónias de granulócitos-macrófagos
GM-CSF, pela sigla em inglês: fator estimulador de colónias de granulócitos-macrófagos
M-CSF, pela sigla em inglês: fator estimulador de colónias de macrófagos
G-CSF, pela sigla em inglês: fator estimulador de colónias de granulócitos
NK: “natural killer”
TPO: trombopoietina
Mutações em genes associados à hematopoiese são observadas numa proporção significativa de casos de MFP.
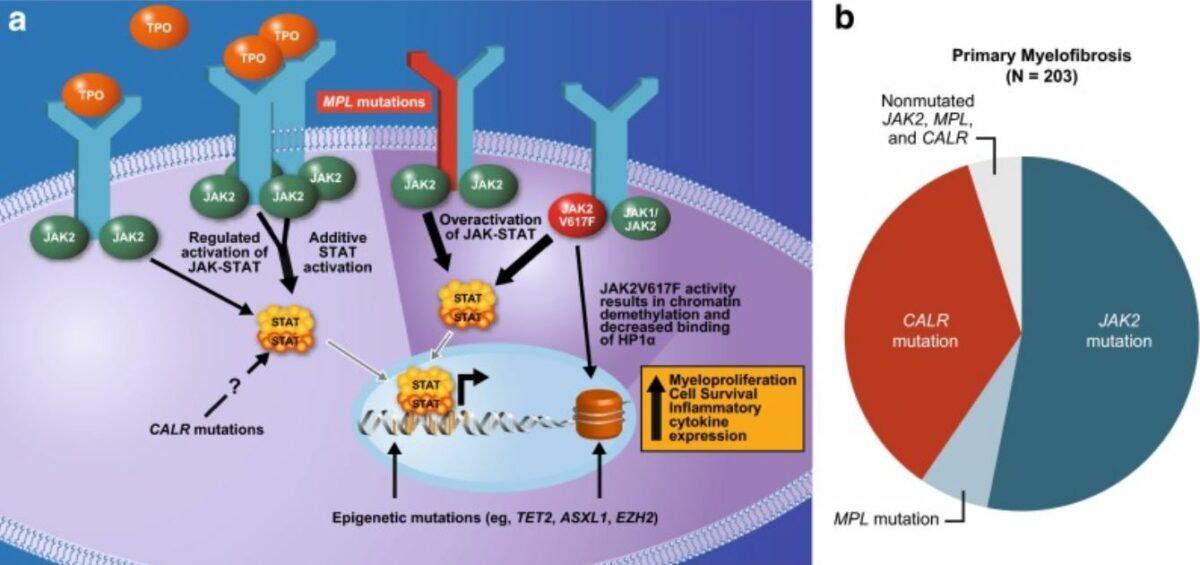
Mutações subjacentes à fisiopatologia da mielofibrose:
Frequentemente afeta a via JAK-STAT
JAK2 (gene JAK2 envolvido): tirosina cinase não recetora que facilita o alcance de sinais extracelulares ao núcleo e a ativação de genes.
MPL ou recetor de trombopoietina (gene MPL envolvido): ativação do recetor de trombopoietina
A calreticulina (gene CALR envolvido) é um regulador da STAT e a mutação causa a ativação do recetor de trombopoietina.
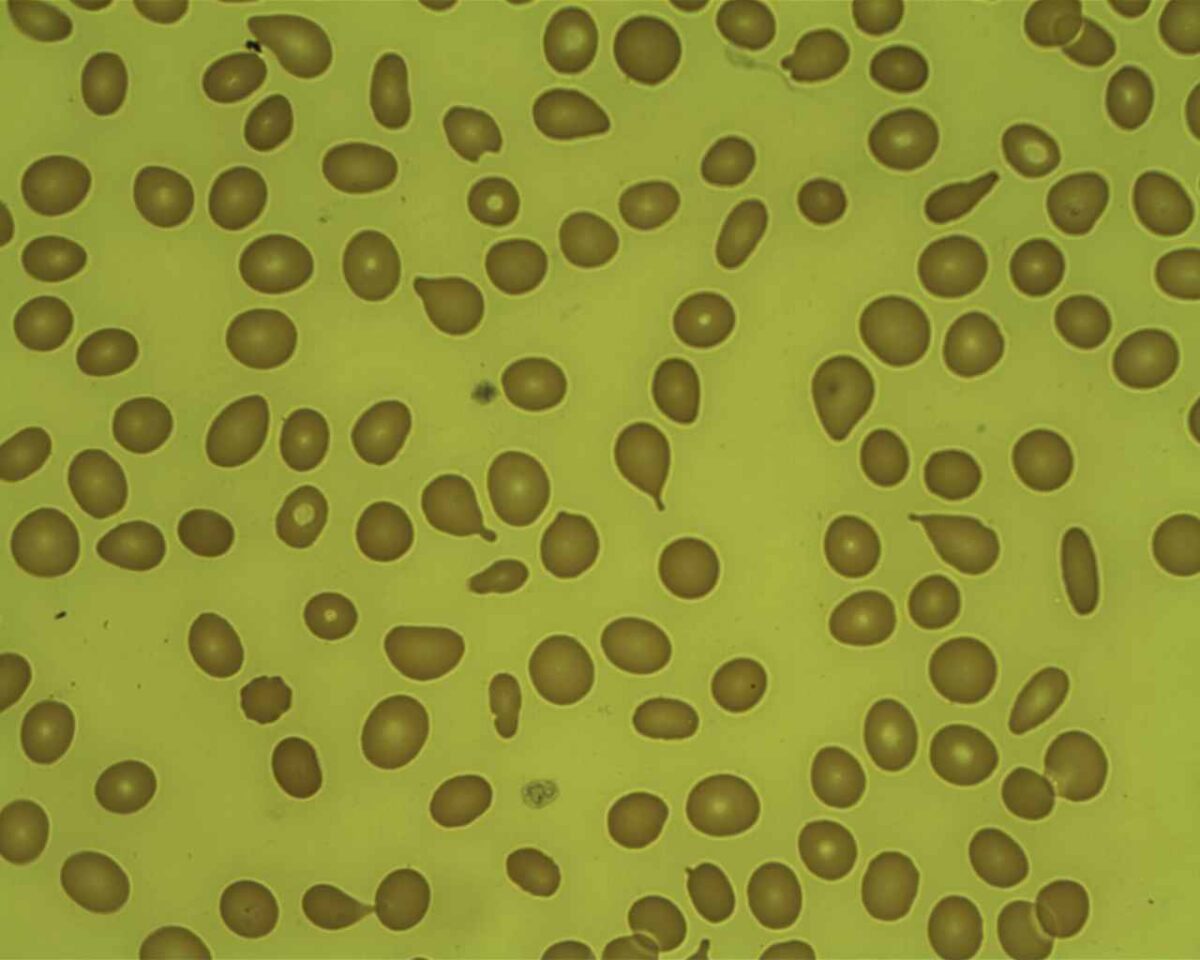
Mielofibrose: células em lágrima em esfregaço de sangue periférico
Imagem: “Tear Drop Poikilocytes” por Prof. Osaro Erhabor. Licença: CC0 1.0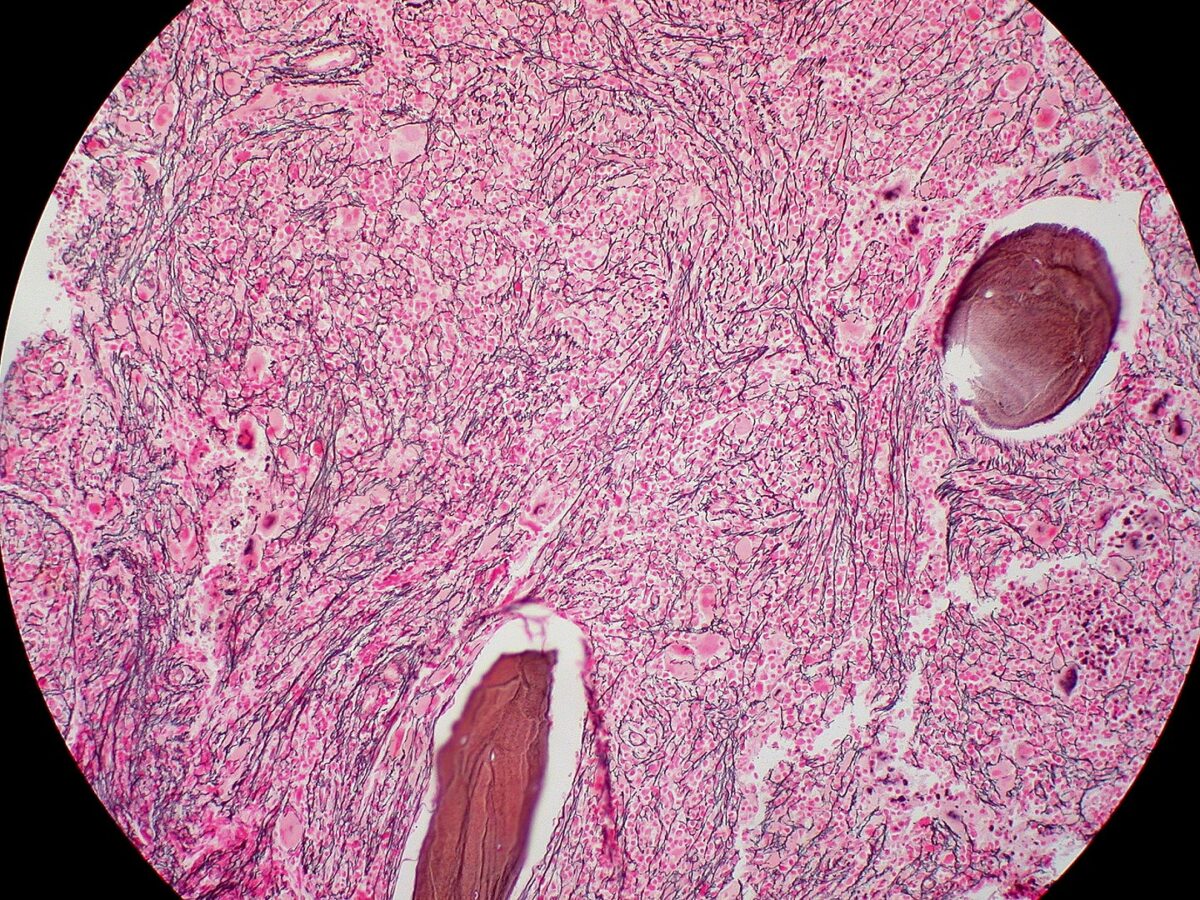
Biópsia da medula óssea na mielofibrose: fibrose extensa (coloração de reticulina)
Imagem: “Myelofibrosis, Reticulin Stain (6032644716)” por Ed Uthman. Licença: CC BY 2.0Em resumo, para lembrar a MFP: Bone marrow is crying (teardrop cells) because it is fibrosed and is a dry tap (A medula óssea chora (células em forma de lágrima) porque está fibrosada e é uma torneira seca).
As neoplasias mieloproliferativas podem ser comparadas de acordo com a seguinte classificação da OMS:
| Doença | Mutação | Pontos chave |
|---|---|---|
| LMC | BCR-ABL1 (cromossoma Filadelfia) | Proliferação de granulócitos maduros e em maturação |
| TE | JAK2, CALR ou MPL | Produção clonal excessiva de plaquetas |
| Policitemia vera (PV) | JAK2 | Aumento da massa eritrocitária |
| MFP | JAK2, CALR ou MPL | Fibrose obliterante da medula óssea |
Outros tipos:
A avaliação do risco é importante na tomada de decisões de tratamento.