O grupo heme corresponde a uma porfirina que contem ferro (constituída por 4 grupos pirrol), sintetizada maioritariamente na medula óssea e no fígado. O grupo heme faz parte da constituição de muitas substâncias essenciais, incluindo dos citocromos, da mioglobina e hemoglobina. As suas funções biológicas são, o transporte de gases (por exemplo, O2) e a transferência de eletrões. A biossíntese do grupo heme é um processo constituído por 8 etapas, iniciado pela síntese do ácido aminolevulínico. A disponibilidade do ferro interfere com a produção do grupo heme, dado que a última etapa envolve a inserção do ferro. Este ião é obtido através da dieta e da decomposição de produtos que contém grupo heme. Nos processos catabólicos, o heme é convertido em pigmentos biliares, ocorrendo a produção de bilirrubina. As mutações associadas às enzimas que participam na síntese do grupo heme levam a um grupo de patologias conhecidas como porfirias, e os defeitos no catabolismo do heme causam hiperbilirrubinemias.
Última atualização: Apr 25, 2025
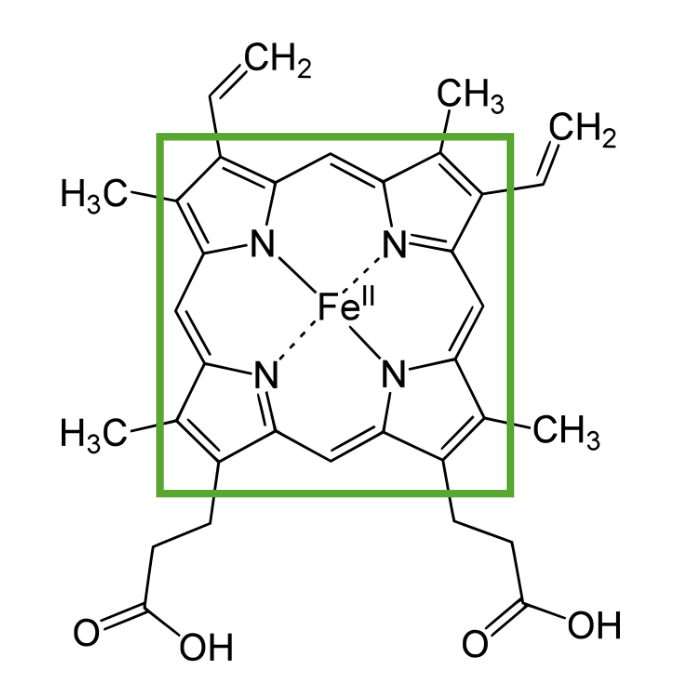
A imagem apresentada representa a estrutura do grupo heme e evidência a presença do anel de porfirina com ião de ferro no centro
Imagem por Lecturio.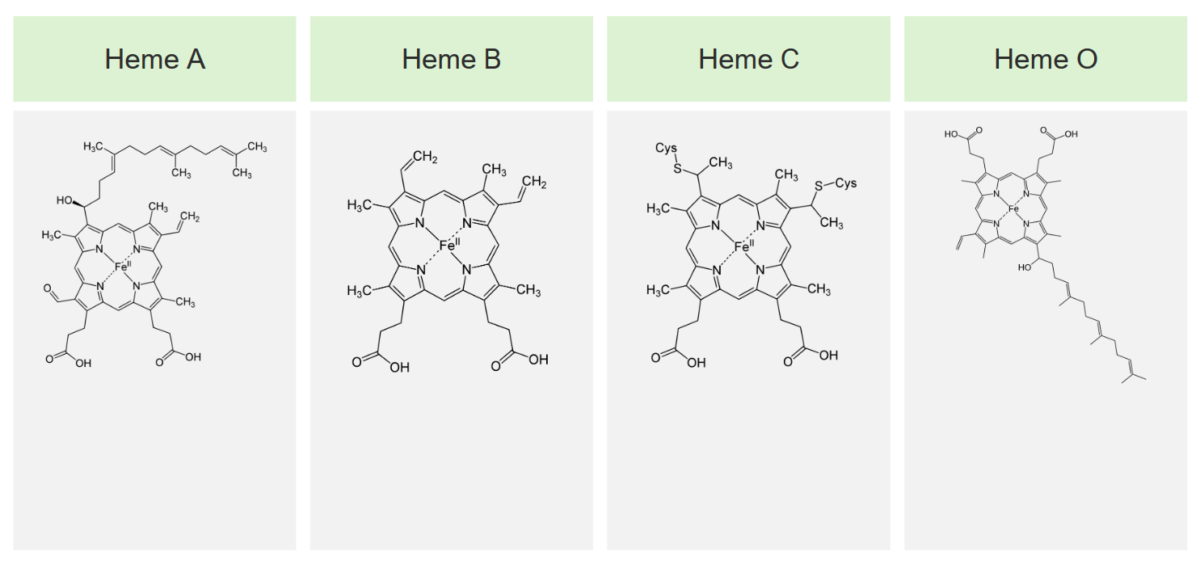
Os 4 principais tipos de grupo heme e as suas estruturas
Imagem por Lecturio.O grupo heme é sintetizado nos normoblastos, mas não nos eritrócitos maduros. A sua biossíntese ocorre em 8 etapas.
A 1.ª etapa consiste na síntese do ácido aminolevulínico.
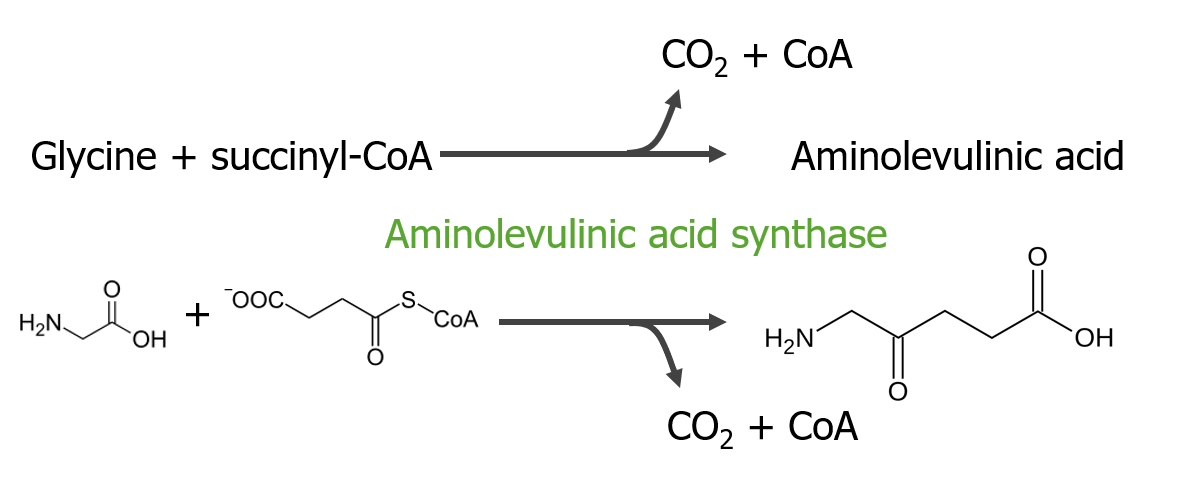
1.ª etapa do metabolismo do grupo heme
Imagem por Lecturio.A 2.ª etapa consiste na formação de porfobilinogénio (PBG).
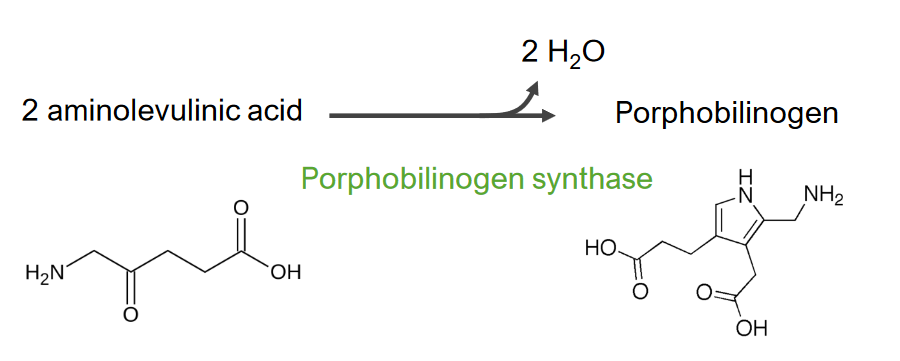
2.ª etapa do metabolismo do grupo heme
Formação de porfobilinogénio
A 3.ª etapa consiste na formação de hidroximetilbilano (HMB).
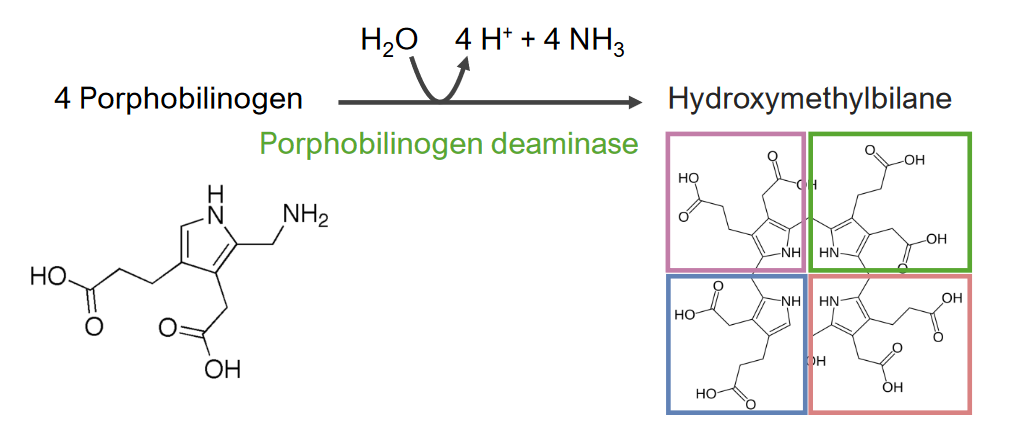
3.ª etapa do metabolismo do grupo heme:
Formação de hidroximetilbilano
A 4.ª etapa consiste na formação de uroporfirinogénio (UPG).
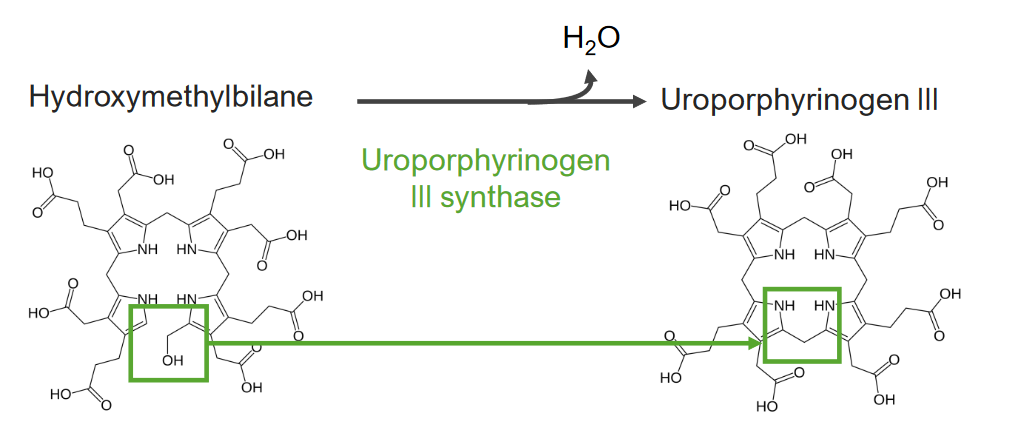
4.ª etapa do metabolismo do grupo heme:
Formação do uroporfirinogénio
A 5.ª etapa consiste na síntese de coproporfirinogénio (CPG) III.
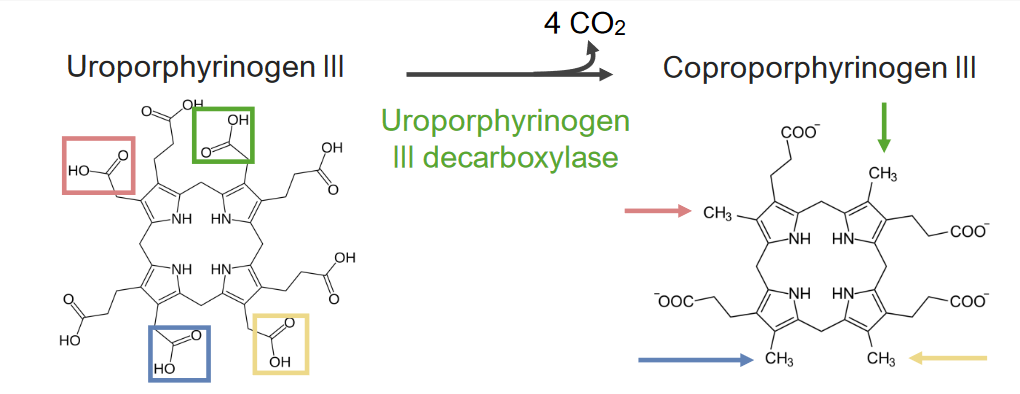
5.ª etapa do metabolismo do grupo heme:
Formação de coproporfirinogénio III
A 6.ª etapa corresponde à síntese de protoporfirinogénio (PPG).
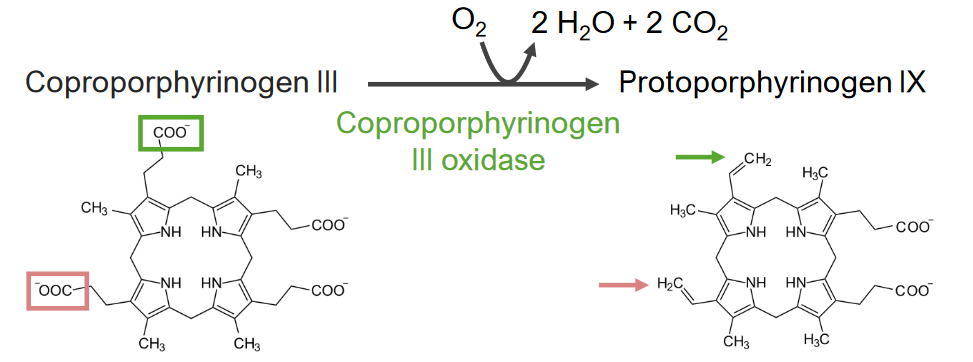
6.ª etapa do metabolismo do grupo heme:
Síntese de protoporfirinogêéio
A 7.ª etapa consiste na formação de protoporfirina (PP).
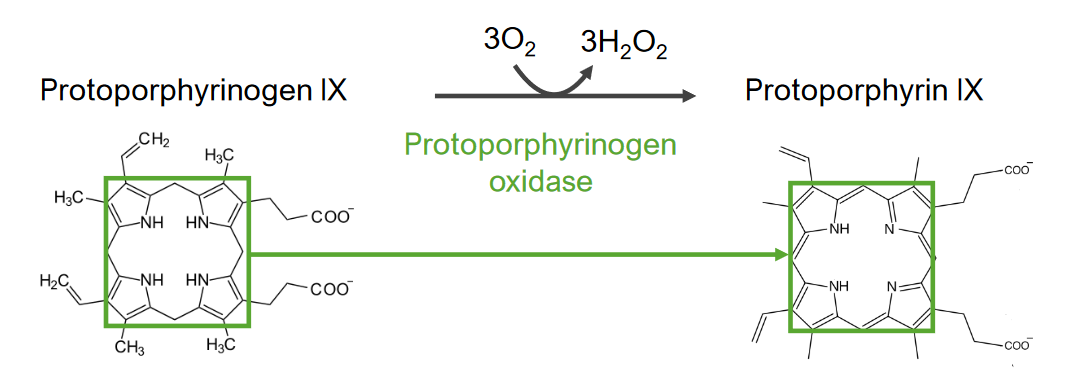
7.ª etapa do metabolismo do grupo heme:
Formação de protoporfirina a partir do protoporfirinogénio IX
A 8.ª etapa consiste na formação do grupo heme.
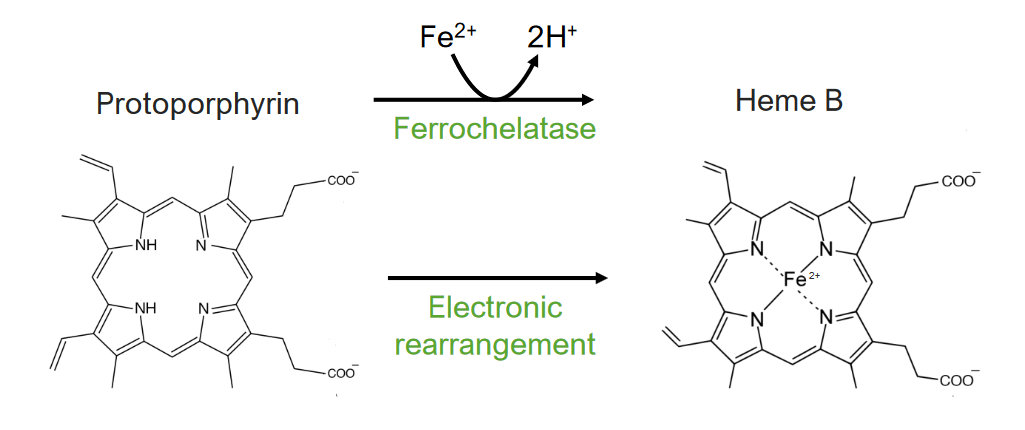
A 8.ª e última etapa do metabolismo do grupo heme:
Formação do grupo heme
| Etapa | Local do processo | Enzima | Doença associada com a presença de mutações genéticas enzimáticas |
|---|---|---|---|
| 1. Síntese de ácido aminolevulínico | Mitocôndria | Sintase do ácido aminolevulínico |
|
| 2. Formação de porfobilinogénio (PBG) | Citosol | Desidratase do ácido aminolevulínico ou sintase do PBG | Porfiria da desidratase do ácido aminolevulínico |
| 3. Formação de hidroximetilbilano (HMB) | Desaminase do PBG/Sintase do HMB | Porfiria aguda intermitente | |
| 4. Formação de uroporfirinogénio (UPG) | Sintase do UPG III | Porfiria eritropoiética congénita | |
| 5. Síntese de coproporfirinogênio (CPG) III | Desxarboxilase do UPG | Porfiria cutânea tardia e porfiria hepatoeritropoiética | |
| 6. Síntese de protoporfirinogénio (PPG) | Mitocôndria | Oxidase do CPG | Coproporfiria hereditária |
| 7. Formação de protoporfirina (PP) | Oxidase do protoporfirinogénio | Porfiria variegata | |
| 8. Formação do grupo heme | Ferroquelatase/sintase do heme | Protoporfiria eritropoiética |
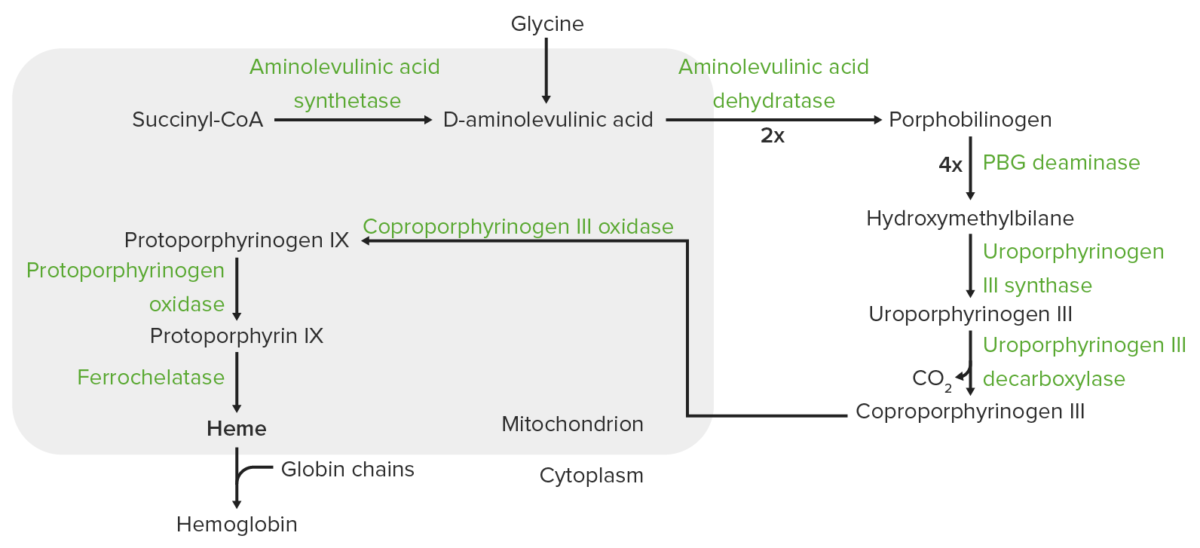
Síntese do grupo Heme:
O processo de síntese do grupo heme ocorre na mitocôndria e no citoplasma.
Nas mitocôndrias, a succinil coenzima A (CoA) combina-se com a glicina para formar o ácido aminolevulínico.
Esta reação é catalisada pela sintase do ácido aminolevulínico. O ácido aminolevulínico sai para o citoplasma, onde 2 moléculas de ácido aminolevulínico condensam-se para produzir o porfobilinogénio (PBG). As etapas subsequentes levam à formação do coproporfirinogénio III, que é transportado de volta para a mitocôndria. A oxidase facilita a conversão do coproporfirinogénio III em protoporfirinogénio IX, que é convertido em protoporfirina IX. O ferro é inserido na protoporfirina IX, formando o grupo heme (catalisado pela ferroquelatase).
O grupo heme decompõem-se, com consequente formação de produtos finais como os pigmentos biliares, como a bilirrubina excretada pela bílis. As etapas de catabolismo do grupo heme são as seguintes:
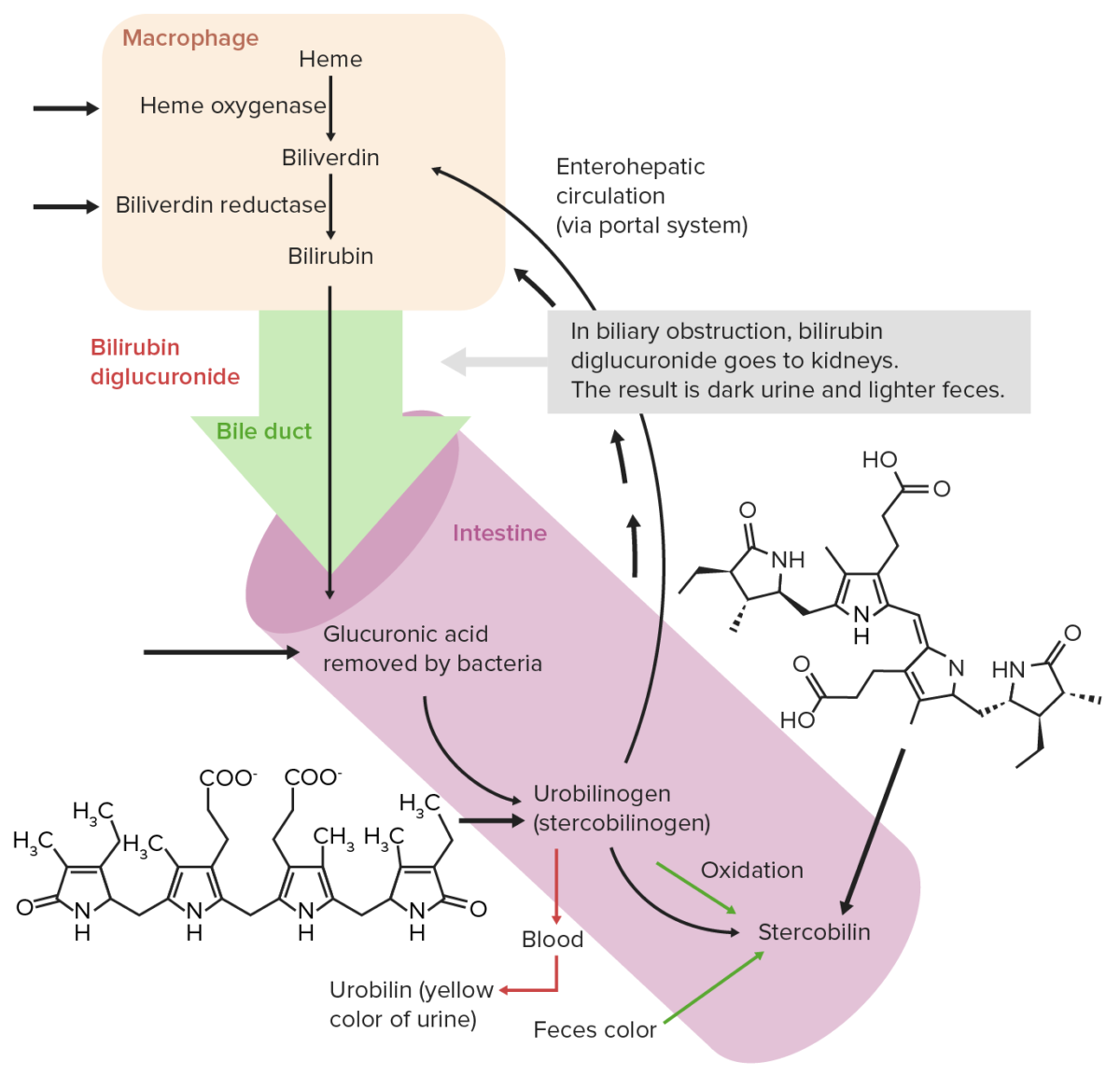
Circulação extra-hepática normal da bilirrubina
Imagem por Lecturio. Licença: CC BY-NC-SA 4.0Absorção de ferro:
Transporte do ferro:
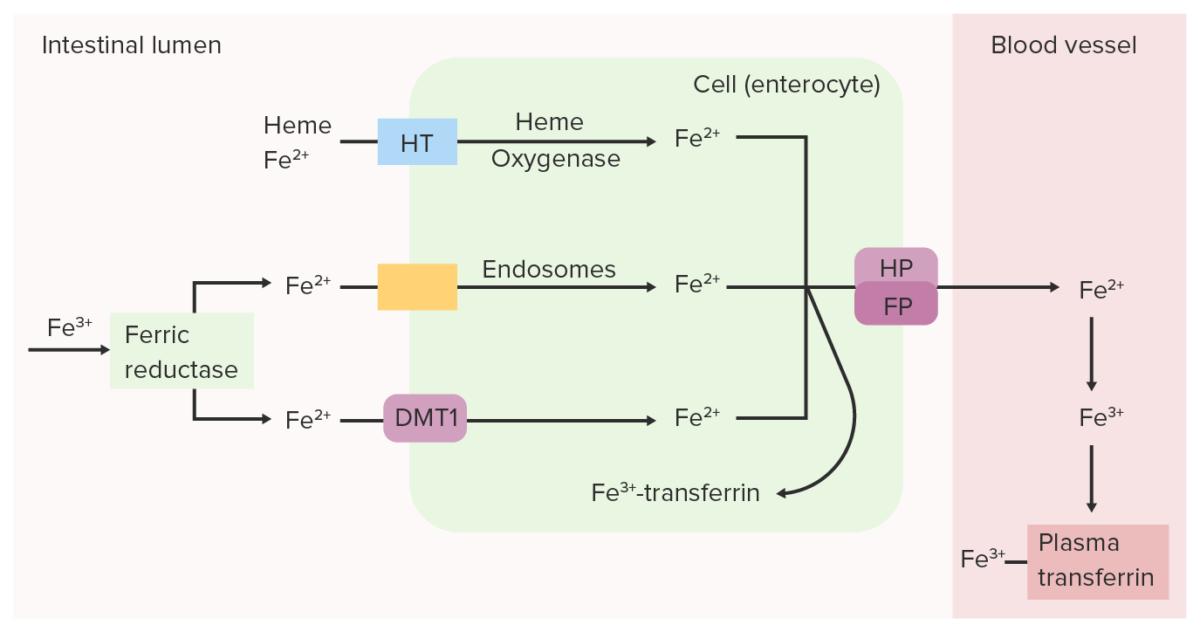
A redutase férrica (Fe 3+) intestinal reduz o Fe 3+ (férrico) a Fe 2+ (ferroso). O Fe 2+ é transportado do lúmen para a célula epitelial intestinal através do transportador de metal divalente 1 (DMT1, pela sigla em inglês), transportador do heme (HT) e/ou endossomas. O Fe 2+ pode ser convertido novamente em Fe 3+ e ligado à transferrina dentro da célula intestinal ou pode ser transportado para o sangue pela ferroportina (FP) e hefestina (HP). O ferro oxidado (Fe 3+), que se liga à transferrina plasmática, é transportado pela circulação até os tecidos.
Imagem por Lecturio.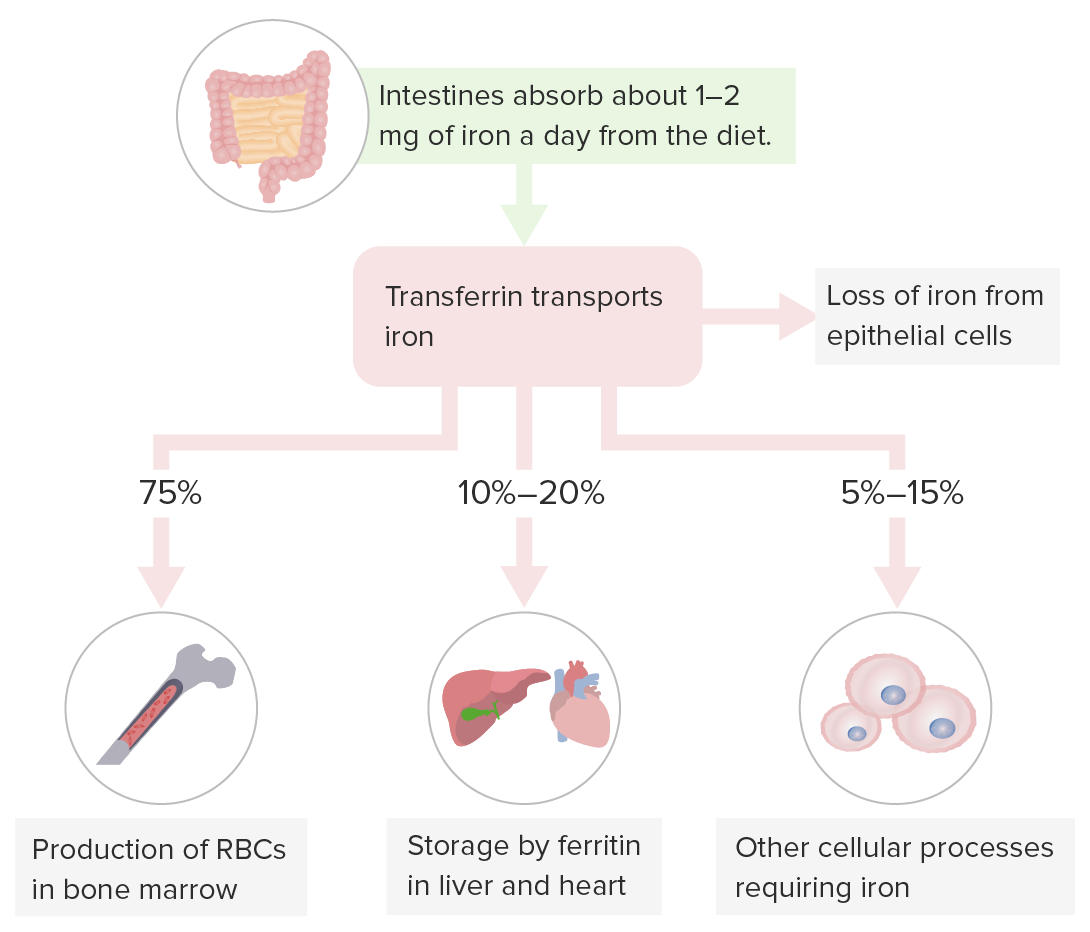
Armazenamento do ferro:
A transferrina transporta o ferro para a hematopoiese na medula óssea, armazenamento no fígado (local de armazenamento primário), e noutros órgãos, e para processos celulares que requerem ferro.
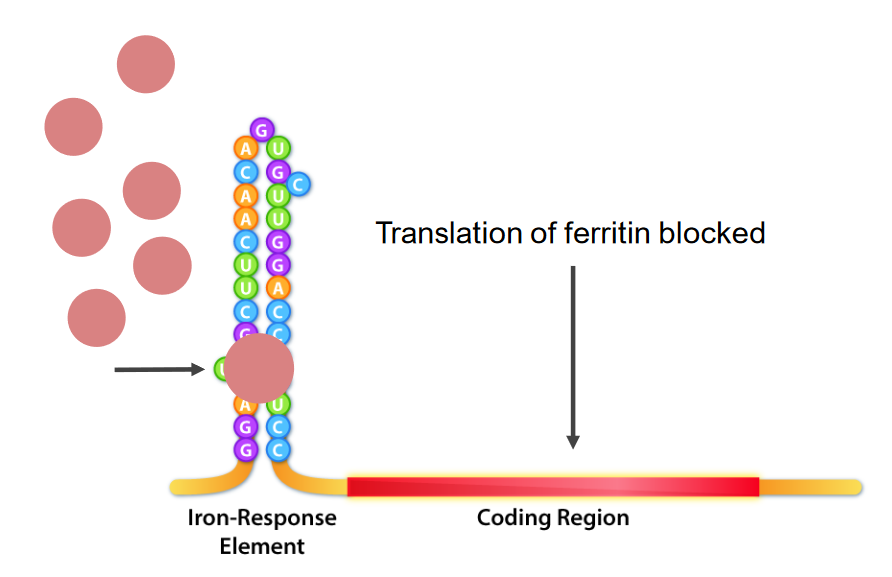
Interação das proteínas de ligação do elemento de resposta ao ferro (IRE, pela sigla em inglês) (IRBPs, pela sigla em inglês; estruturas redondas com cor rosa) e IRE, que é a estrutura da ansa da haste na extremidade 5′ do mRNA. No défice de ferro, os IRBPs ligam-se aos IREs, causando a inibição da tradução do mRNA da ferritina.
Imagem por Kevin Ahern.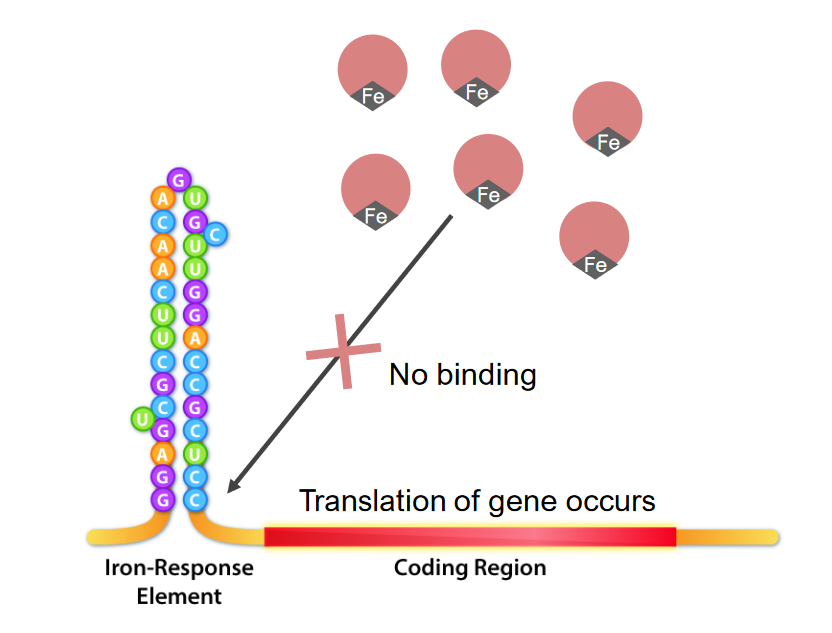
Interação de elementos de resposta do ferro e proteínas de ligação aos IRE (IRBPs) no caso de excesso de ferro:
O ferro liga-se aos IRBPs, tornando-os indisponíveis para se ligarem à ferritina. Isso permite a manutenção da tradução.
Em certas condições é necessário ocorrer uma diminuição ou aumento na absorção de ferro e nos níveis de ferro circulante. Esta via é regulada pela hepcidina: