Os inibidores enzimáticos ligam-se às enzimas e diminuem a sua atividade. Os ativadores enzimáticos ligam-se às enzimas e aumentam a sua atividade. As moléculas que diminuem a atividade catalítica das enzimas podem-se apresentar de várias formas, incluindo a inibição reversível ou irreversível. A inibição reversível pode ser competitiva, não competitiva, ou incompetitiva.
Última atualização: Apr 17, 2025
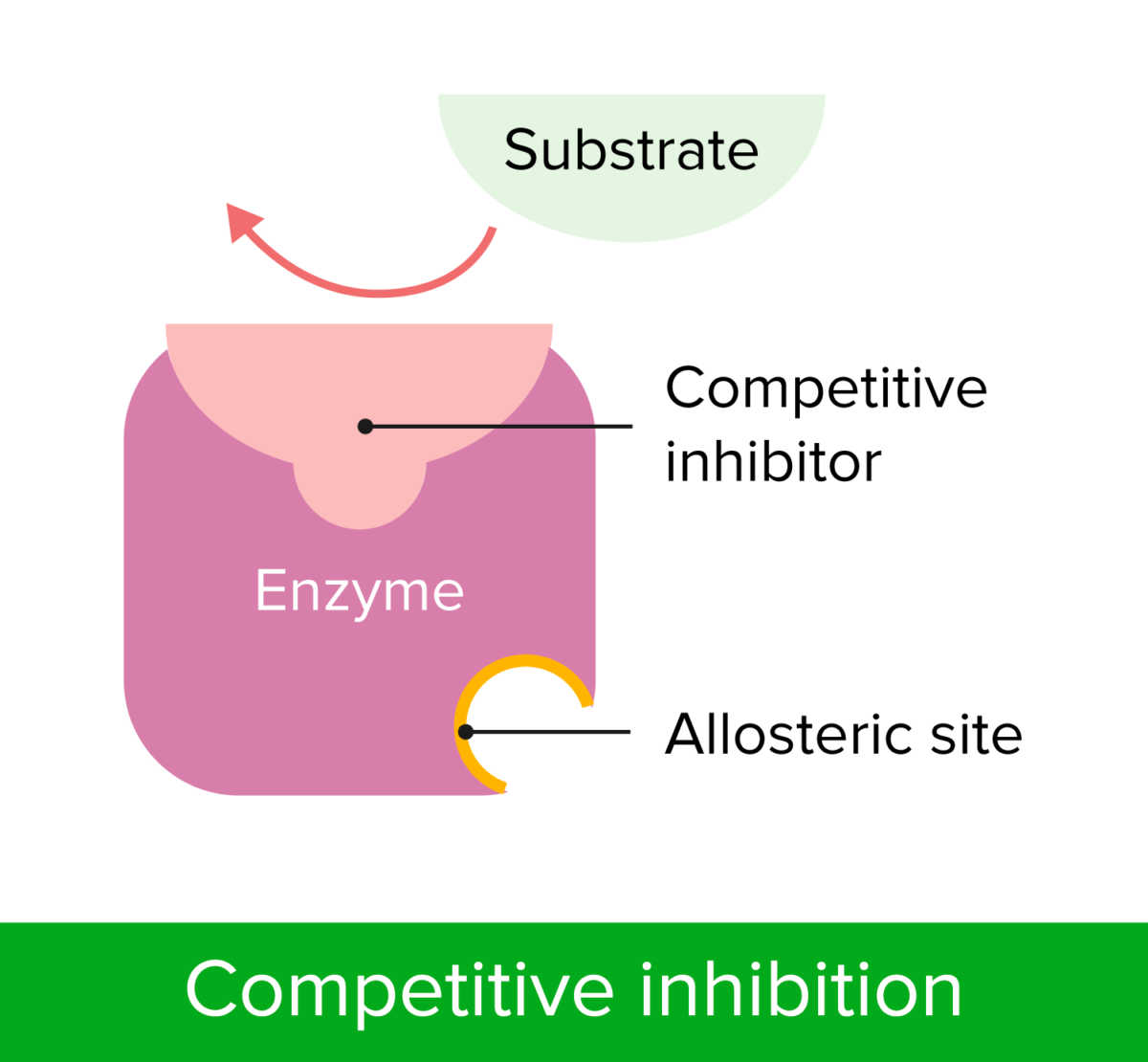
Inibição competitiva
Image by Lecturio.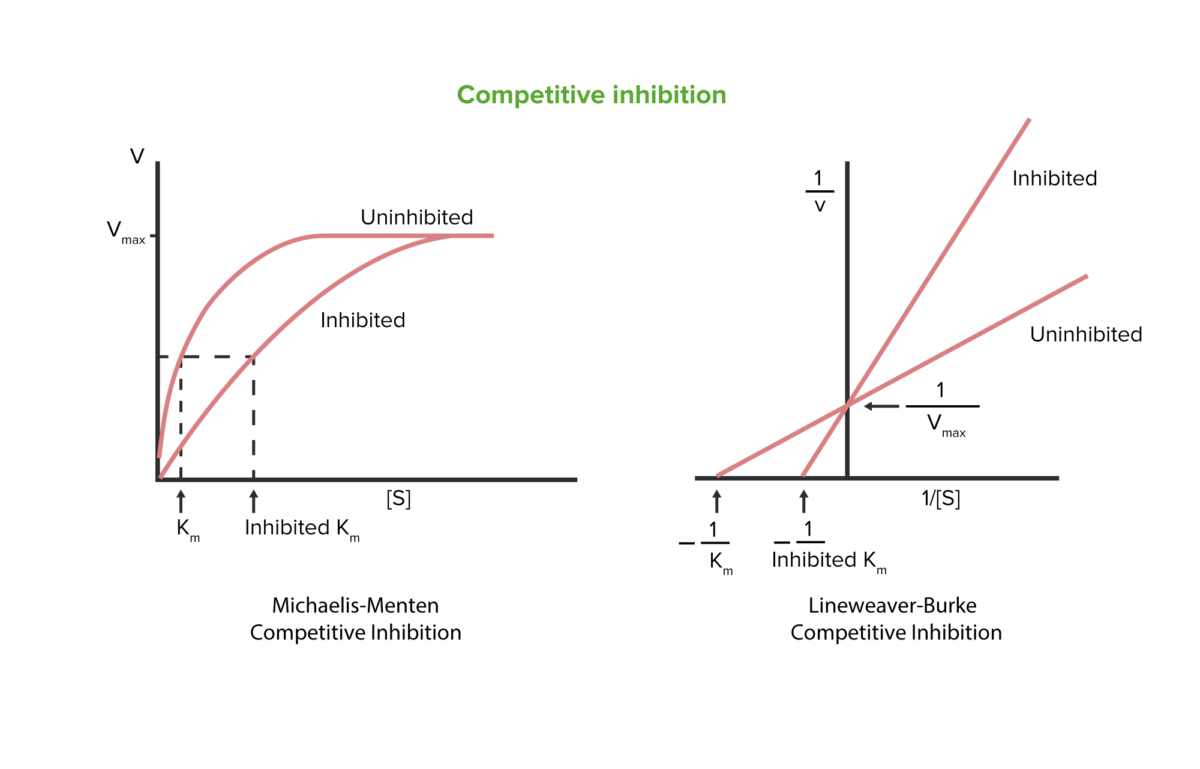
Inibição competitiva
Image by Lecturio.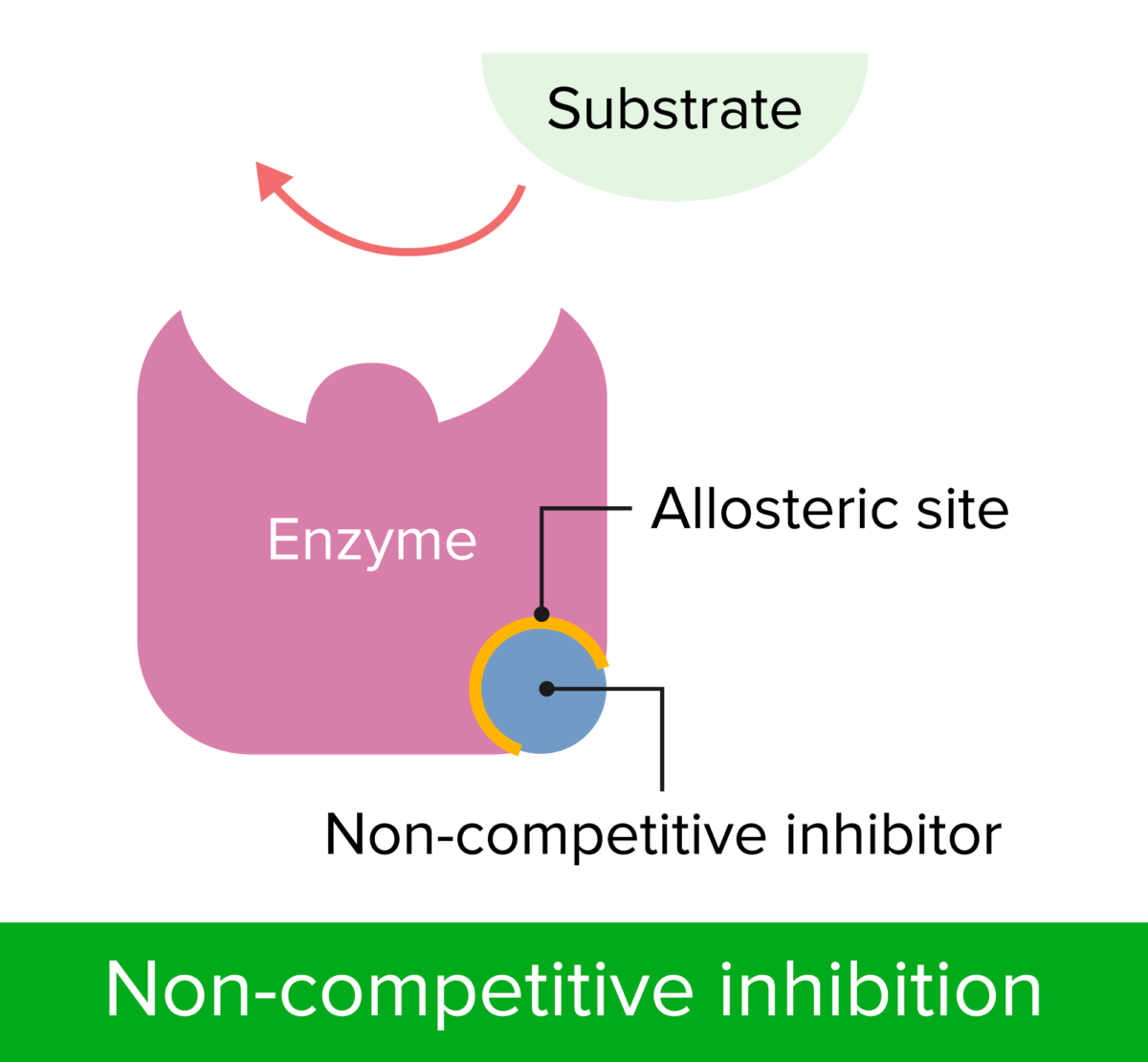
Inibição não competitiva
Image by Lecturio.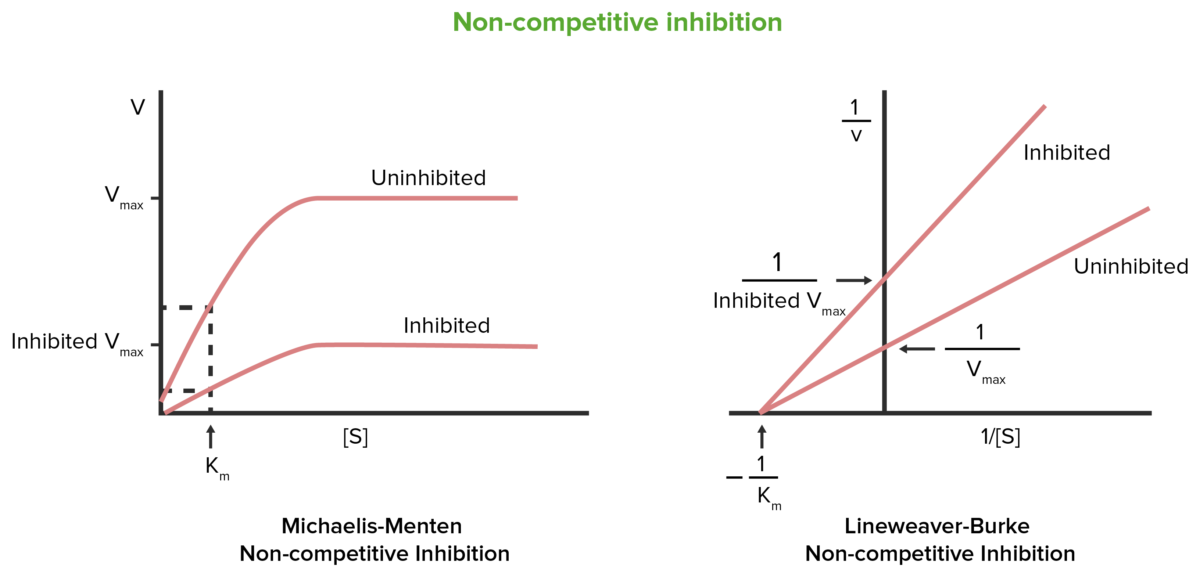
Inibição não competitiva
Image by Lecturio.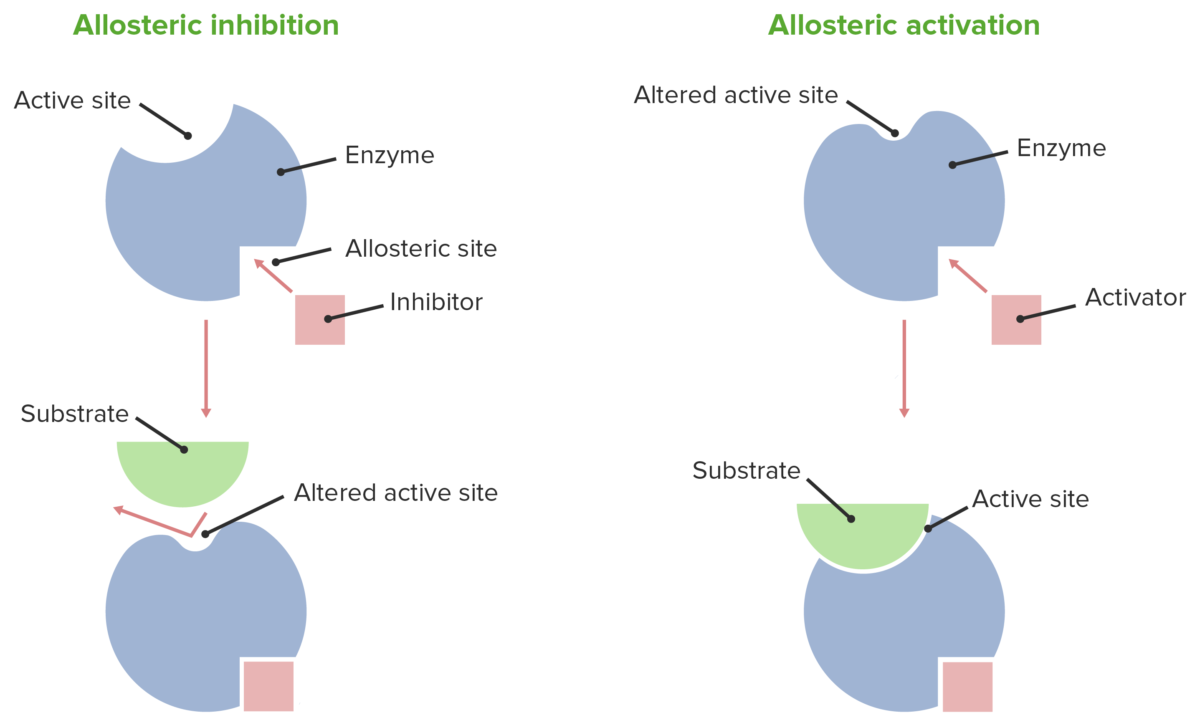
Efeitos alostéricos
Image by Lecturio.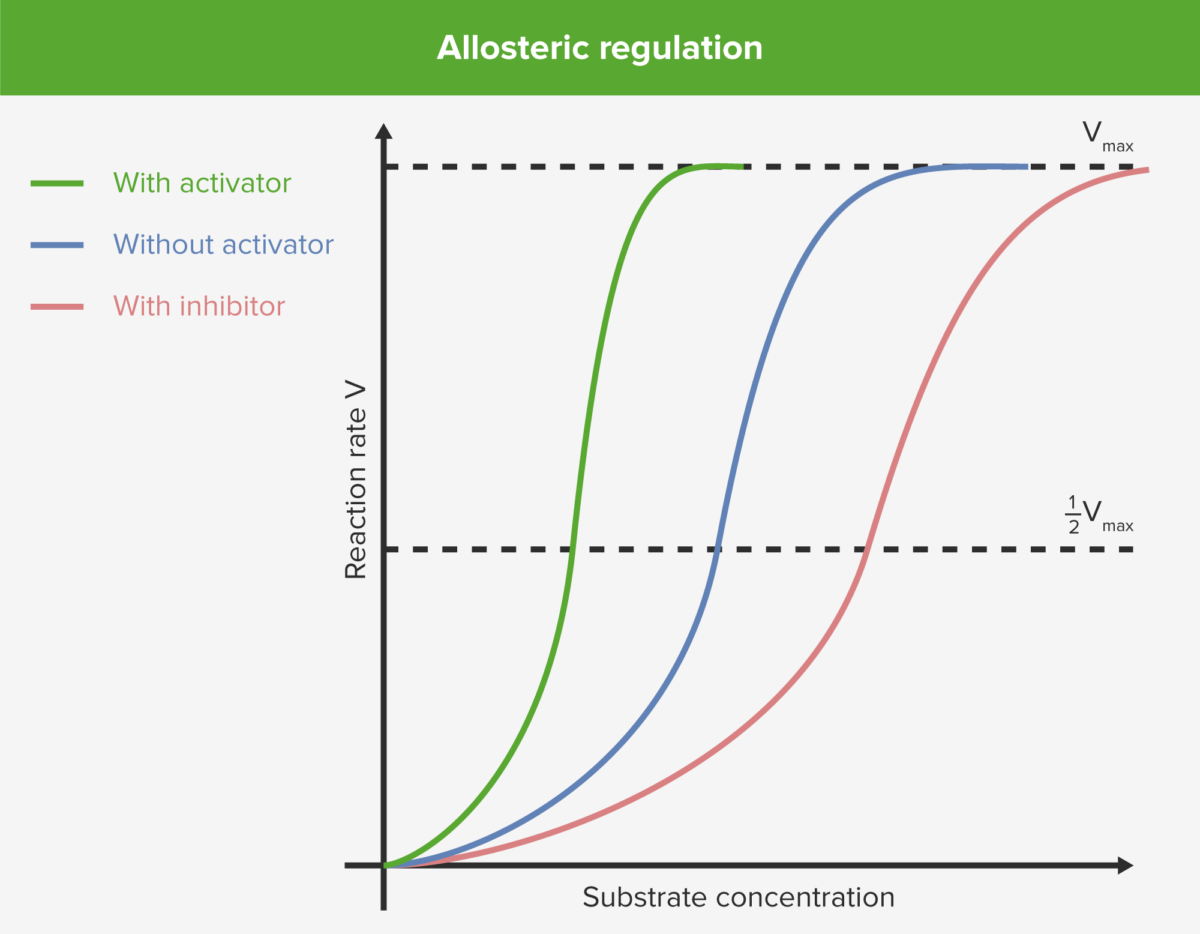
Regulação alostérica
Image by Lecturio.