A imunoterapia contra neoplasias é uma terapêutica médica de rápido avanço, que aproveita o sistema imunológico para conter ou eliminar as células cancerígenas. Atualmente, as imunoterapias têm sido incorporadas aos regimes de tratamento estabelecidos para diferentes tipos de neoplasias. Existem várias abordagens terapêuticas, incluindo o uso de citocinas, vacinas, vírus oncolíticos, manipulação de células T ou imunoterapia celular adotiva, ou anticorpos contra moléculas do checkpoint imunológico. Estas terapêuticas oferecem novas opções em neoplasias avançadas, incluindo no melanoma, no carcinoma de células renais, no adenocarcinoma da próstata, na neoplasia do pulmão, no carcinoma urotelial, no linfoma de Hodgkin e na LLA de células B refratária. Por envolverem o sistema imunológico, estes agentes apresentam efeitos adversos e toxicidades graves e potencialmente fulminantes.
Última atualização: Jun 14, 2022
O sistema imunológico fornece defesa (imunidade) contra agentes patogénicos invasores que variam de vírus a parasitas, e os seus componentes estão interconectados pelo sangue e pela circulação linfática.
As 2 linhas de defesa (que se sobrepõem):
Ocorrem por dia mais de 20.000 eventos que danificam o DNA, os quais são reparados por vias específicas, não causando nenhum efeito duradouro.
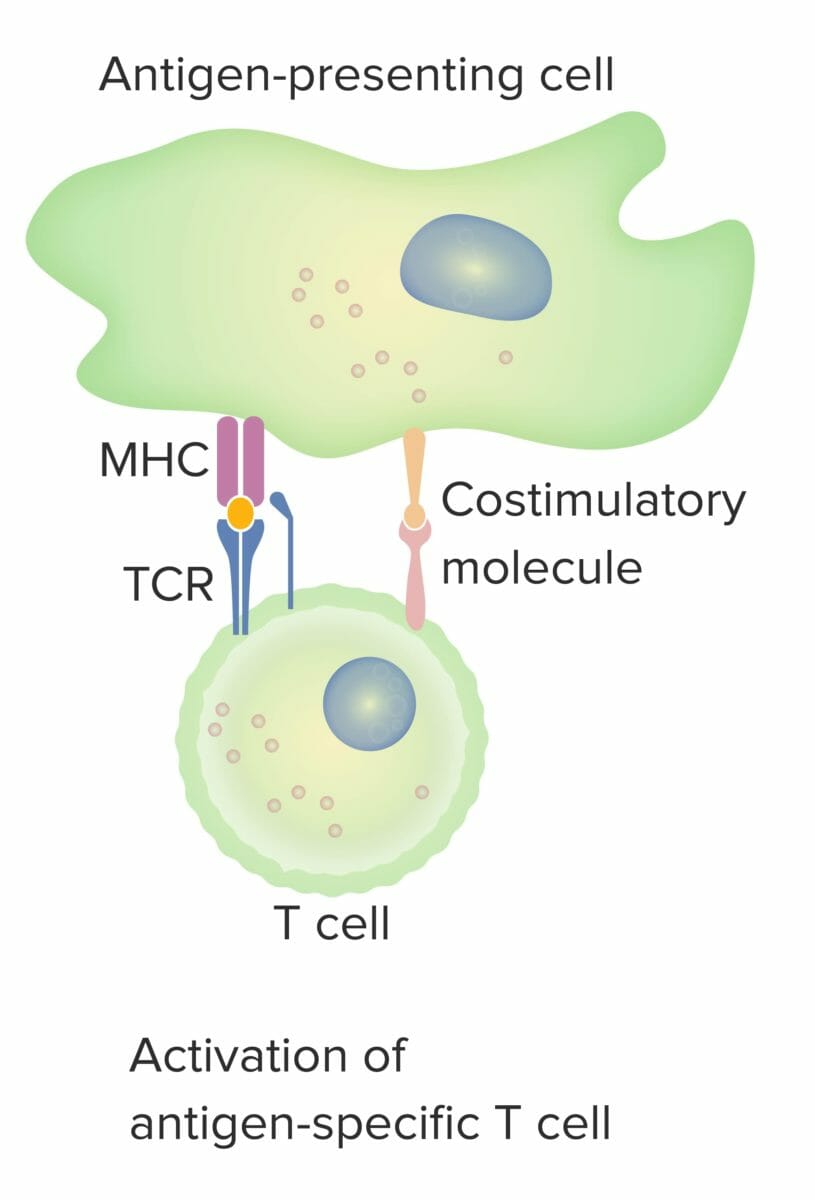
Modelo de 2 sinais representativos da dependência da coestimulação pelas células T:
Quando tanto o sinal 1 (recetor de células T (TCR, pela sigla em inglês) liga-se ao antigénio associado, apresentado pela molécula do MHC na célula apresentadora de antigénio) como o sinal 2 (interação da molécula coestimuladora entre a célula apresentadora de antigénio e a célula T) estão presentes, a célula T madura é totalmente ativada.
A mancha laranja indica a ligação adequada entre o antigénio e o TCR.
A imunoedição é um processo que consiste na supressão imunológica do tumor, mas pode levar à progressão do mesmo. A imunoedição ocorre em 3 fases principais:
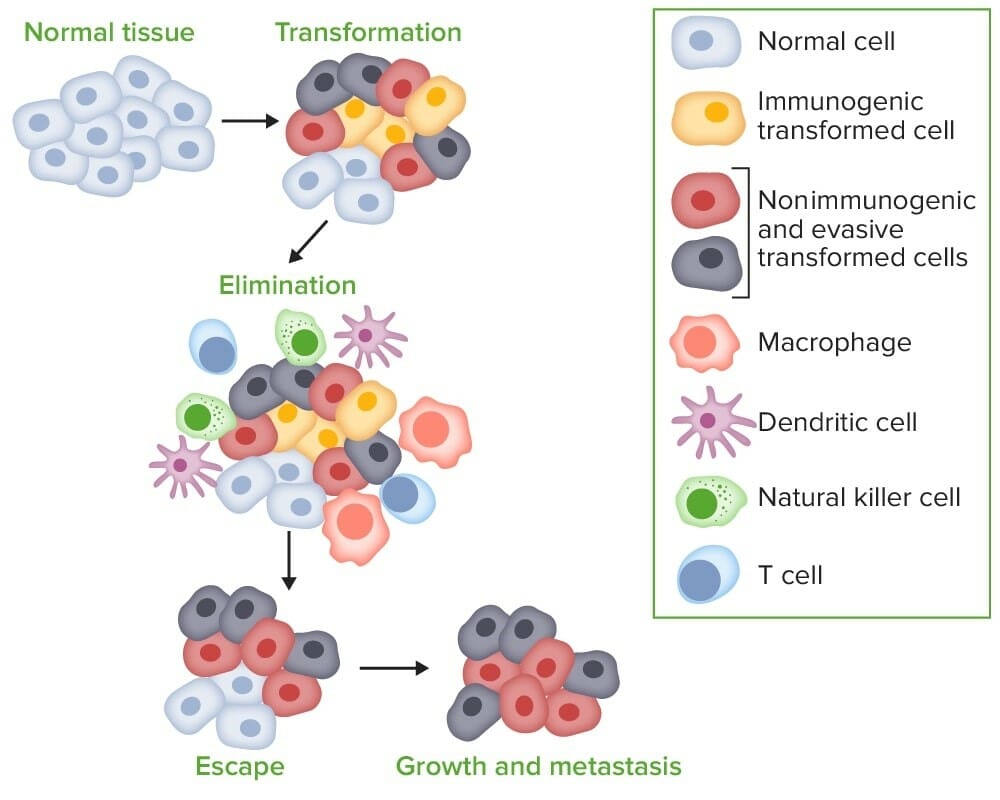
Carcinogénese por evasão imune:
Quando as células tumorais se transformam a partir de células normais, os sistemas imunológicos inato e adaptativo detetam e eliminam as células transformadas, antes mesmo que a doença seja clinicamente aparente (eliminação). O processo entra em equilíbrio, porque as variantes de células tumorais podem não ser completamente eliminadas. No entanto, o sistema imunológico tenta controlar o crescimento de células tumorais exercendo pressão seletiva sobre as células tumorais altamente imunogénicas. A imunogenicidade das células tumorais é editada, deixando-as crescer e escapar à imunovigilância célular pela imunogenicidade reduzida, o que leva à progressão para a fase de escape, onde as células menos imunogénicas crescem progressivamente e se tornam num cancro clinicamente aparente.
A imunoterapia contra o cancro estimula o sistema imunológico a responder a uma malignidade, ativando diferentes aspetos do sistema imunológico para atacar as células cancerígenas.
Estas terapias são desenvolvidas com base na manipulação das células do indivíduo através da expansão in vitro de células T tumor-específicas, que são reinfundidas através de um transplante autólogo.
Técnicas de manipulação de células T (e outros tipos de células imunes):
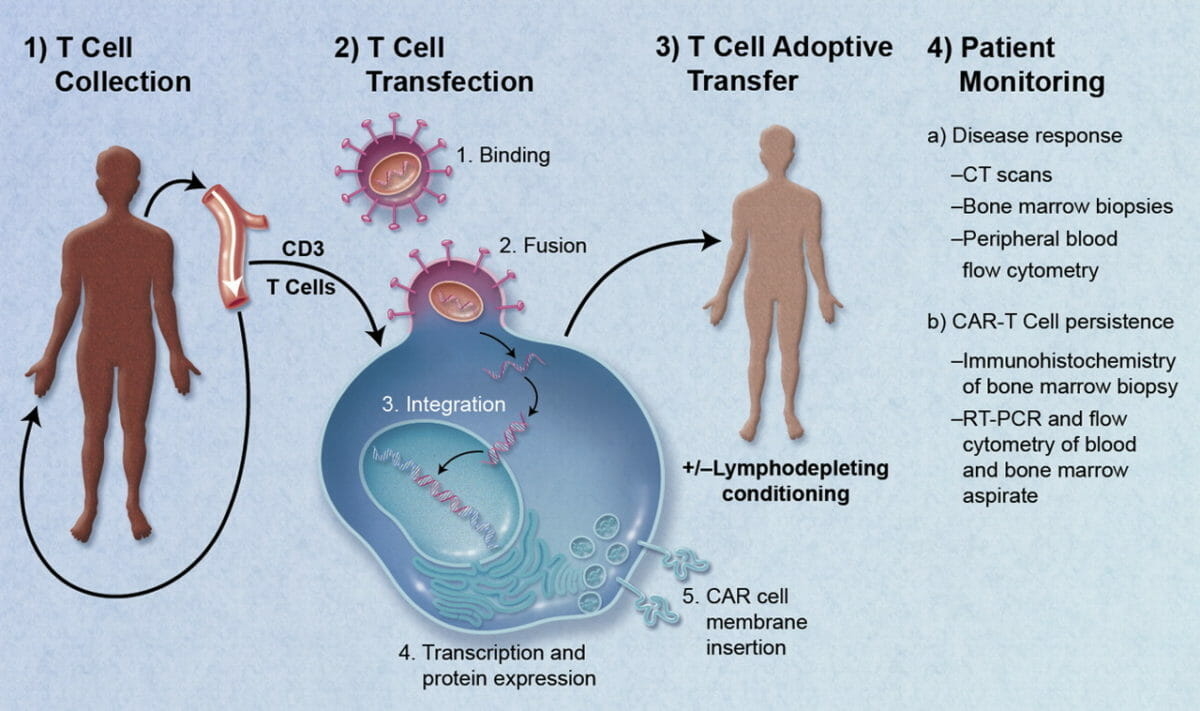
Imunoterapia adaptativa celular:
1) As células T são colhidas.
2) As células T são projetadas para expressarem recetores de antigénio quiméricos (CARs, pela sigla em inglês), seguidos de expansão in vitro.
3) Estas células são então infundidas no mesmo indivíduo. As mesmas entram em circulação, reconhecendo e destruindo as células malignas.
4) Segue-se a monitorização subsequente da resposta à doença.
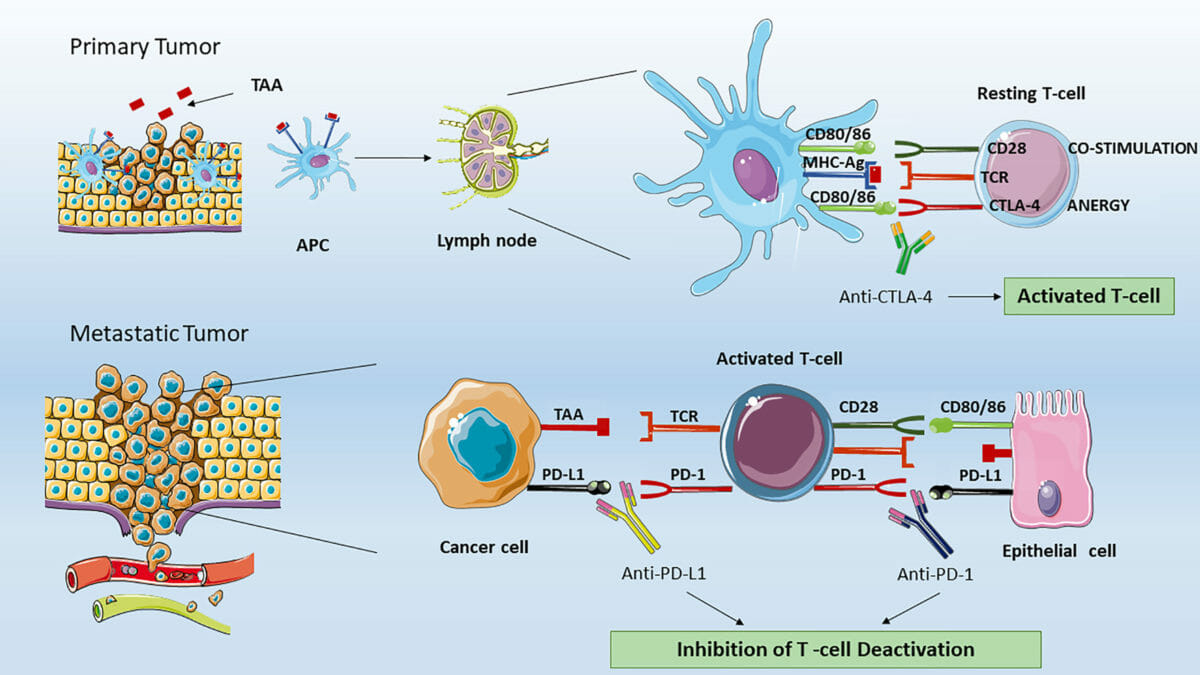
Inibidores do checkpoint imunológico:
Topo: As células apresentadoras de antigénios processam antigénios associados a tumores (TAAs, pela sigla em inglês) e complexam-nos em moléculas de MHC.
As células apresentadoras de antigénios migram para os gânglios linfáticos (em áreas dominadas por células T) e apresentam TAAs às células T virgens.
A ativação da célula T requer 2 sinais. O 1ª é mediado pela ligação do TAA a um recetor de células T (TCR, pela sigla em inglês). O segundo sinal pode ser da ligação do CD28 da célula T ao coestimulador CD80/CD86, que ativa a célula T.
No entanto, quando o CTLA-4 da célula T interage com as mesmas moléculas CD80/CD86 das células apresentadoras de antigénio, o efeito é inibitório (anergia das células T ou ausência de ativação das células T).
Portanto, o CTLA-4 e o CD28 competem pela ligação às proteínas CD80/CD86. A ação bloqueadora anti-CTLA-4 do ipilimumab restaura a sinalização do pró-ativador CD28, resultando em respostas antitumorais de linfócitos T.
Parte inferior: Em tecidos periféricos, a célula T ativada pode ser desativada pela ligação de morte celular programada-1 (PD-1, pela sigla em inglês) da célula T ao ligante de morte celular programada 1 (PD-L1, pela sigla em inglês) (ou PD-L2) expresso nas células tumorais. A ação bloqueadora anti-PD-1 ou anti-PD-L1 por anticorpos monoclonais (e.g., nivolumab, pembrolizumab, atezolizumab) restaura a atividade antitumoral efetiva dos linfócitos T.
| Grupo terapêutico | Agentes | Indicações |
|---|---|---|
| Citocinas imunoestimuladoras | IL-2 |
|
| IFNα-2b |
|
|
| Vacinas | Sipuleucel-T | Adenocarcinoma da próstata resistente à castração |
| Bacille Calmette-Guérin (BCG) | Neoplasia da bexiga | |
| Agentes imunomoduladores |
|
Mieloma múltiplo |
| Vírus oncolíticos | T-VEC | Melanoma |
| Terapia com células T CAR | Os agentes estão disponíveis no programa REMS da FDA (somente para uso autólogo). |
|
| BiTE (terapia direcionada ao CD3) | Blinatumomab | Leucemia Linfocítica Aguda (LLA) |
| Grupo terapêutico | Agentes | Indicações |
|---|---|---|
| Anti-PD-1 | Pembrolizumab |
|
| Nivolumab |
|
|
| Dostarlimab |
|
|
| Anti-PD-L1 | Atezolizumab |
|
| Avelumab |
|
|
| Durvalumab |
|
|
| Anti–CTLA-4 | Ipilimumab |
|