La inmunoterapia oncológica es una terapia médica que avanza rápidamente y que aprovecha el sistema inmunitario para contener o eliminar las células cancerosas. Actualmente, las inmunoterapias se han incorporado a los regímenes de tratamiento para diferentes tipos de cáncer. Existen varios enfoques terapéuticos, incluido el uso de citoquinas, vacunas, virus oncolíticos, manipulación de células T o inmunoterapia celular adoptiva, o anticuerpos contra moléculas de puntos de control inmunitarios. Estas terapias brindan nuevas opciones para los cánceres avanzados, incluidos el melanoma, el carcinoma de células renales, el adenocarcinoma de próstata, el cáncer de pulmón, el carcinoma urotelial, el linfoma de Hodgkin y la leucemia linfocítica aguda de células B refractaria. Con el sistema inmunológico involucrado, estos agentes conllevan efectos secundarios y toxicidades graves y potencialmente mortales.
Última actualización: Jul 12, 2022
El sistema inmune brinda defensa (inmunidad) contra patógenos invasores que van desde virus hasta parásitos, y los componentes están interconectados por la circulación sanguínea y linfática.
Las 2 líneas de defensa (que se superponen):
Cada día ocurren más de 20 000 eventos que dañan el ADN, los cuales se reparan a través de vías específicas, por lo que no causan un efecto duradero.
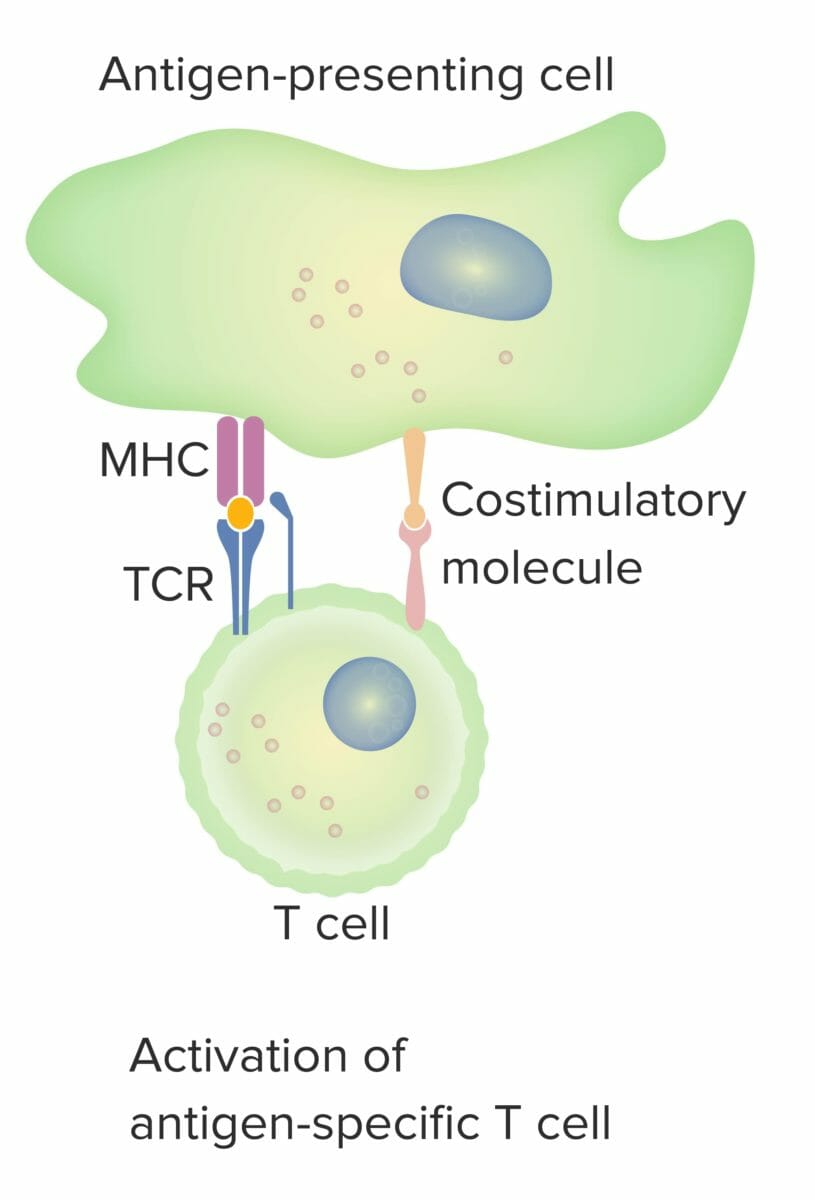
El modelo de 2 señales de la dependencia de las células T a la coestimulación:
Cuando tanto la señal 1 (receptor de células T que se une al antígeno afín presentado por la molécula del CMH en la célula presentadora de antígeno) como la señal 2 (interacción de la molécula coestimuladora entre la célula presentadora de antígeno y la célula T) están presentes, la célula T madura está totalmente activada.
El punto naranja indica la unión adecuada entre el antígeno y el receptor de células T.
La inmunoedición es un proceso que consiste en la supresión inmunológica del tumor, pero puede conducir a la progresión del tumor. La inmunoedición ocurre en 3 fases principales:
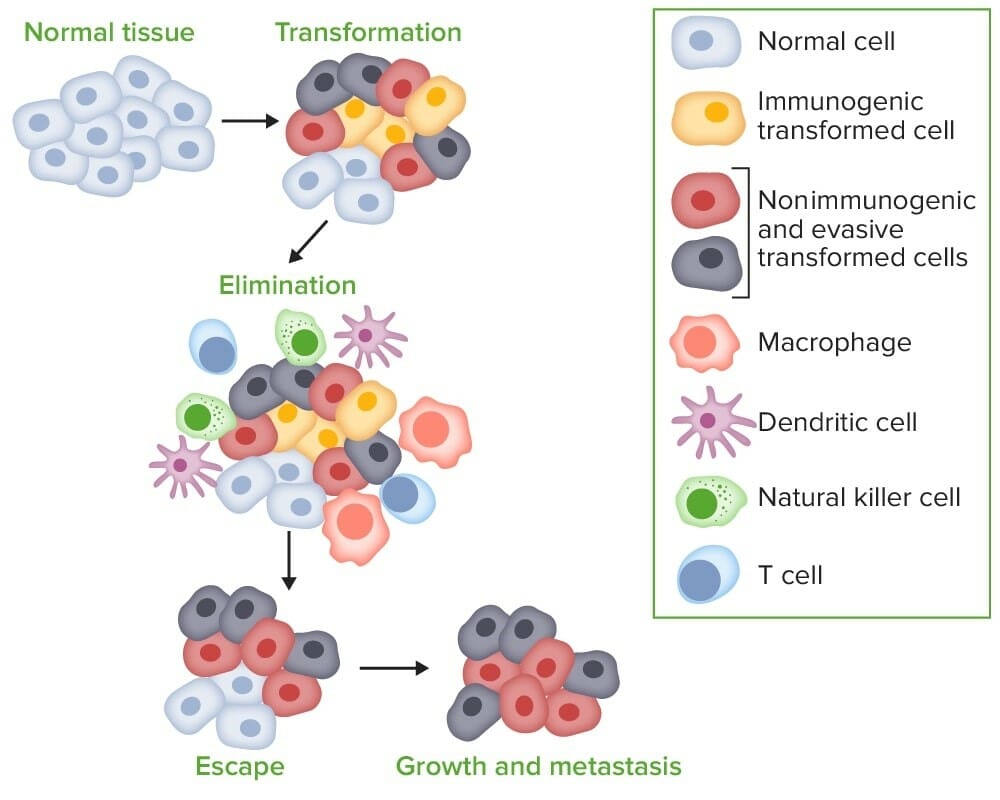
Carcinogénesis por evasión inmune:
Cuando las células tumorales se transforman a partir de células normales, los sistemas inmunitarios innato y adaptativo detectan y eliminan las células transformadas incluso antes de que la enfermedad sea clínicamente aparente (eliminación). El proceso entra en equilibrio, ya que es posible que las variantes de células tumorales no se eliminen por completo. Sin embargo, el sistema inmunitario intenta controlar el crecimiento de las células tumorales ejerciendo una presión selectiva sobre las células tumorales altamente inmunogénicas. Se edita la inmunogenicidad de las células tumorales, dejando que las células con inmunogenicidad reducida crezcan y evadan la inmunovigilancia, lo que lleva a la progresión de las células a la fase de escape, donde las células menos inmunogénicas crecen progresivamente y se vuelven clínicamente cancerosas.
La inmunoterapia contra el cáncer estimula el sistema inmunitario para que responda a una neoplasia maligna, activando diferentes aspectos del sistema inmunitario para atacar las células cancerosas.
Estas terapias se desarrollan con base en la manipulación de las células del individuo a través de la replicación in vitro de células T específicas del tumor, que se reinfunden mediante trasplante autólogo.
Técnicas de manipulación de células T (y otros tipos de células inmunitarias):
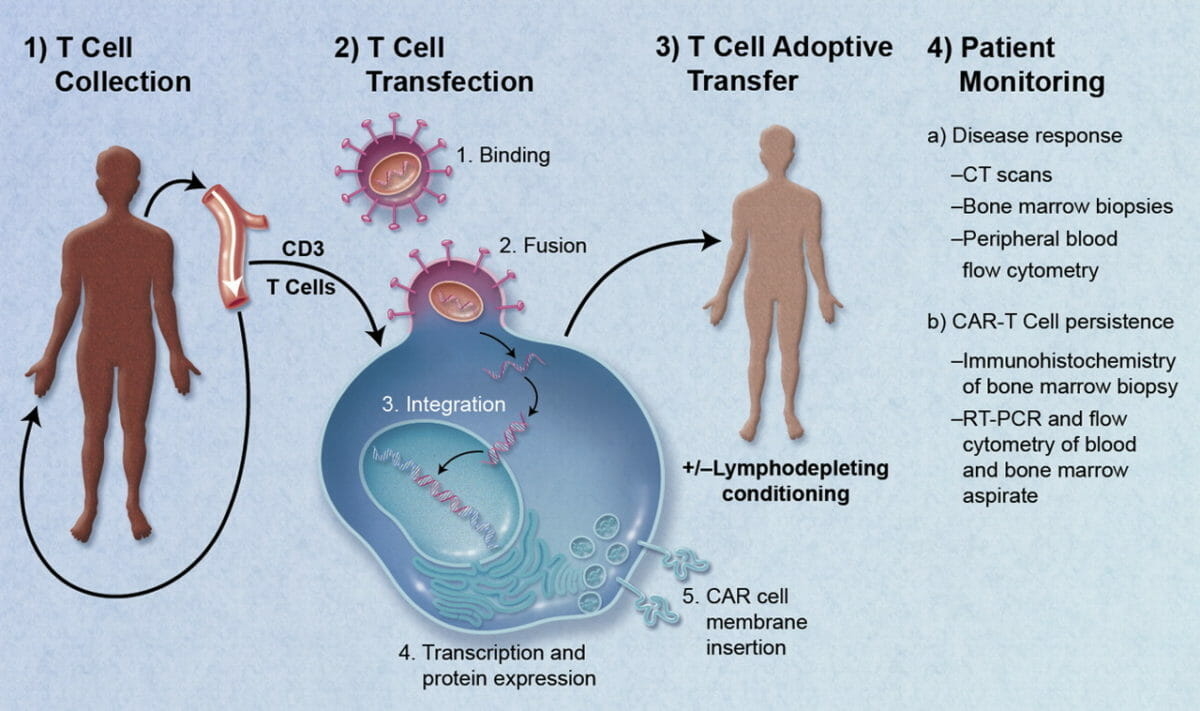
Inmunoterapia celular adaptativa:
1) Se recogen las células T.
2) Las células T se modifican para expresar receptores de antígenos quiméricos, seguido de replicación in vitro.
3) Estas células luego se infunden en el mismo individuo. Estas células entran en circulación, reconociendo y destruyendo células malignas.
4) Seguimiento posterior de la respuesta de la enfermedad.
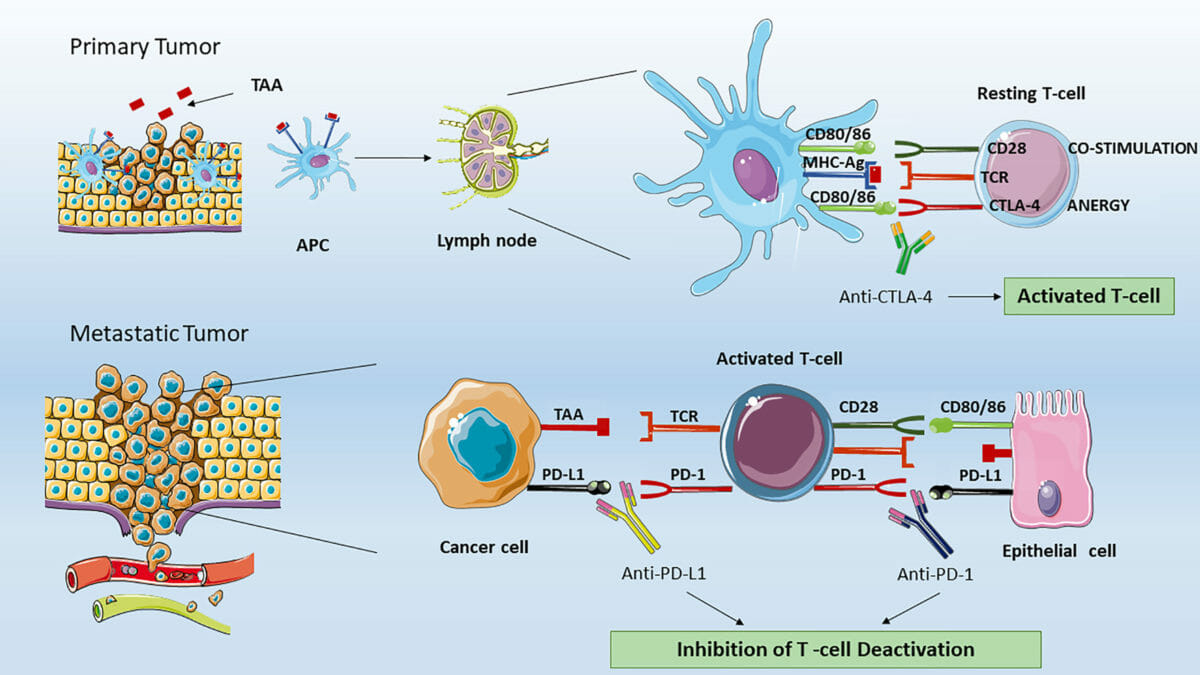
Inhibidores del punto de control inmunitario:
Arriba: Las células presentadoras de antígenos procesan antígenos asociados a tumores y los unen con moléculas del CMH.
Las células presentadoras de antígenos migran al ganglio linfático (en áreas predominantes de células T) y presentan antígenos asociados a tumores a las células T vírgenes.
La activación de la célula T requiere 2 señales. La 1ra está mediada por la unión de antígenos asociados a tumores a un receptor de células T. La 2dada señal puede provenir de la unión del linfocito T CD28 al coestimulador CD80/CD86, que activa el linfocito T.
Sin embargo, cuando el linfocito T-CTLA-4 interactúa con las mismas moléculas de células presentadoras de antígeno CD80/CD86, el efecto es inhibitorio (anergia de linfocitos T o no se produce activación de linfocitos T).
Por lo tanto, CTLA-4 y CD28 compiten por la unión a las proteínas CD80/CD86. La acción de bloqueo anti-CTLA-4 de ipilimumab restaura la señalización del proactivador de CD28, lo que da como resultado respuestas de linfocitos T antitumorales.
Abajo: En los tejidos periféricos, la célula T activada puede desactivarse mediante la unión de la célula de muerte programada 1 de células T (PD-1) con el ligando 1 de muerte celular programada (PD-L1) (o PD-L2) expresado en las células tumorales. La acción bloqueadora anti-PD-1 o anti-PD-L1 por parte de los anticuerpos monoclonales (e.g., nivolumab, pembrolizumab, atezolizumab) restablece la actividad eficaz de los linfocitos T antitumorales.
| Tipo de terapéutica | Agentes | Indicaciones |
|---|---|---|
| Citocinas inmunoestimuladoras | IL–2 |
|
| IFNa-2b |
|
|
| Vacunas | Sipuleucel-T | Adenocarcinoma de próstata resistente a la castración |
| Bacilo de Calmette-Guérin (BCG) | Cáncer de vejiga | |
| Agentes inmunomoduladores |
|
Mieloma múltiple |
| Virus oncolíticos | Talimogén laherparepvec | Melanoma |
| Terapia de células T con receptor de antígeno quimérico | Los agentes están disponibles bajo el programa de estrategia de evaluación y mitigación de riesgos de la FDA (solo para uso autólogo). |
|
| Enganchadores biespecíficos de célular T (terapia dirigida a CD3) | Blinatumomab | Leucemia linfocítica aguda |
| Tipo de terapéutica | Agentes | Indicaciones |
|---|---|---|
| Anti-PD-1 | Pembrolizumab |
|
| Nivolumab |
|
|
| Dostarlimab |
|
|
| Anti-PD-L1 | Atezolizumab |
|
| Avelumab |
|
|
| Durvalumab |
|
|
| Anti–CTLA-4 | Ipilimumab |
|