Um sistema complexo de circuitos elétricos coordenados no coração controla a atividade do músculo cardíaco. O coração gera os seus próprios impulsos elétricos nas células pacemaker. O sinal viaja, então, através de miócitos especializados, que atuam como cabos de eletricidade, distribuindo o sinal por todo o coração. Assim que o sinal “deixa” o sistema de condução especializado, ele passa para cada miócito através de canais chamados junções comunicantes (que conectam os miócitos uns aos outros) e faz com que eles se contraiam. Um impulso elétrico é criado pela abertura e fecho de canais iónicos, permitindo o fluxo de partículas carregadas através da membrana celular do miocárdio. O fluxo de partículas carregadas altera a voltagem através da membrana e abre canais adicionais dependentes de voltagem, permitindo que o sinal se propague por todo o coração.
Última atualização: Apr 7, 2022
Nó Sinoauricular (SA):
O nó AV:
Feixe de His e fibras de Purkinje:
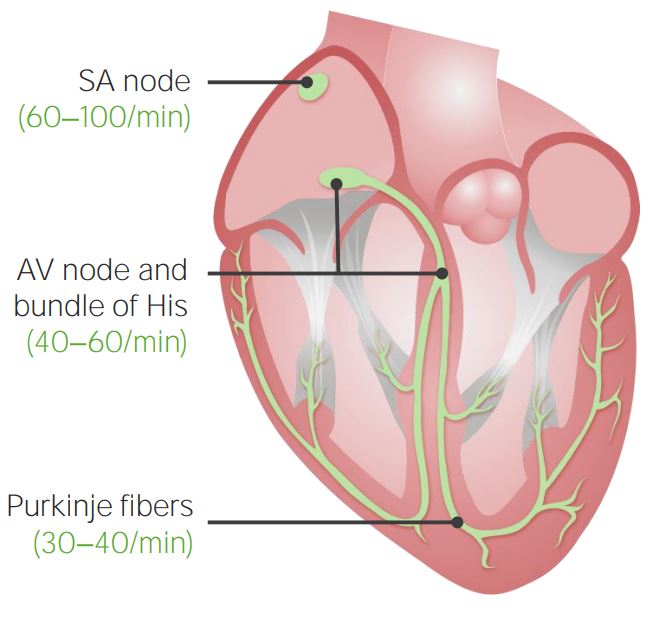
Sistema de condução cardíaca e ritmos intrínsecos:
Localização das células pacemaker no sistema de condução cardíacos e os seus ritmos intrínsecos correspondentes
Miócitos não pacemaker:
Os potenciais de ação viajam em velocidades diferentes através de diferentes tecidos e segmentos do sistema de condução.
Os miócitos cardíacos não pacemaker despolarizam apenas quando recebem um estímulo elétrico. Quando os miócitos cardíacos não pacemaker não são estimulados, eles estão num estado de repouso e têm um RMP.
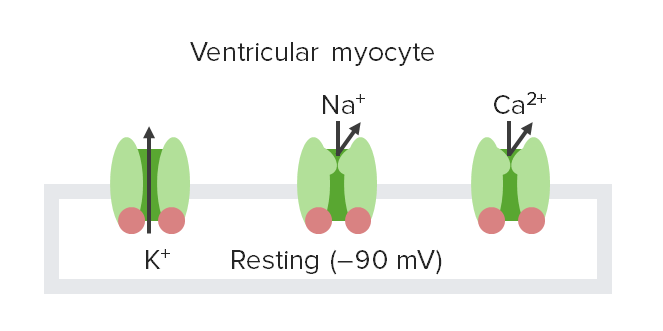
Condutâncias dos iões no potencial de repouso:
No potencial de repouso hiperpolarizado, os canais de K+ dependentes de voltagem são os únicos canais que estão abertos; assim, o K+ é o principal contribuinte para o potencial de membrana em repouso das células.
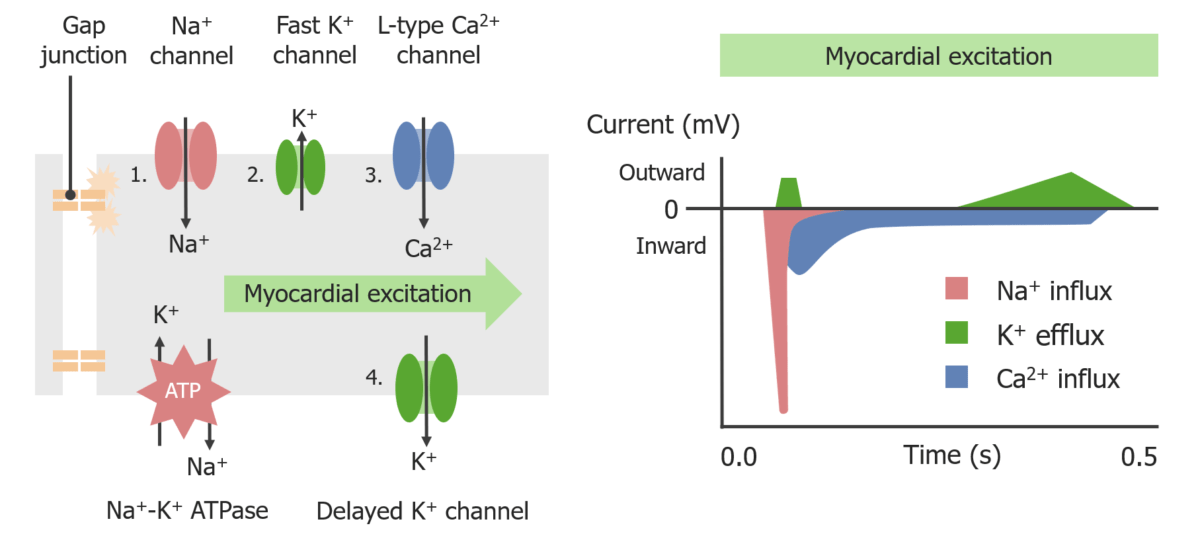
Despolarização do cardiomiócito:
A propagação dos potenciais de ação ocorre através de junções comunicantes que conectam os cardiomiócitos, que influenciam a abertura dos canais de Na+ e cálcio (Ca2+) dependentes de voltagem.
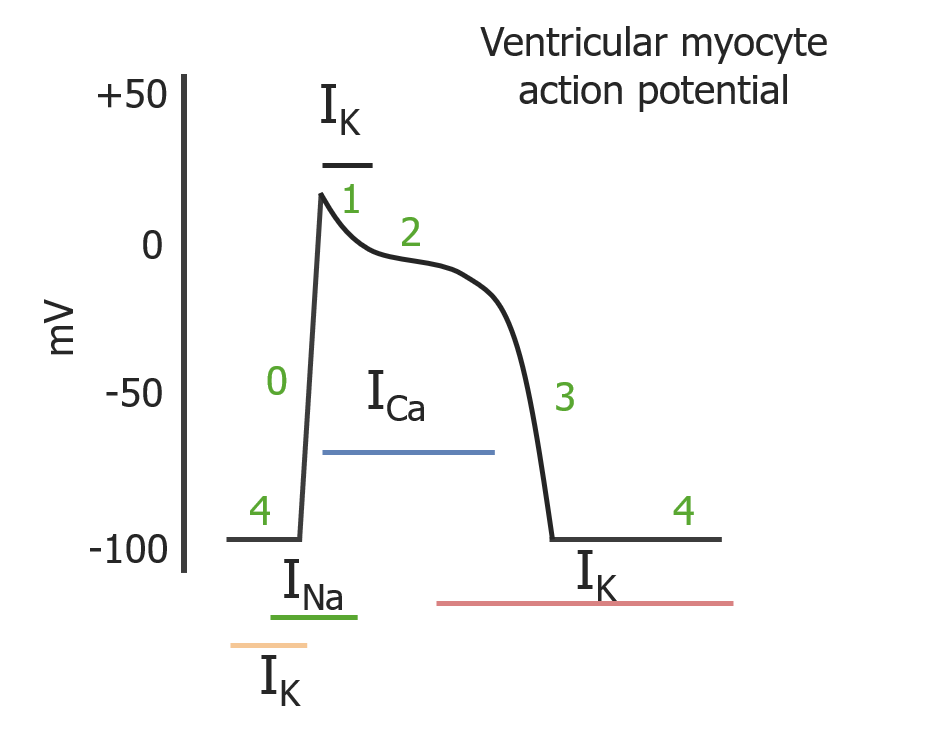
Fases de um potencial de ação do miócito cardíaco:
As fases 0, 1, 2, 3 e 4 ocorrem sequencialmente. As linhas coloridas representam a duração das respetivas correntes de iões.
I K : corrente de K+
I Ca : corrente de cálcio (Ca2+)
I Na : corrente de Na +
| Canal | Fase 4 | Fase 0 | Fase 1 | Fase 2 | Fase 3 |
|---|---|---|---|---|---|
| Canais de Na + dependentes de voltagem | – | Ativo | Desativando | – | – |
| Canais de K+ rápidos | – | – | Ativo | – | – |
| Canais de Ca 2+ tipo L | – | – | Ativando | Ativo | Desativando |
| Canais de K+ atrasados | Ativo | – | – | – | Ativo |
A propagação refere-se a como os sinais elétricos se espalham para todos os miócitos do coração.
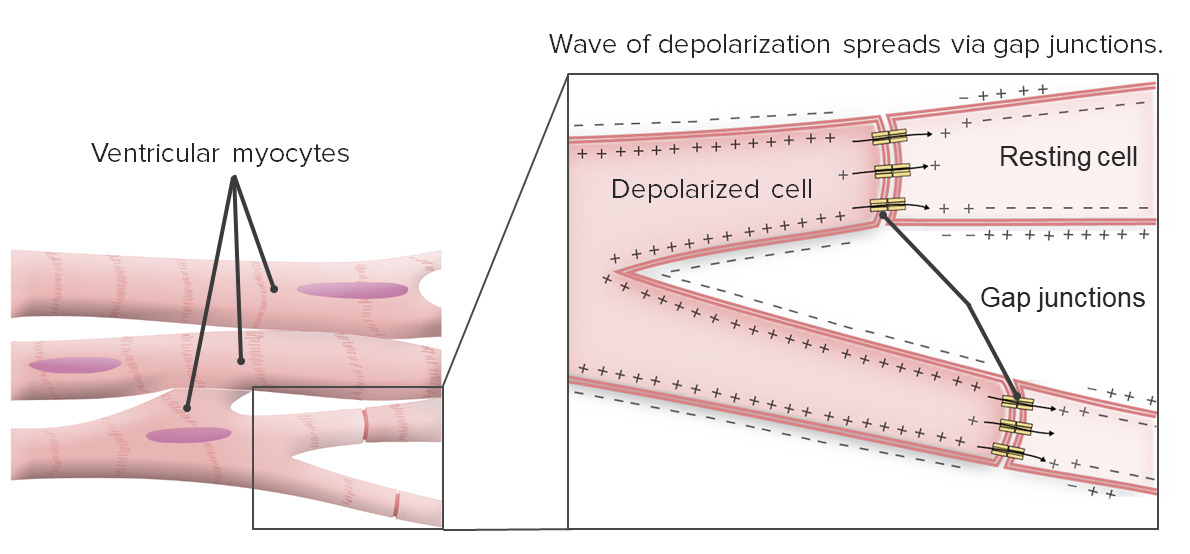
Os miócitos cardíacos estão conectados uns aos outros através de junções comunicantes. A onda de despolarização espalha-se através das junções comunicantes.
Imagem por Lecturio.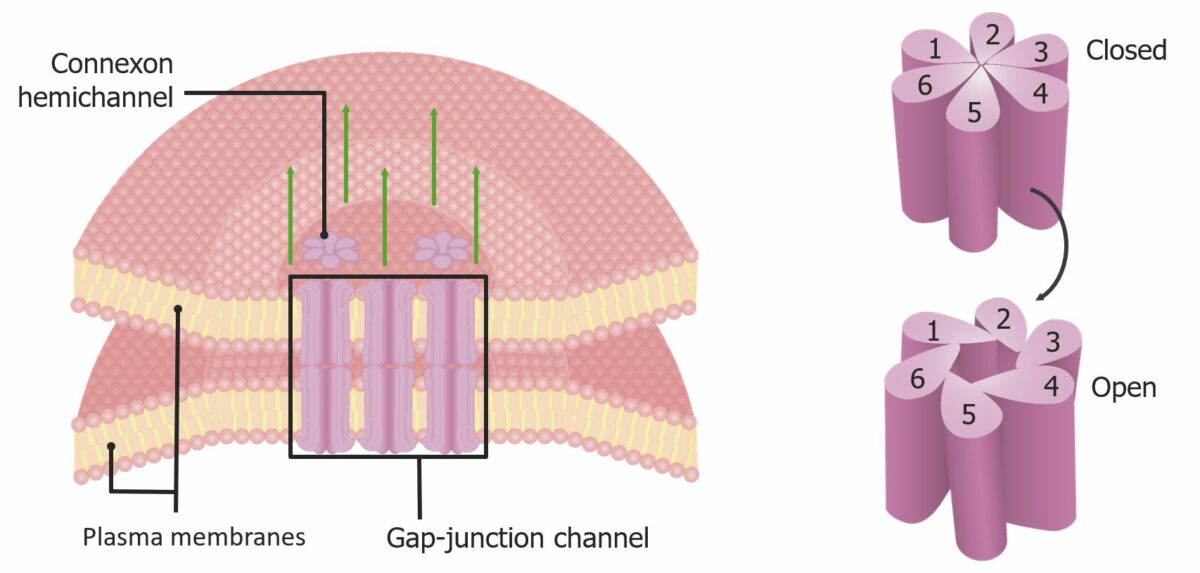
Junções comunicantes entre os miócitos cardíacos
Imagem por Lecturio.As células pacemaker localizadas nos nós SA e AV sofrem mudanças contínuas no potencial de ação; portanto, não têm um verdadeiro potencial de repouso.
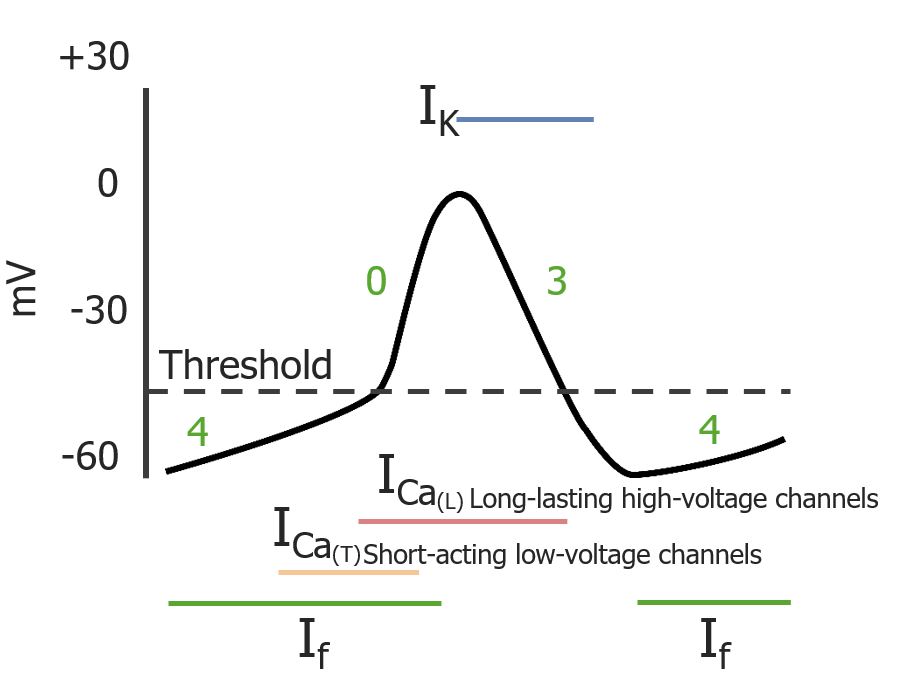
Fases do potencial de ação de um pacemaker cardíaco:
As fases 4, 0, 3 e 4 ocorrem sequencialmente. As linhas coloridas representam a duração das respetivas correntes.
If : corrente “funny”
ICa(T): corrente transitória de cálcio (Ca2+) de ação curta
ICa(L): long-lasting Ca2+ current
I K : corrente de K+
| Tipo de canal | Fase 4 | Fase 0 | Fase 3 |
|---|---|---|---|
| Canal HCN | Ativo * | – | – |
| Canais de Ca 2+ transitórios ou tipo T | Ativo | Inativo | – |
| Canais de Ca 2+ do tipo L | – | Ativo | Inativo |
| Canais de K+ atrasados | Ativo | – | Ativo |
Em comparação com os potenciais de ação não pacemaker, os potenciais de ação pacemaker têm as seguintes características:
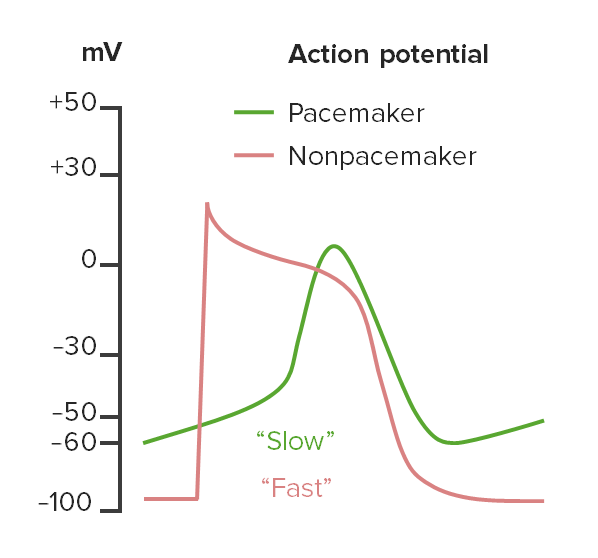
Potenciais de ação pacemaker (verde) e não pacemaker (vermelho):
Os potenciais de ação não pacemaker começam com uma despolarização rápida seguida por uma repolarização lenta, enquanto os potenciais de ação de pacemaker têm uma fase de despolarização mais longa. Os potenciais de ação não pacemaker também começam numa linha isoelétrica (plana), enquanto os potenciais de ação do pacemaker não têm nenhuma por causa da sua oscilação constante entre a repolarização e a despolarização.
A cronotropia refere-se à modulação da FC ao nível das células pacemaker. A frequência do nó SA é controlada principalmente pelo SNA (nervos simpáticos e parassimpáticos).
Dromotropia é a modulação da velocidade de condução através do nó AV (também controlada pelo SNA):
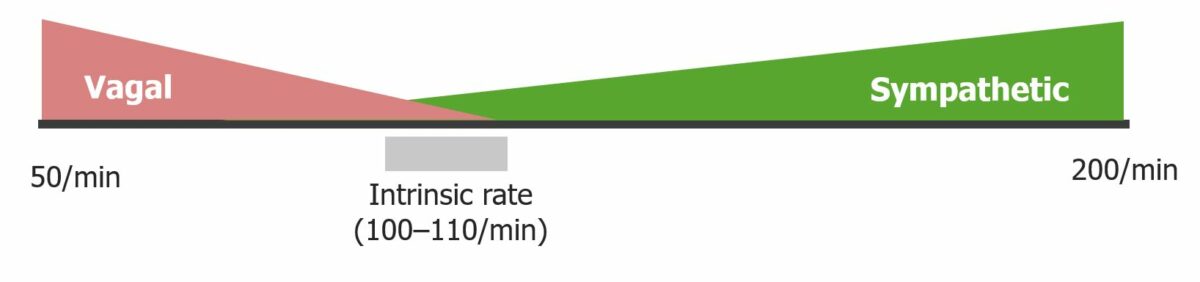
Controlo autonómico da FC no nó SA:
O sistema nervoso simpático aumenta a FC (cronotropia positiva) ao atuar nos receptores β1-adrenérgicos do nó SA. O sistema nervoso parassimpático diminui a FC (cronotropia negativa) via vago, atuando sobre os recetores muscarínicos(M2) no nó SA.
Os nervos colinérgicos libertam acetilcolina, que provoca 2 alterações primárias nos miócitos:
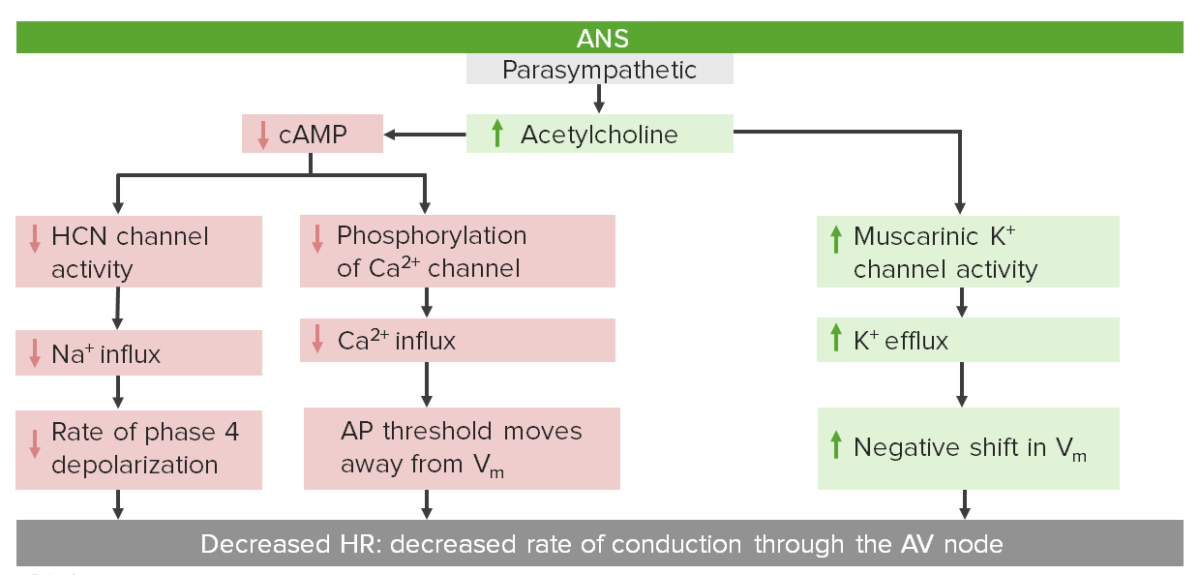
Controlo parassimpático da FC através do nó AV
AV: auriculoventricular
AP: potencial de ação
Vm : potencial de membrana
HCN: nucleotídeo cíclico ativado por hiperpolarização
A norepinefrina é libertada pelos nervos simpáticos, que se ligam aos recetores β1-adrenérgicos nos miócitos e causa um aumento intracelular do AMPc, aumentando assim a FC através de 2 mecanismos:
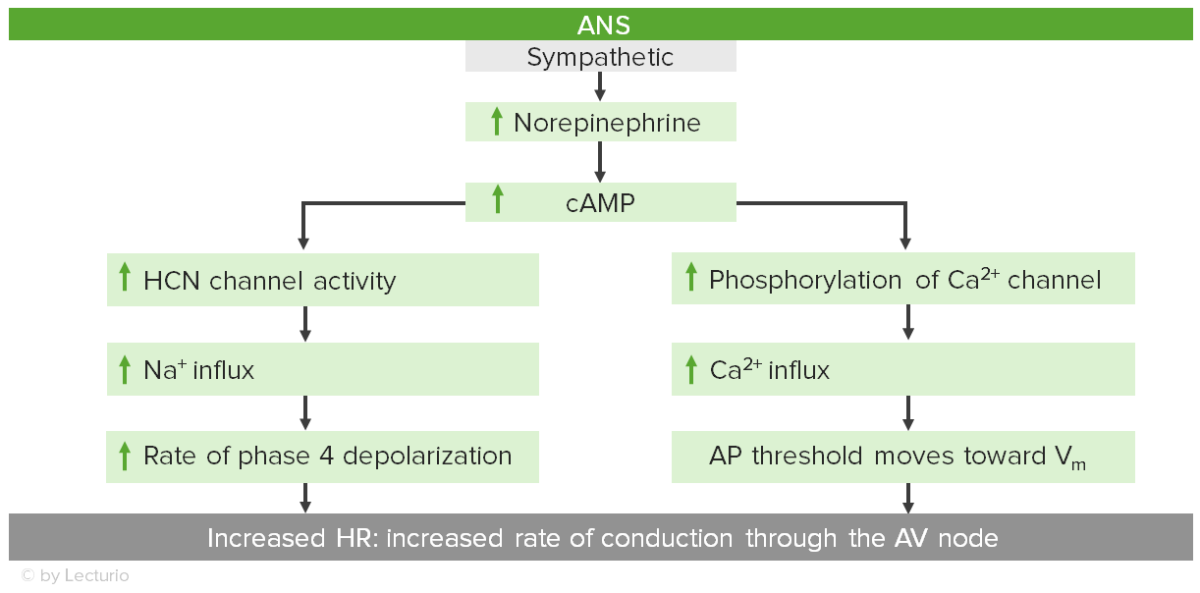
Controlo simpático da FC através do nó AV
AV: auriculoventricular
AP: potencial de ação
Vm : potencial de membrana
HCN: nucleotídeo cíclico ativado por hiperpolarização
| Fator | FC aumentada (cronotropia positiva) | FC diminuída (cronotropia negativa) |
|---|---|---|
| SNA * | Sistema nervoso simpático | Sistema nervoso parassimpático |
| Hormonas da tiróide | Hipertiroidismo | Hipotiroidismo |
| K+ | Hipocaliemia | Hipercalemia |
| Catecolaminas circulantes |
|
– |
| Fluxo sanguíneo/O2 | – | Isquemia / hipóxia |
Os bloqueios do nó auriculoventricular ocorrem quando um comprometimento anatómico ou funcional do sistema de condução do coração causa um atraso ou interrupção na transmissão dos potenciais de ação das aurículas para os ventrículos através do nó AV. Os indivíduos afetados podem ser assintomáticos ou apresentar síncope, dor torácica, dispneia e bradicardia, dependendo da gravidade do bloqueio. O diagnóstico é feito com base no ECG e o tratamento é baseado no tipo de bloqueio e estabilidade hemodinâmica do indivíduo afetado.
Os bloqueios de ramo e fasciculares ocorrem quando a atividade elétrica normal no sistema de His-Purkinje é interrompida. Os bloqueios de ramo e fasciculares podem ocorrer devido a muitas etiologias que podem afetar a estrutura do coração ou o sistema de condução diretamente (por exemplo, isquemia miocárdica, miocardite, cardiomiopatia). Embora geralmente assintomáticos, os bloqueios de ramo e fasciculares podem ocasionalmente causar síncope.
As seguintes classes de fármacos são usadas para o tratamento de arritmias: