Os eritrócitos, ou glóbulos vermelhos (hemácias), são as células mais abundantes no sangue. Enquanto os eritrócitos no feto são inicialmente produzidos no saco vitelino e depois no fígado, a medula óssea acaba por se tornar o principal local de produção. A eritropoiese começa com células estaminais hematopoiéticas, que se desenvolvem em progenitores comprometidos com a linhagem e se diferenciam em eritrócitos maduros. O processo ocorre em etapas, e a extrusão dos núcleos e organelos ocorre antes da maturação. Assim, os eritrócitos maduros não possuem núcleos e têm uma forma bicôncava. As hemácias transportam hemoglobina, e a sua forma permite o transporte eficiente de oxigénio. Bilhões de eritrócitos são produzidos diariamente, pois a sua vida útil é de 120 dias. As hemácias senescentes ou deformadas são removidas por macrófagos no baço, fígado e medula óssea.
Última atualização: May 3, 2022
Os eritrócitos, também chamados de glóbulos vermelhos (GVs), são estruturas terminalmente diferenciadas sem núcleo, mas cheias de hemoglobina transportadora de oxigénio. Os eritrócitos são as células mais abundantes no sangue.
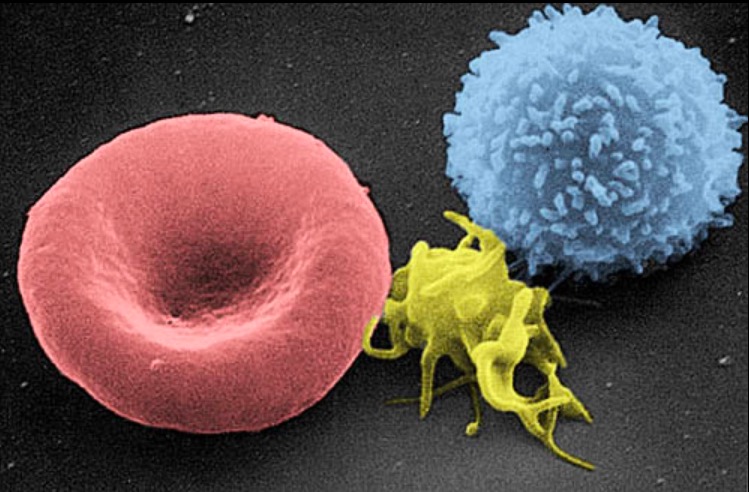
Micrografia eletrónica de scanning de uma célula sanguínea:
Da esquerda para a direita: eritrócitos humanos, trombócitos (plaquetas) e leucócitos
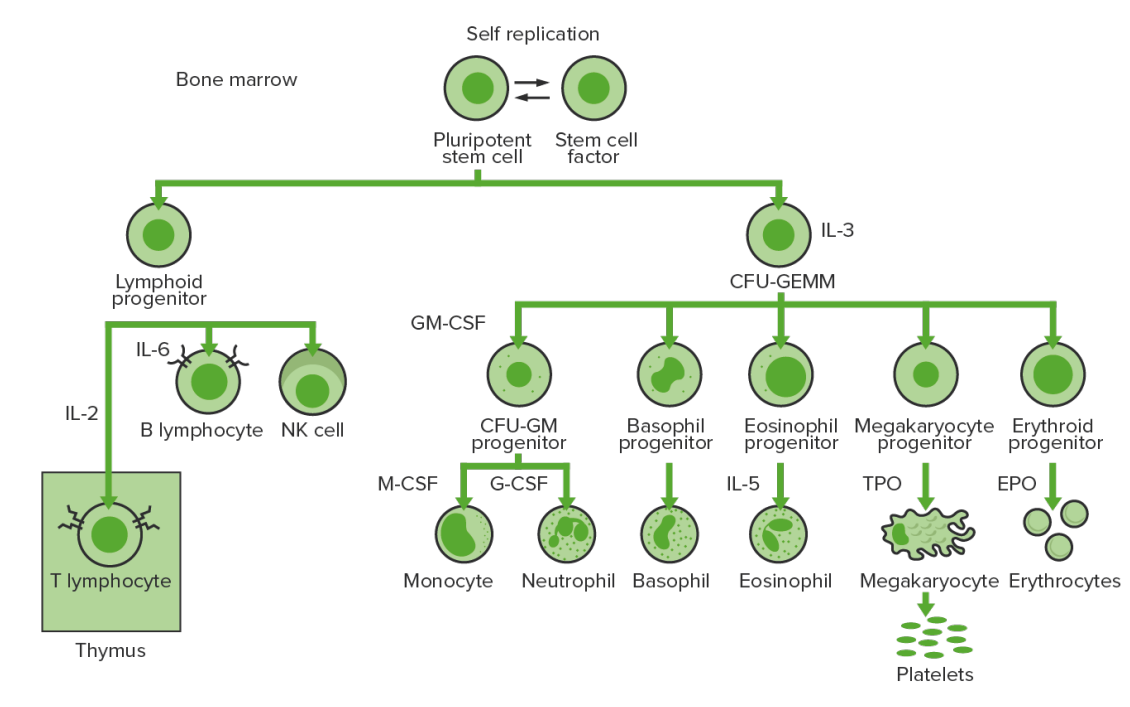
Hematopoiese da medula óssea: proliferação e diferenciação dos elementos formados de sangue.
CFU-GEMM: unidade formadora de colónias de granulócitos, eritrócitos, monócitos, megacariócitos
CFU-GM: unidade formadora de colónias granulócitos-macrófagos
GM-CSF: fator estimulador de colónias de granulócitos-macrófagos
M-CSF: fator estimulador de colónias de macrófagos
G-CSF: fator estimulador de colónias de granulócitos
NK: “natural killer”
TPO: trombopoietina
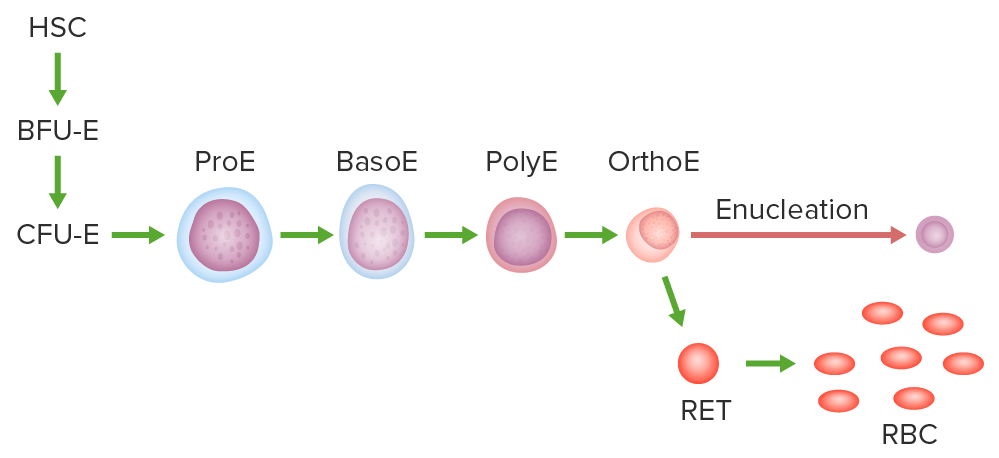
Via de eritropoiese:
Célula estaminal hematopoiética (HSC, pela sigla em inglês), unidade de formação de explosão eritroide (BFU-E, pela sigla em inglês) ou o progenitor mais antigo comprometido, unidade de formação de colónia eritroide (CFU-E, pela sigla em inglês), proeritroblasto (ProE), basofílico (BasoE), policromático (PolyE) e eritroblasto ortocromático (OrthoE).
O OrthoE sofre enucleação e torna-se um reticulócito (RET). Depois dos organelos serem expelidos ou digeridos, é formado o GV maduro.
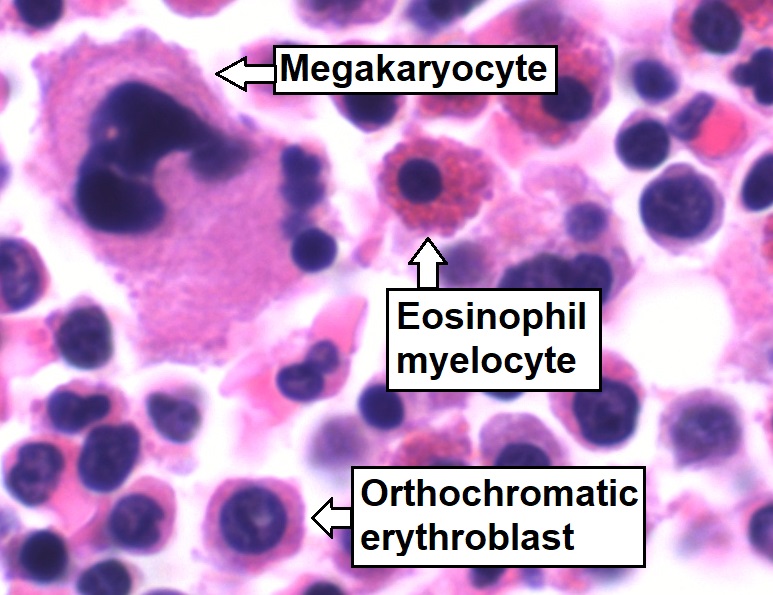
Aspirado de medula óssea que mostra hematopoiese de trilinhagem normal:
Células mielomonocíticas (marcadas como mielócitos eosinofílicos), células eritroides (marcadas como eritroblastos ortocromáticos) e células megacariocíticas
| Citocinas e fatores de crescimento | Atividades | Origem |
|---|---|---|
| SCF | Estimula todas as células progenitoras hematopoiéticas | Células estromais da medula óssea |
| GM-CSF | Estimula as células progenitoras mieloides | Células endoteliais, células T |
| EPO | Estimula a eritropoiese, incluindo a diferenciação | Rim, fígado |
| IL-3 | Mitogénio para todas as células progenitoras de granulócitos e megacariócitos/eritrócitos | Células T auxiliares |
Outros fatores: