Os linfócitos B, também conhecidos como células B, são componentes importantes do sistema imunológico adaptativo. Na medula óssea, as células-tronco hematopoiéticas passam por uma série de etapas para se tornarem células B naive maduras. As células migram para órgãos linfoides secundários para a sua ativação e posterior maturação. O processo envolve a estimulação do antigénio, com ou sem a ajuda de células T. A ativação independente de células T gera uma resposta imune de curta duração (via células plasmáticas), observada com antigénios como lipopolissacarídeos bacterianos. Por outro lado, a ativação dependente de células T produz células plasmáticas e células de memória. As células B ativadas proliferam então nos centros germinativos, mas nem todas se tornam células B efetoras. Através da hipermutação somática, as células B sofrem mecanismos adicionais para aumentar a afinidade do anticorpo pelo antigénio. Somente aquelas com recetores de células B de alta afinidade avançam posteriormente para a diferenciação terminal. As células B passam então por uma mudança de classe (de IgM para outra classe de Ig) sob a influência de citocinas. Após a troca de classe, as células B tornam-se células plasmáticas (que produzem anticorpos) ou células de memória (que desencadeiam uma resposta imune secundária robusta).
Última atualização: Aug 1, 2022
Os linfócitos B (derivados da medula óssea), ou células B, são um tipo de linfócitos provenientes do progenitor linfoide comum.
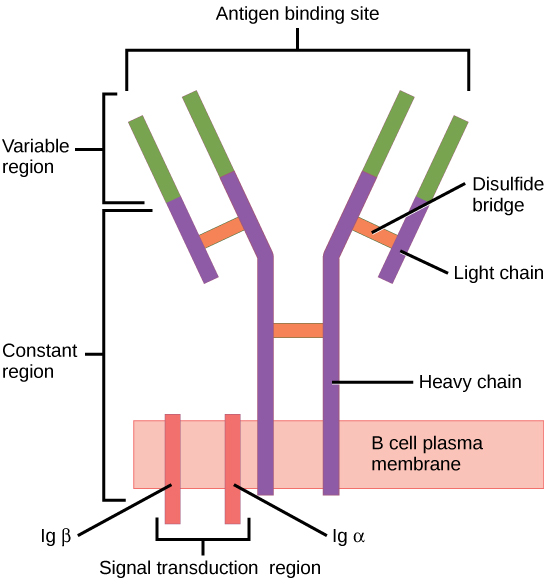
O recetor de células B (BCR, pela sigla em inglês) consiste na molécula de Ig e na molécula de sinalização:
A Ig contém 2 cadeias pesadas idênticas e 2 cadeias leves idênticas ligadas por uma ponte dissulfeto. A Ig ligada à membrana é ancorada à superfície da célula.
Para obter a sua funcionalidade, a célula B passa por etapas na medula óssea e nos órgãos linfoides secundários:
| Estadio de maturação | Genes Ig | Recetor de células B (BCR) | Eventos associados |
|---|---|---|---|
| Independente de antigénio | |||
| Célula pré-pro-B | DNA de linha germinativa | Nenhum | Sem expressão de cadeia pesada ou leve |
| Célula Pró-B | Rearranjo DJ IGH | Nenhum | Começa a expressar CD19, CD34 e HLA-DR (antigénio de histocompatibilidade de classe II) |
| Célula pré-B | Rearranjo IGH VDJ | Forma-se o Pré-BCR:
|
Surgem outros marcadores (CD79, CD10, CD20, CD40 e desoxinucleotidil transferase terminal entre eles). |
| Célula B imatura |
|
BCR maduro (molécula IgM) | A expressão de HLA-DR, CD19, CD20 e CD40 continua, ao contrário de outros marcadores (por exemplo, CD10, CD34 e desoxinucleotidil transferase terminal). |
| Célula B madura (naive) |
|
Com BCR maduro (IgM) → saída da medula óssea | Expressam todos CD19 e CD20. |
| Dependente de antigénio | |||
| Célula B madura (em tecidos linfoides secundários) | BCR maduro (expressa IgM e IgD quando nos tecidos linfoides secundários) | As células podem descansar ou pode ocorrer a sua ativação: as células B interagem com o antigénio exógeno e/ou células T auxiliares. | |
| Célula B ativada | Troca de classe | Uma vez ativada, pode mudar para IgE, IgG, IgA ou permanecer como IgM | |
| Célula B de memória |
|
||
| Célula de plasma |
|
||
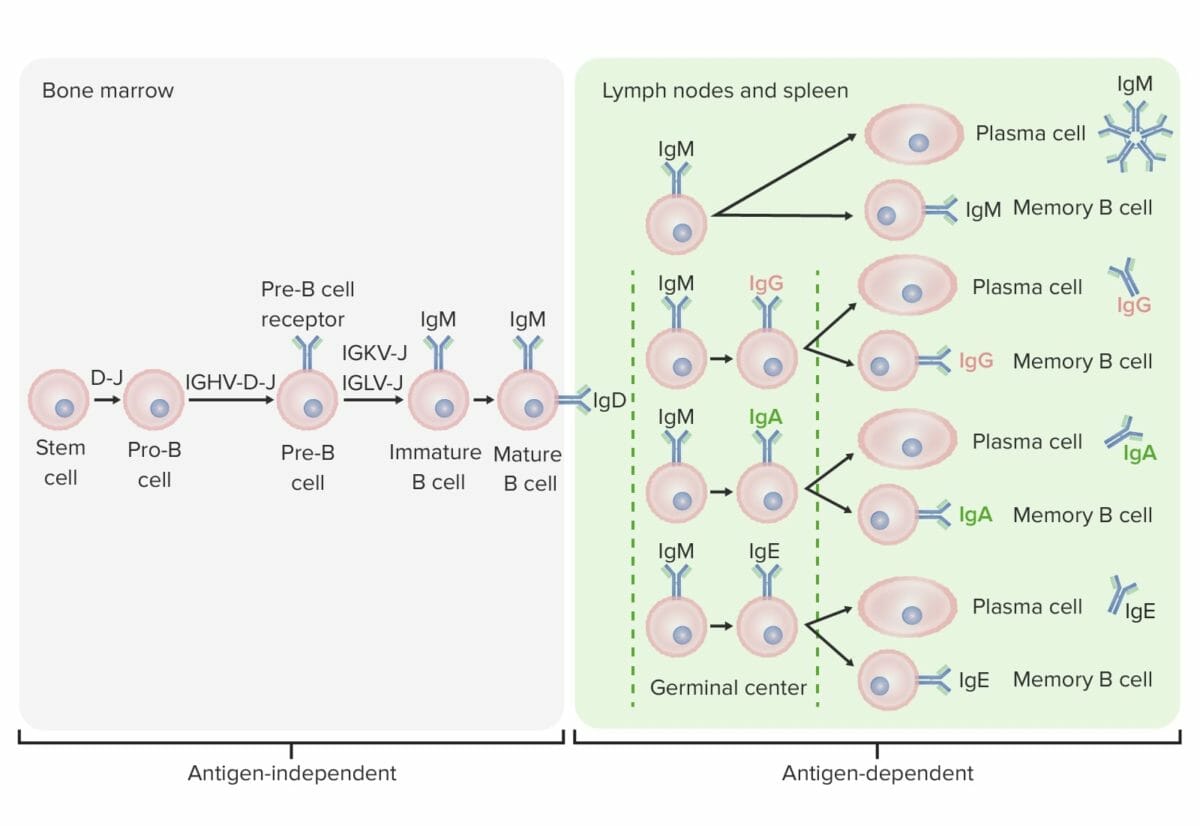
Fases de diferenciação da célula B:
Nos estadios independentes de antigénio, a produção de células B começa com a célula-tronco hematopoiética (HSC, pela sigla em inglês), que se torna um progenitor linfoide comum (CLP, pela sigla em inglês) e, de seguida, numa célula pré-pro-B ou célula progenitora B. Os próximos passos incluem o rearranjo de segmentos de genes para formar a molécula de Ig. As cadeias pesadas de imunoglobulinas começam com o rearranjo da diversidade e a junção de segmentos para formar a célula pró-B. Na etapa seguinte (célula pré-B), a recombinação da cadeia pesada de Ig (variabilidade, diversidade, junção) é completada e o recetor da célula pré-B é formado. O rearranjo da cadeia leve (kappa (κ) ou lambda (λ)) resulta na expressão de uma molécula de anticorpo IgM completa por uma célula B imatura. Segue-se a formação da célula B madura (“naive”) com IgM e IgD.
Os estadios dependentes de antigénio ocorrem em tecidos linfoides secundários. Uma vez que a célula B madura produz IgM e IgD, pode ocorrer uma mudança de classe para produzir IgE, IgG e IgA. As células B são ativadas e tornam-se células plasmáticas ou células de memória.
A célula B migra da medula óssea para os órgãos linfoides secundários. Este processo leva uma série de etapas para a produção de uma célula B diferenciada funcional: ativação por um antigénio, proliferação, maturação de afinidade, mudança de classe e diferenciação (em célula plasmática ou de memória).
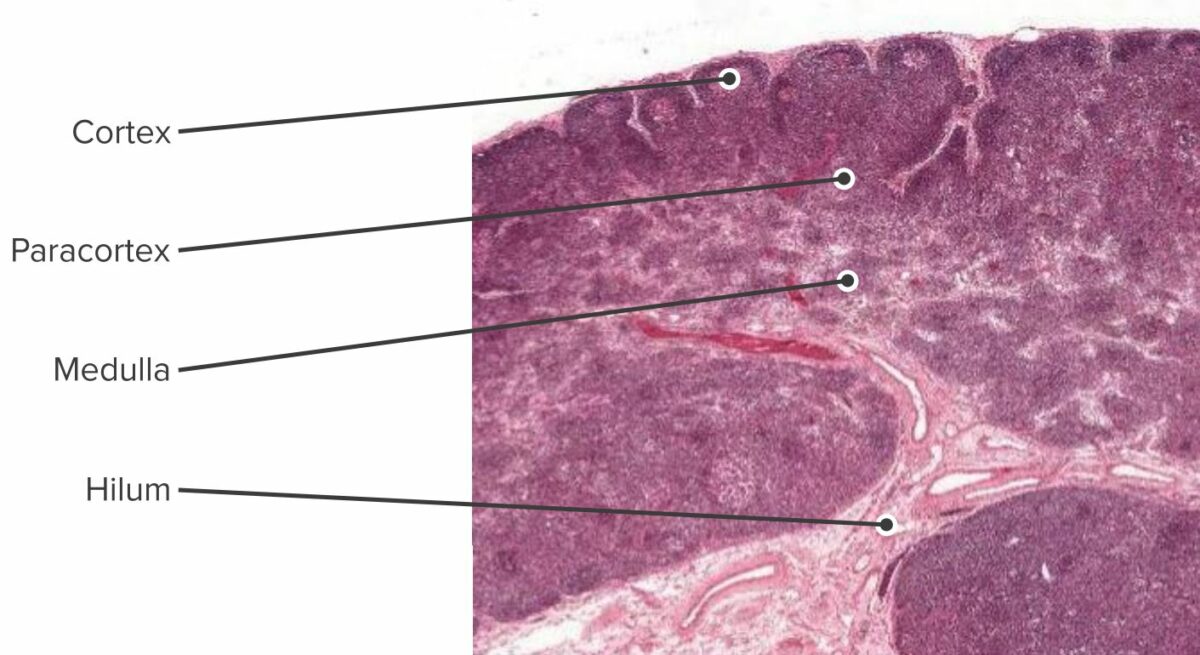
Corte histológico de um nódulo linfático, visualizando-se o córtex, o paracórtex e a medula
Imagem de Geoffrey Meyer, editada por Lecturio.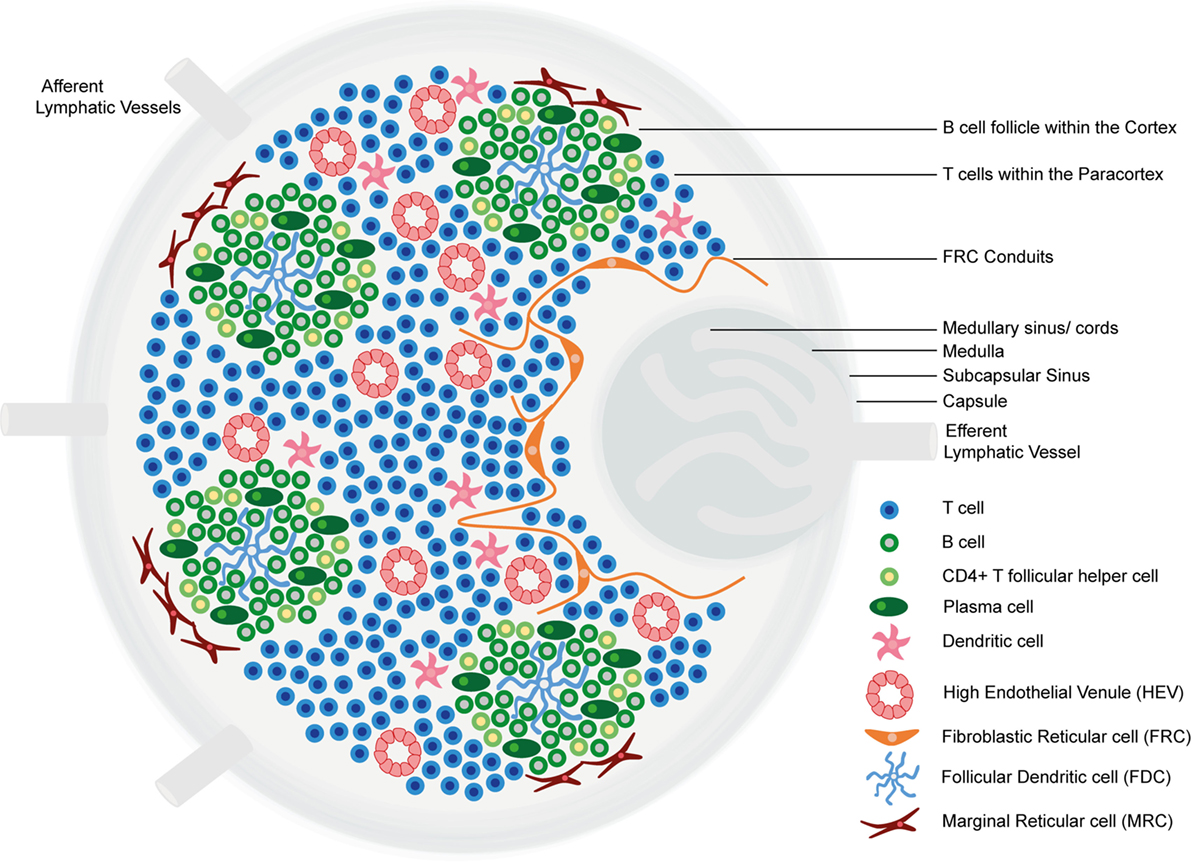
Estrutura e regiões funcionais de um nódulo linfático: formado por uma cápsula fibrosa rica em colagénio e um seio subcapsular (SCS, pela sigla em inglês) subjacente.
As células são secretadas no (1) córtex (constituído por células B, células T auxiliares foliculares e células dendríticas foliculares [FDCs, pela sigla em inglês], dispostos em folículos primários, nos quais as células B pesquisam os antigénios presentes na rede estromal da FDC); e (2) no paracórtex (que contém células T, células dendríticas [DCs, pela sigla em inglês] e células reticulares fibroblásticas [FRCs, pela sigla em inglês], que formam redes de células estromais e fibras reticulares).
A medula interna é composta por tecidos linfáticos (cordões medulares) separados por seios medulares constituídos por linfa.
A ativação de células B por apresentação de antigénio pode ocorrer através de diferentes vias:
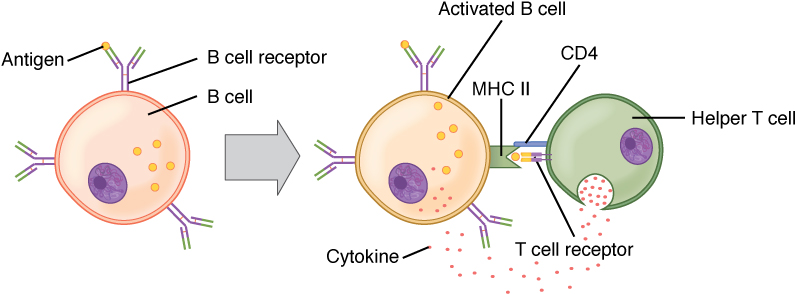
Ativação de células B (dependente de células T):
O antigénio circulante interage com o BCR da célula B. O antigénio é endocitado e degradado, e os componentes peptídicos são complexados com moléculas MHC II da superfície celular. As células T auxiliares foliculares (Tfh) (células T auxiliares especializadas CD4+) reconhecem e ligam-se ao complexo antigénio-MHC II. As citocinas são libertadas pelas células Tfh, levando à ativação e proliferação das células B. As células B ativadas entram nos centros germinativos, onde sofrem diferenciação.
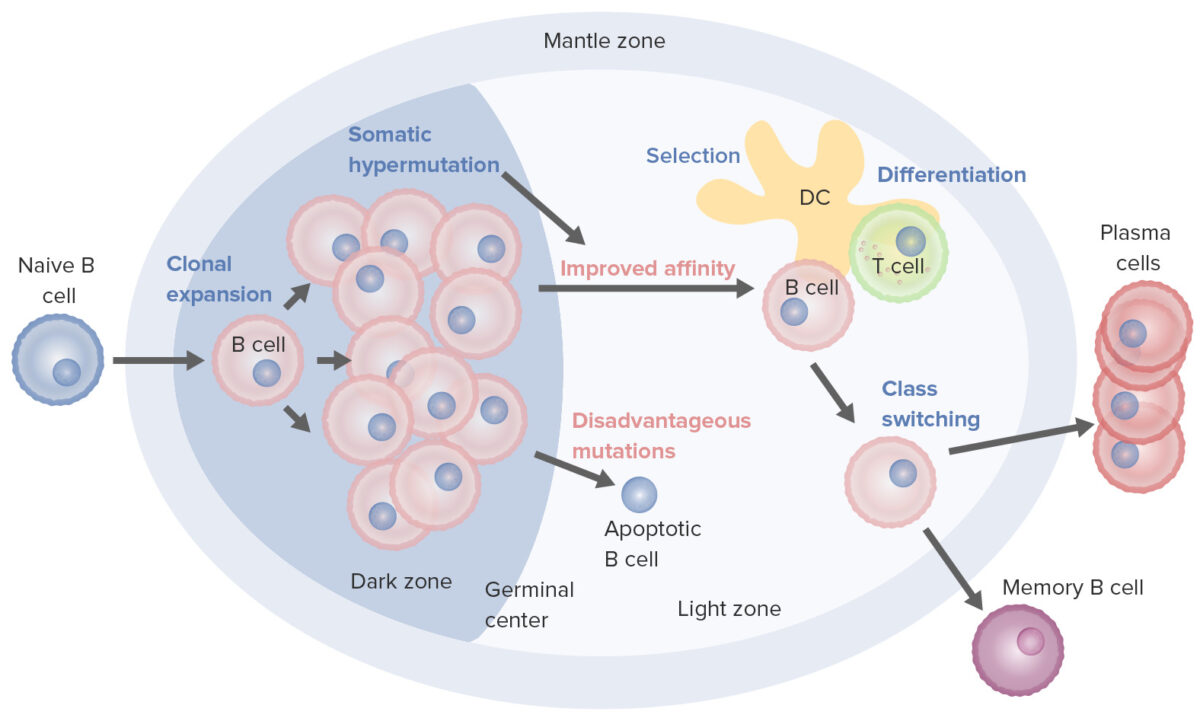
Processos de ativação e maturação de células B que ocorrem no centro germinativo:
Na ativação, a célula B desloca-se da zona do manto e entra no centro germinativo. Dá-se a proliferação de células B (expansão clonal) e o aumento da afinidade do anticorpo para o antigénio, através do processo de hipermutação somática. Os ciclos repetidos de proliferação e hipermutação ajustam o recetor de células B. Contudo, nem todas as células B continuam a diferenciação, sobretudo se a afinidade for fraca. Se a ligação antigénio-anticorpo não for adequada pode ocorrer a apoptose. As células com forte afinidade sobrevivem (seleção) com a ajuda de sinais de sobrevivência de células dendríticas foliculares e células T. Estas células B selecionadas seguem para a mudança de classe e diferenciação em células plasmáticas ou células de memória.
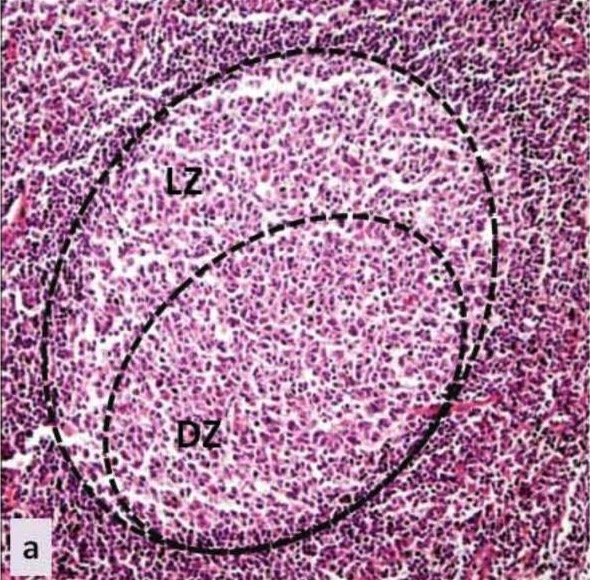
Centro germinativo: imagem histológica do centro germinativo de um tecido linfoide secundário
LZ: zona clara
DZ: zona escura
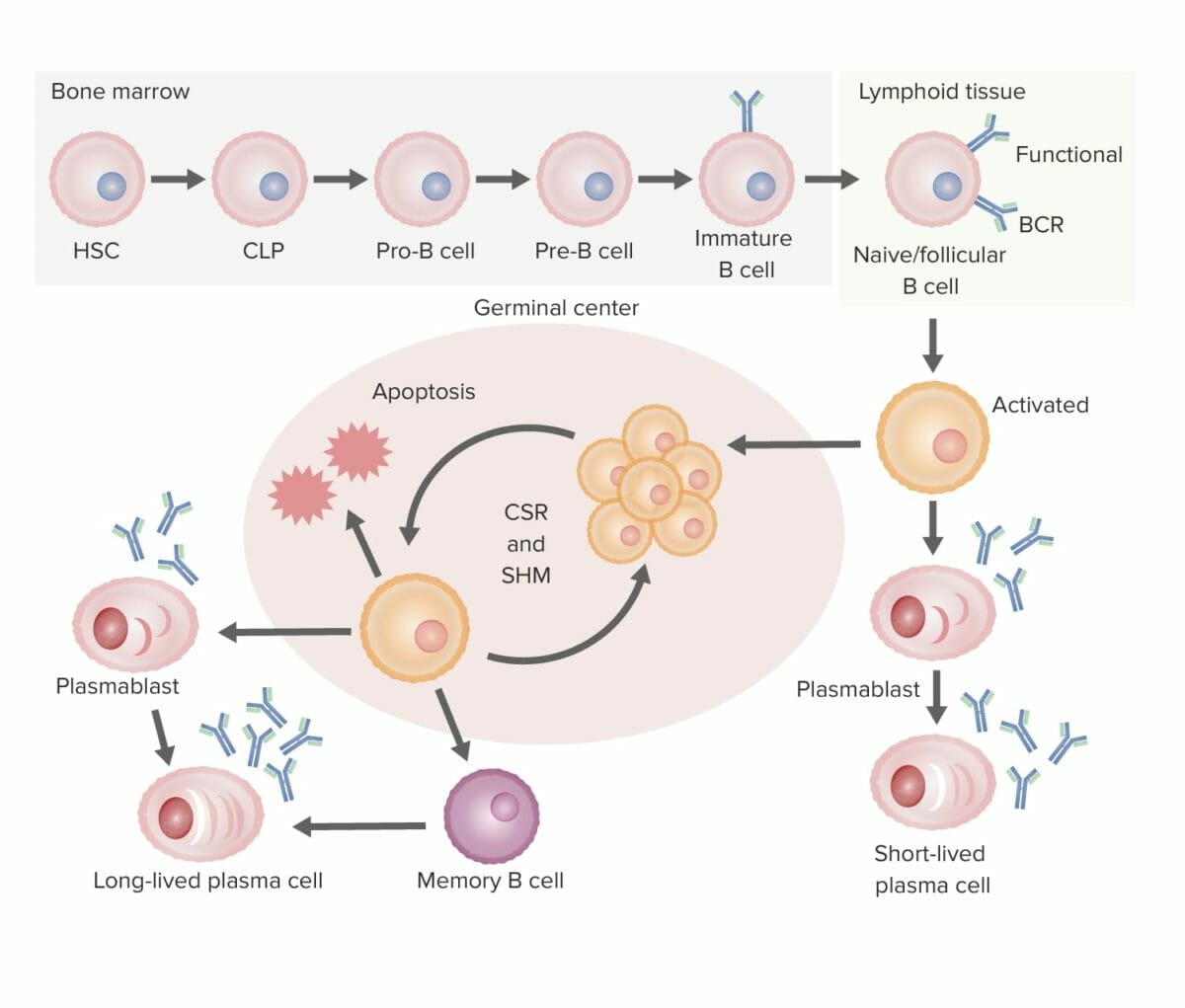
Resumo do desenvolvimento de células B até à sua diferenciação (da medula óssea ao órgão linfoide secundário):
Desenvolvimento de células B:
Na medula óssea, as células B transformam-se em células B imaturas, processo no qual é formado o recetor de células B (BCR). De seguida, a célula B migra para os órgãos linfoides secundários, onde ocorre a ativação.
Ativação de células B:
O antigénio liga-se à célula B com o BCR de maior afinidade. A ativação por ser independente de células T, quando a célula B ativada se diferencia numa célula plasmática de vida curta (produzindo anticorpos) sem a ajuda da célula T, ou dependente de células T, que reconhecem o antigénio-MHC II, desencadeando a proliferação da célula B no centro germinativo do tecido linfoide.
Proliferação e maturação:
Posteriormente ocorre hipermutação somática (SHM; uma mutação programada para ajustar ainda mais a afinidade do anticorpo para o antigénio), que consiste em ciclos repetidos de proliferação e hipermutação para aperfeiçoamento do BCR. São selecionados apenas aqueles com maior afinidade; os com baixa afinidade sofrem apoptose. As células B sobreviventes passam então pela recombinação de troca de classe (CSR), na qual a composição da cadeia pesada é alterada (IgM para outros isotipos) com a ajuda de citocinas.
Diferenciação:
As células B diferenciam-se em plasmócitos e células de memória, abandonando o centro germinativo.
A partir da produção inicial de células B, existem diversos processos que permitem que os humanos produzam diferentes moléculas de anticorpos que são significativamente maiores do que o número de genes no genoma.
Estima-se que sejam gerados bilhões de anticorpos, em comparação com cerca de 30.000 genes.
O sistema imunológico possui mecanismos únicos para criar diversidade de anticorpos, tais como: