A anemia falciforme (AF) é uma doença genética onde uma molécula de Hb anormal (Hb S) transforma eritrócitos em células em forma de foice, resultando em anemia crónica, episódios vaso-oclusivos, dor e danos em órgãos. O traço falciforme, condição heterozigótica, é o único do grupo que é geralmente benigno e está raramente associado a complicações graves semelhantes à AF. Triggers como stresse e hipóxia podem induzir ou piorar a falciformização dos eritrócitos. Os indivíduos com AF são suscetíveis à infeção, enfarte de vários órgãos e aplasia da medular; o envolvimento pulmonar na síndrome torácica aguda pode ser rapidamente fatal. As células falciformes geralmente podem ser visualizadas no esfregaço de sangue periférico, mas a eletroforese de Hb é necessária para o diagnóstico. O tratamento dos episódios dolorosos consiste em fluidos intravenosos e analgésicos. Em episódios graves, podem ser necessárias transfusões sanguíneas. A sobrevivência é aumentada pela vacinação contra infeções bacterianas, antibióticos profiláticos e tratamento agressivo de infeções.
Última atualização: Dec 31, 2022
A anemia falciforme (AF) é uma doença genética causada por uma molécula de Hb anormal (Hb S) que transforma os eritrócitos em células em forma de foice, resultando em anemia crónica, episódios vaso-oclusivos, dor e danos em alguns órgãos
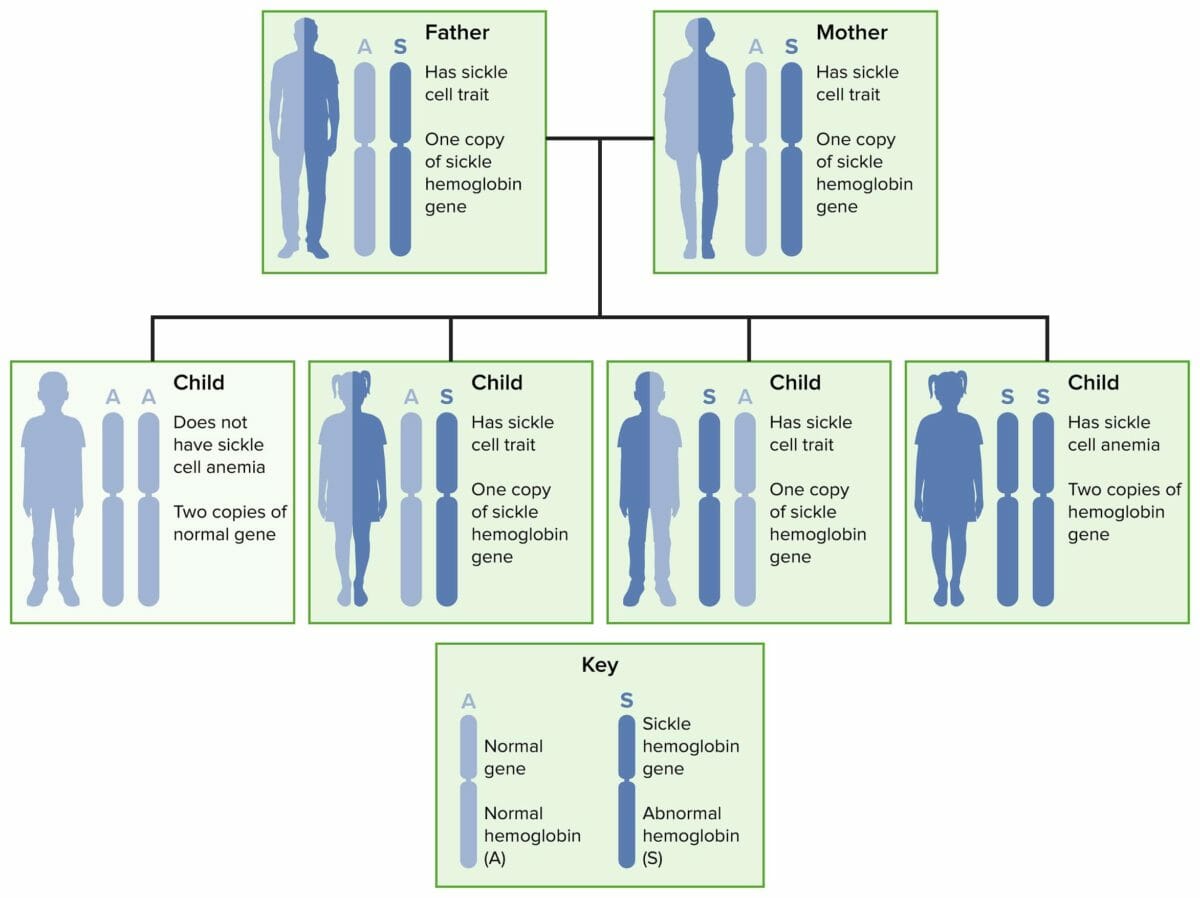
Transmissão autossómica recessiva da anemia falciforme e do traço falciforme.
Imagem: “Sickle cell 02” por National Heart Lung and Blood Insitute (NIH). Licença: Domínio PúblicoA molécula de hemoglobina normal do adulto (HbA 1 ) consiste em 2 pares de cadeias chamadas alfa e beta.
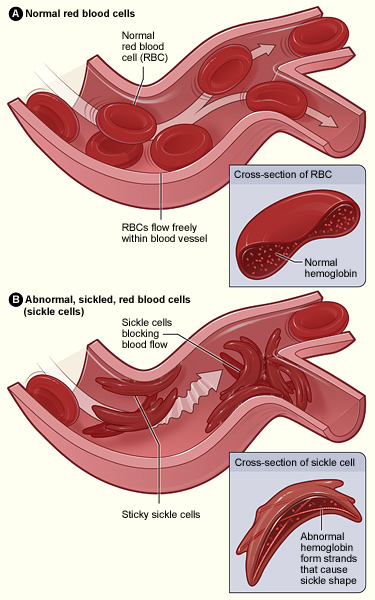
A hemoglobina anormal leva à falciformização dos eritrócitos e à adesão das células falciformes ao endotélio, que é ativado pelos eritrócitos aderentes. A oclusão de pequenos vasos ocorre pela agregação de eritrócitos falciformes a plaquetas e leucócitos (não se encontra na figura).
Imagem: “Sickle cell 01” por The National Heart, Lung, and Blood Institute (NHLBI). Licença: Domínio PúblicoA maioria dos sintomas resulta da anemia e dos eventos vaso-oclusivos observados em indivíduos com AF ou complicações, incluindo infeções.
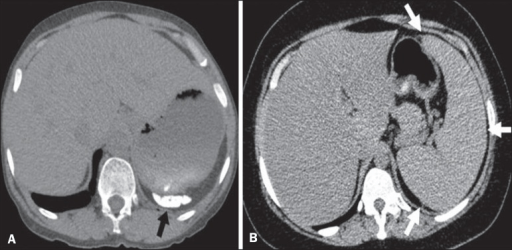
Padrões diferentes de envolvimento esplénico na anemia falciforme:
A: atrofia e calcificação do baço (seta)
B: esplenomegalia (setas)
A doença falciforme é geralmente diagnosticada no rastreio pré-natal ou ao nascimento, pelo rastreio neonatal. Os métodos variam de país para país.
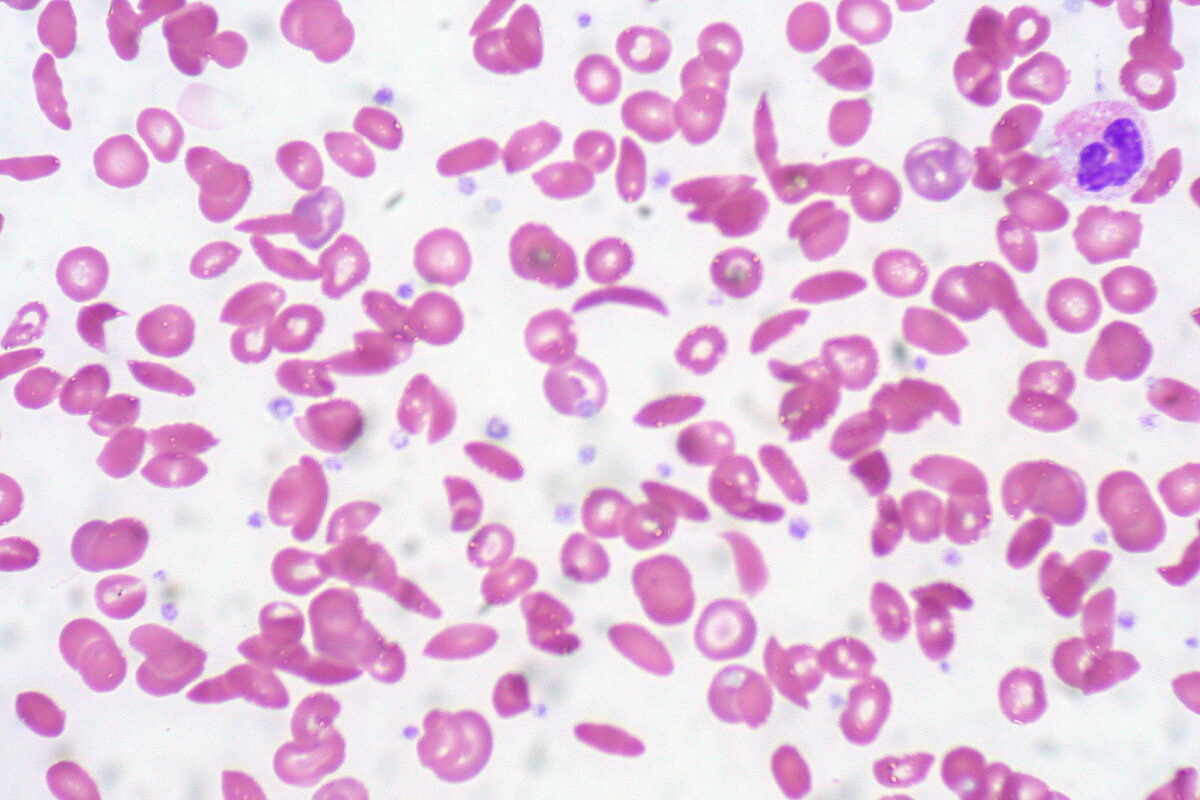
O esfregaço de sangue periférico mostra uma mistura de eritrócitos, alguns com morfologia normal arredondada e alguns com foice (alongamento e curvatura)
Imagem: “Sickle Cell Anemia” por Ed Uthman. Licença: CC BY 2.0O tratamento dos episódios dolorosos inclui analgésicos e medidas gerais de suporte. As transfusões podem ser necessárias, ocasionalmente, se o indivíduo se apresentar com anemia sintomática, incluindo na complicação da síndrome torácica aguda.
| Apresentação clínica | Tratamento |
|---|---|
| Episódios de dor aguda / eventos vaso-oclusivos |
|
| Sequestro esplénico agudo |
|
| Infeções | Prevenção:
|
| Priapismo |
|
| Rastreio profilático |
|
| Refratário |
|