La anemia drepanocítica o de células falciformes es un grupo de trastornos genéticos en los que una molécula de hemoglobina (Hb S) anormal transforma los eritrocitos en células falciformes, lo que provoca anemia crónica, episodios vasooclusivos, dolor y daño de órganos. El rasgo de células falciformes, que es la afección heterocigota, es el único del grupo que generalmente es benigno y rara vez se asocia con complicaciones graves similares a las de la anemia de células falciformes. Desencadenantes como el estrés y la hipoxia pueden inducir o empeorar la formación de eritrocitos falciformes. Los individuos con anemia de células falciformes son susceptibles a infecciones, infartos de varios órganos y aplasia de la médula ósea; la afectación pulmonar en el síndrome torácico agudo puede ser rápidamente letal. Las células falciformes generalmente se pueden ver en el frotis de sangre periférica, pero se necesita la electroforesis de hemoglobina para el diagnóstico. El tratamiento de los episodios dolorosos consiste en líquidos y analgésicos por vía intravenosa y, en episodios graves, puede ser necesaria la exanguinotransfusión. La supervivencia mejora con la vacunación contra las infecciones bacterianas, los antibióticos profilácticos y el tratamiento agresivo de las infecciones.
Última actualización: Feb 6, 2023
La anemia drepanocítica o de células falciformes es un grupo de trastornos genéticos que causan una molécula de hemoglobina (Hb S) anormal que transforma los eritrocitos en células falciformes, lo que resulta en anemia crónica, episodios vasooclusivos, dolor y daño de órganos.
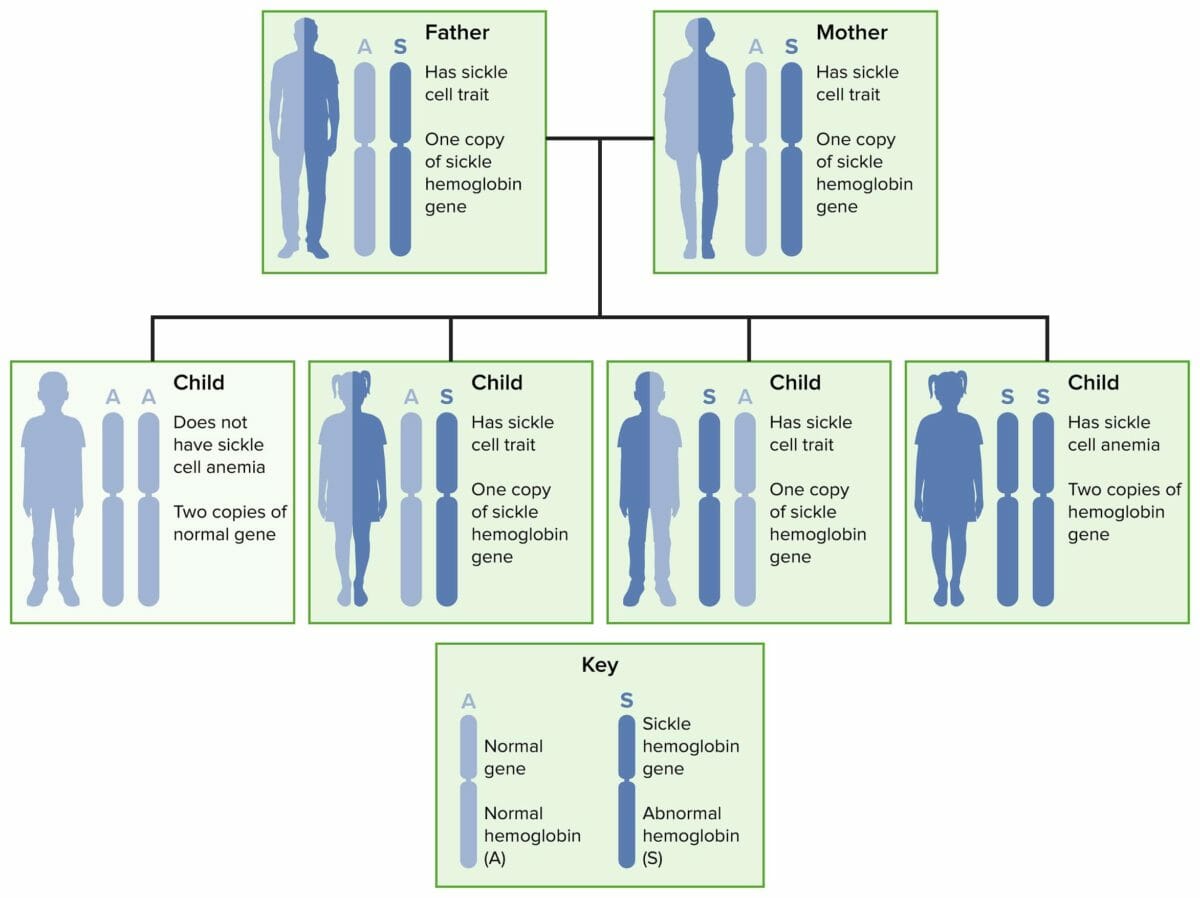
Herencia autosómica recesiva de la enfermedad de células falciformes y su rasgo
Imagen por Lecturio.La molécula normal de hemoglobina adulta (HbA1) consta de 2 pares de cadenas llamadas alfa y beta.
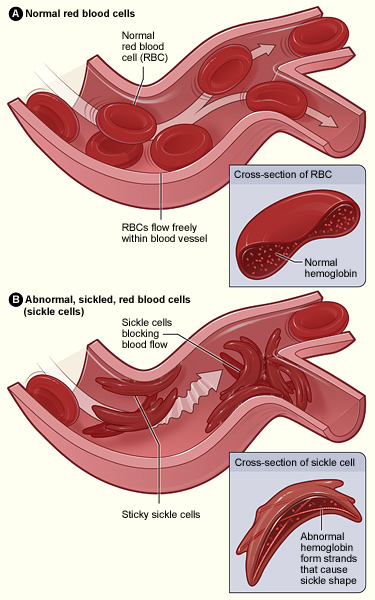
La hemoglobina anormal da lugar a la formación de hongos en los glóbulos rojos y a la adhesión de las células falciformes al endotelio, que es activado por los glóbulos rojos adheridos. La oclusión de los vasos pequeños se produce por un agregado de glóbulos rojos falciformes, con plaquetas y glóbulos blancos (no se muestra en la figura).
Imagen: “Sickle cell 01” por The National Heart, Lung, and Blood Institute (NHLBI). Licencia: Dominio PúblicoLa mayoría de los síntomas resultan de la anemia y los eventos vasooclusivos que se observan en individuos con anemia drepanocítica o complicaciones que incluyen infección.
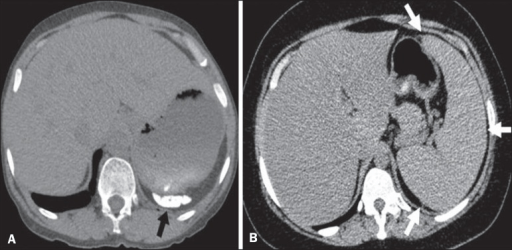
Diferentes patrones de afectación esplénica en la enfermedad de células falciformes:
A: atrofia y calcificación del bazo (flecha)
B: esplenomegalia (flechas)
La enfermedad de células falciformes generalmente se diagnostica prenatalmente o al nacer mediante un tamizaje neonatal obligatorio. Los métodos varían de un estado a otro.
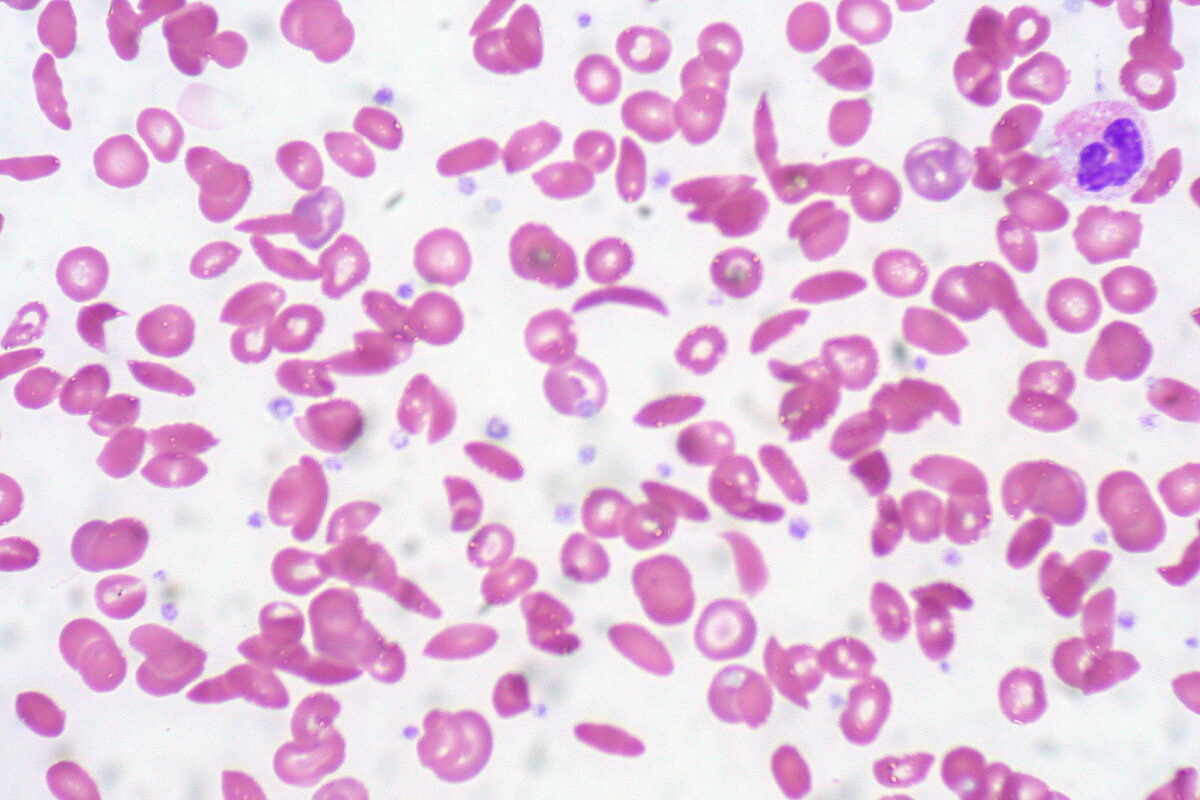
Frotis de sangre periférica que muestra una mezcla de eritrocitos, algunos con morfología redonda normal y otros con forma de hoz (alargamiento y flexión)
Imagen: “Sickle Cell Anemia” por Ed Uthman. Licencia: CC BY 2.0El tratamiento de los episodios dolorosos incluye analgésicos y medidas generales de soporte. Las transfusiones pueden ser necesarias en ocasiones si el paciente tiene anemia sintomática, incluyendo la complicación del síndrome torácico agudo
| Presentación clínica | Tratamiento |
|---|---|
| Episodios de dolor agudo/eventos vasooclusivos |
|
| Secuestro esplénico agudo |
|
| Infecciones | Prevención:
|
| Priapismo |
|
| Tamizaje profiláctico |
|
| Refractario |
|