Bunyaviridae es una familia de virus de ARN que se clasifica en 5 géneros: Orthobunyavirus (virus La Crosse), Hantavirus, Nairovirus (virus de la fiebre hemorrágica de Crimea-Congo), Phlebovirus (virus de la fiebre del Valle del Rift) y Tospovirus. Las características comunes de la familia de virus con un genoma tipo ácido ribonucleico (ARN) de sentido negativo monocatenario, incluyen que tiene tres segmentos, y que se encuentra en una estructura esférica envuelta. Las infecciones generalmente son transmitidas por artrópodos o roedores. Hay múltiples manifestaciones clínicas, en general se presentan como fiebres hemorrágicas y/o encefalitis. Los procedimientos de diagnóstico incluyen serología y RT-PCR. El tratamiento es principalmente de soporte.
Última actualización: Dic 8, 2024
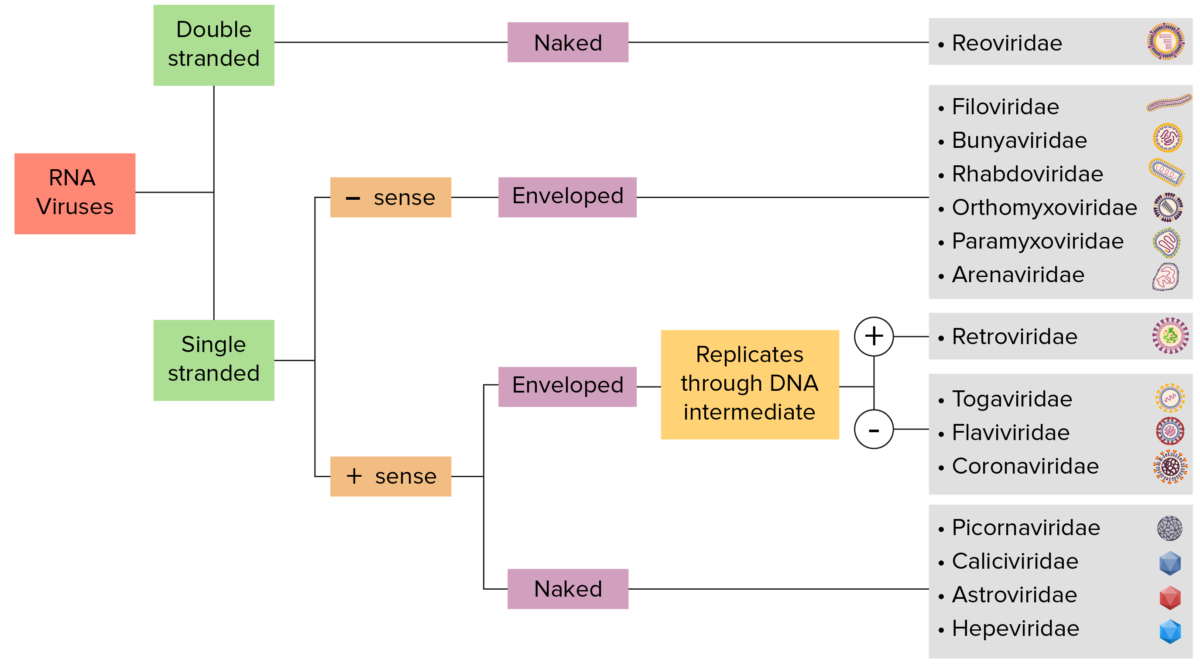
Identificación de los virus ARN:
Los virus pueden clasificarse de muchas maneras. Sin embargo, la mayoría de los virus tienen un genoma formado por ADN o ARN. Los virus del genoma de ARN se pueden caracterizar adicionalmente basándose en la presencia de ARN monocatenario o bicatenario. Los virus «envueltos» están cubiertos por una fina capa de membrana celular (normalmente tomada de la célula huésped). Si no poseen envoltura, los virus se denominan «desnudos». Los virus con genomas monocatenarios se denominan virus de «sentido positivo» si el genoma se utiliza directamente como ARN mensajero (ARNm), el cual se traduce en proteínas. Los virus monocatenarios de «sentido negativo» emplean la ARN polimerasa dependiente de ARN, una enzima viral, para transcribir su genoma en ARN mensajero.
Una partícula del virus Sin Nombre que se muestra gemando de una célula Vero:
El virus Sin Nombre causa el síndrome pulmonar por hantavirus en América del Norte.
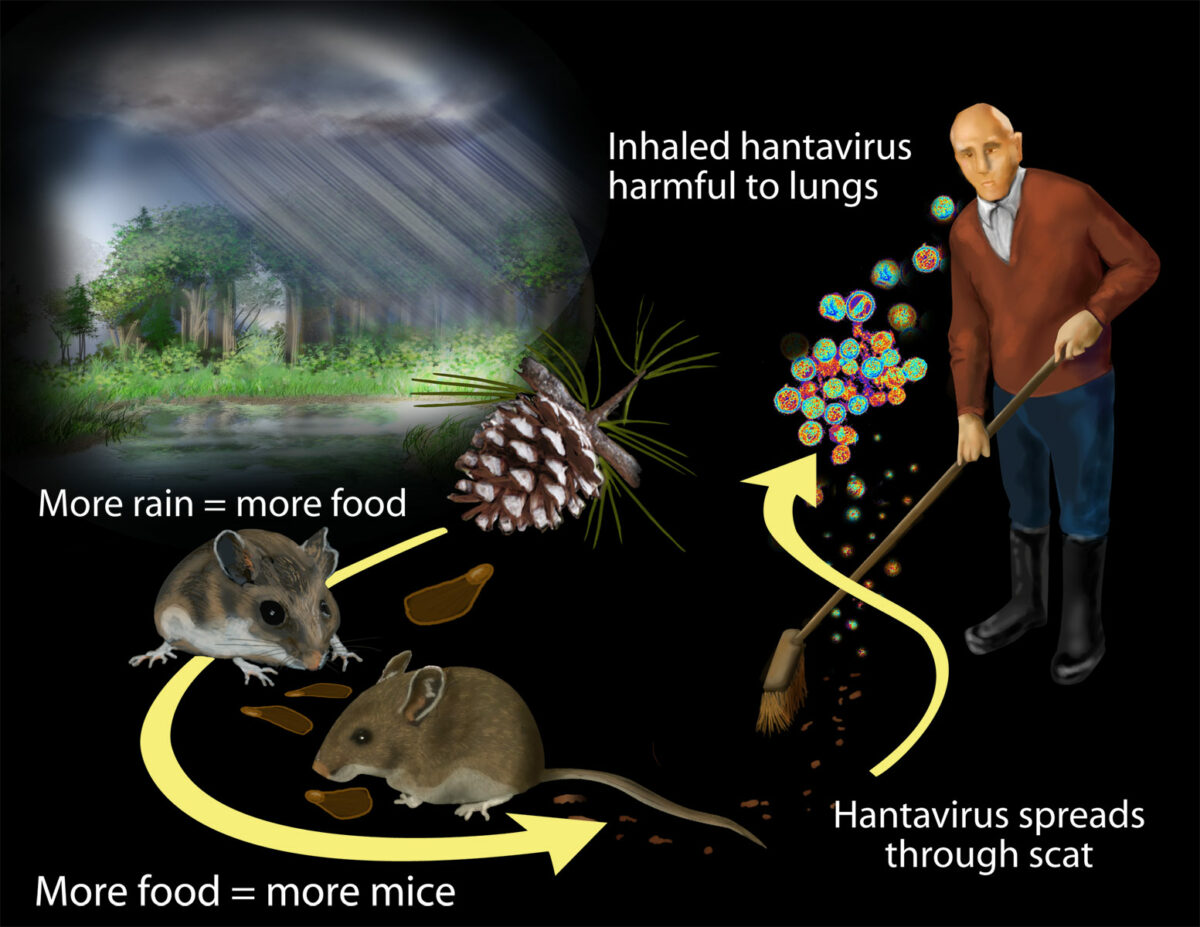
Transmisión de hantavirus:
Los investigadores encontraron que el contacto con roedores y sus desechos pone a los humanos en riesgo de exposición al hantavirus. Las lluvias masivas asociadas con fenomeno del Niño de 1991-1992 impulsaron la productividad de las plantas.
La población de roedores creció al alimentarse con la materia vegetal más abundante. El mayor contacto con roedores y sus desechos pone a más humanos en riesgo de exposición al hantavirus.
| Síndrome pulmonar por hantavirus | Fiebre hemorrágica por hantavirus | |
|---|---|---|
| Incubación | 1–3 semanas | 1–3 semanas (hasta 6 semanas) |
| Diagnóstico |
|
|
| Manifestaciones clínicas | Pródromo: síntomas similares a los de la gripe, aparición repentina de dificultad para respirar con edema pulmonar de rápida evolución | Fiebre, presión arterial baja/shock, IRA |
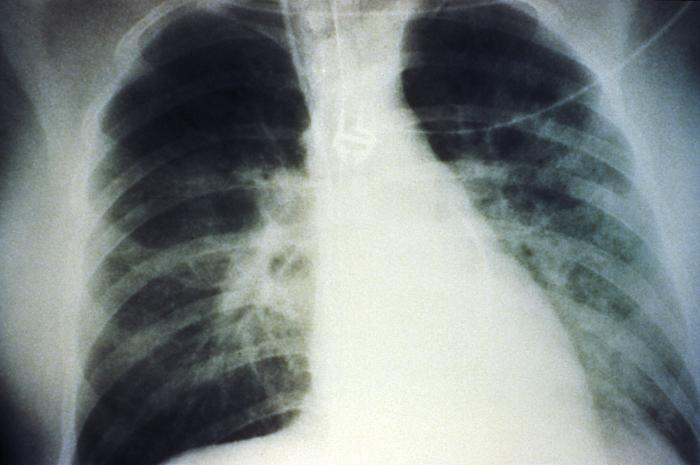
Una radiografía de tórax anteroposterior muestra un derrame pulmonar bilateral en estadio medio debido al síndrome pulmonar por hantavirus:
La evolución radiológica del síndrome pulmonar por hantavirus comienza con cambios mínimos por edema pulmonar intersticial que progresa a edema alveolar con afectación bilateral severa. Los derrames pleurales son frecuentes y, a menudo, lo suficientemente grandes como para ser evidentes radiográficamente.
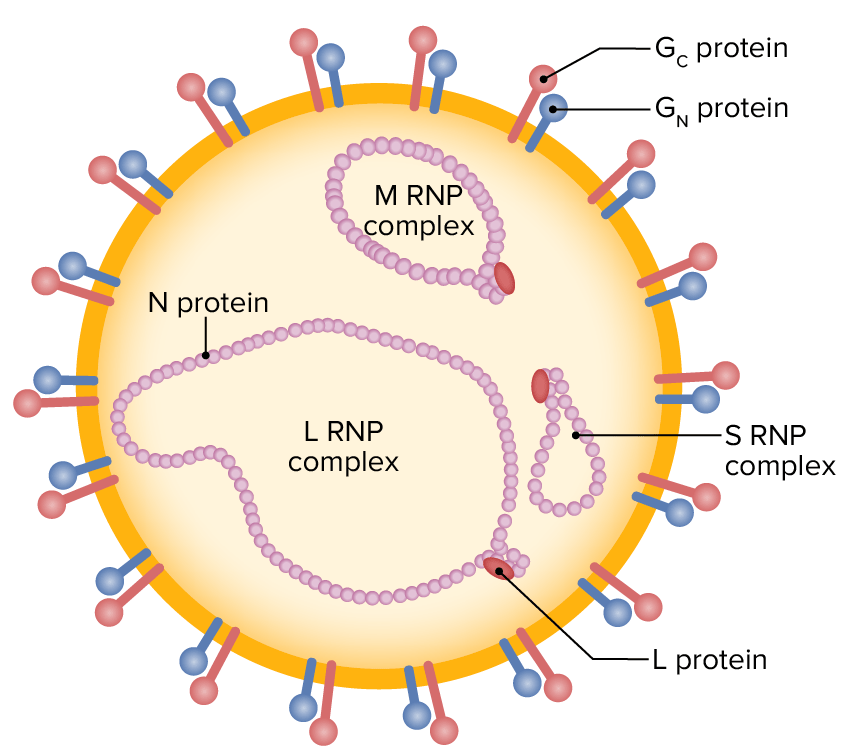
Ilustración esquemática de una partícula de nairovirus (ARN monocatenario envuelto que contiene segmentos L, M y S, rodeado de glicoproteínas externas)
RNP: ribonucleoproteína
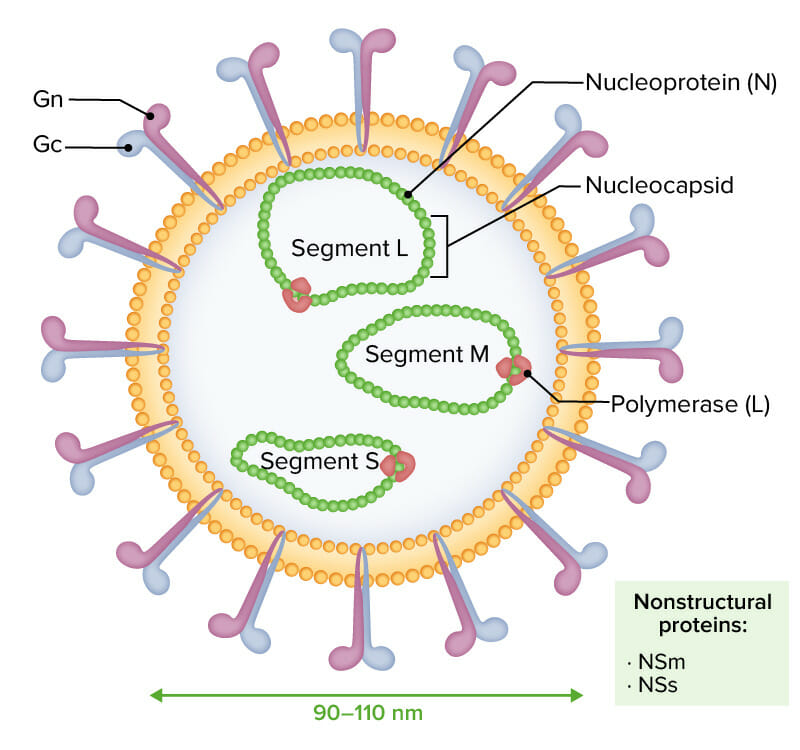
Los viriones envueltos del virus de la fiebre del Valle del Rift se caracterizan por un genoma de ARN negativo o ambisentido compuesto por 3 segmentos monocatenarios (designados L, M y S):
Las 3 moléculas de ARN están encapsuladas por la nucleoproteína (N), dando forma a la nucleocápside e interactuando con la polimerasa viral (L). Las glicoproteínas Gn y Gc se observan externamente. Las proteínas no estructurales NSm y NSs se expresan durante la infección.
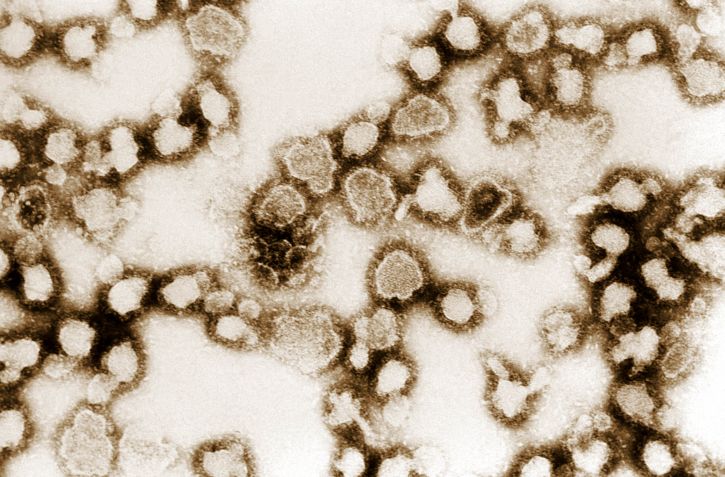
Imagen que muestra la morfología ultraestructural exhibida por numerosas partículas del virus La Crosse (LCV)
Imagen: “Image showing the ultrastructural morphology exhibited by numerous La Crosse virus (LCV) particles” por Dr. Erskine Palmer, USCDCP.Licencia: Dominio Público| Organismo | Hantavirus | Virus de la fiebre hemorrágica de Crimea-Congo | Virus de la fiebre del valle del Rift | Virus de La Crosse | |
|---|---|---|---|---|---|
| Características | Virus de ARN monocatenario, envuelto y de sentido negativo | ||||
| Género | Hantavirus u Orthohantavirus | Nairovirus | Phlebovirus | Orthobunyvirus | |
| Transmisión | Inhalación y contacto directo con la orina y las heces de ratones infectados | Contacto con garrapatas infectadas (especialmente Hyalomma spp.) |
|
Picadura de mosquito | |
| Presentación Clínica |
|
Fiebre hemorrágica |
|
Encefalitis | |
| Diagnóstico |
|
|
|
|
|
| Tratamiento | De soporte |
|
De soporte | De soporte | |