El síndrome de DiGeorge es una afección causada por una microdeleción en la ubicación q11.2 del cromosoma 22 (también llamado síndrome de deleción 22q11.2). Hay un desarrollo defectuoso de la tercera y cuarta bolsas faríngeas, lo que conduce a hipoplasia tímica y paratiroidea (que causa inmunodeficiencia de células T e hipocalcemia, respectivamente). Las anomalías conotruncales que se presentan como defectos cardíacos congénitos también son características de la enfermedad. Otras manifestaciones consisten en rasgos faciales característicos, infecciones frecuentes y trastornos neuropsiquiátricos. El diagnóstico se obtiene mediante una combinación de hallazgos clínicos, pruebas de laboratorio (células T reducidas y calcio bajo), ecocardiograma y análisis genético. El tratamiento puede incluir suplementos de calcio, antibióticos profilácticos, cirugía (para defectos cardíacos y anomalías del paladar) y trasplante de timo o células hematopoyéticas. El pronóstico depende de la gravedad de la anomalía cardíaca y la inmunodeficiencia.
Última actualización: Feb 25, 2025
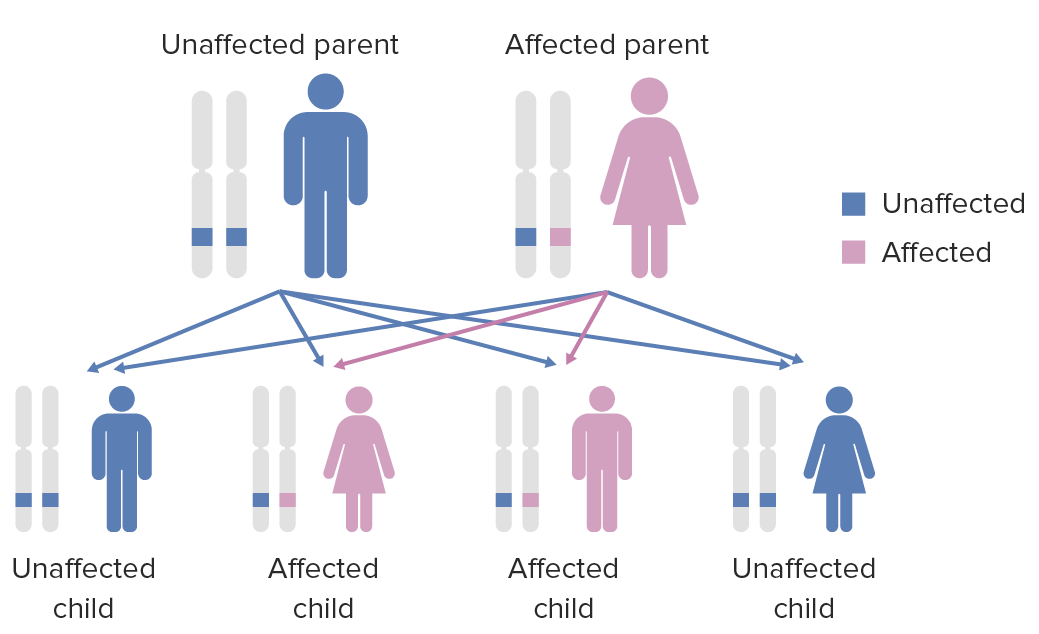
Diagrama del patrón de herencia de las condiciones autosómicas dominantes
Imagen por Lecturio.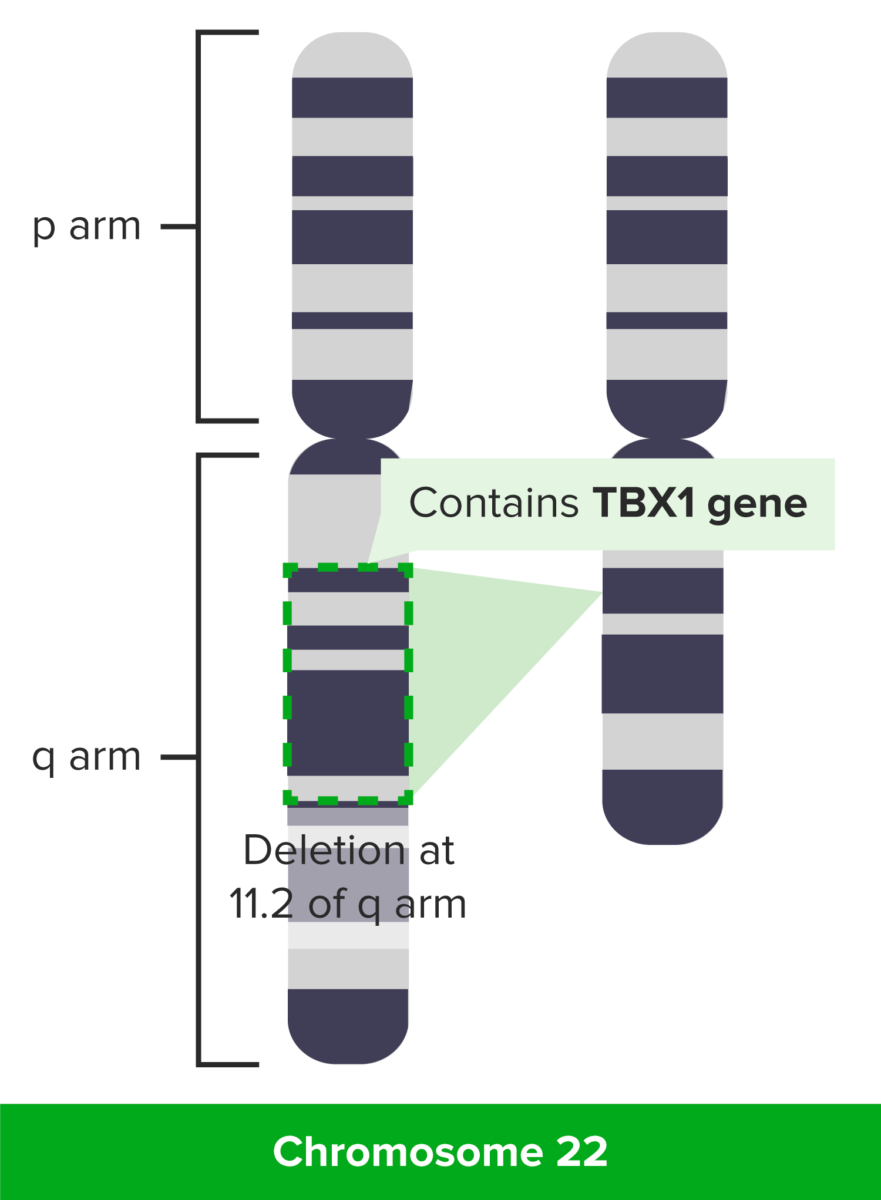
Síndrome de DiGeorge: deleción en 11.2 del brazo q
Imagen por Lecturio.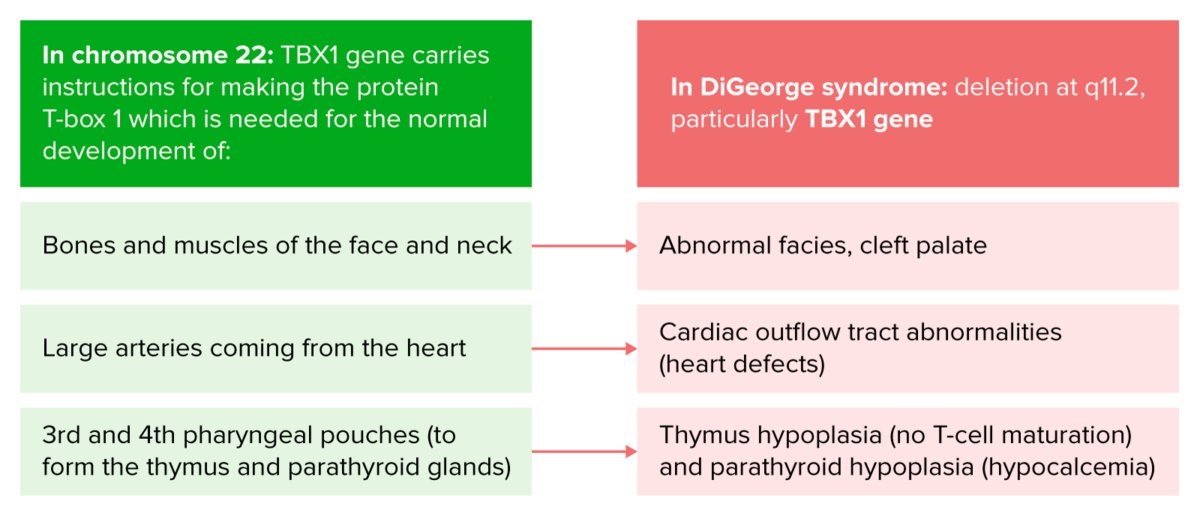
Fisiopatología del síndrome de DiGeorge
Imagen por Lecturio.El síndrome de DiGeorge tiene una marcada variabilidad en la expresión clínica entre diferentes individuos. Las manifestaciones pueden incluir las siguientes:
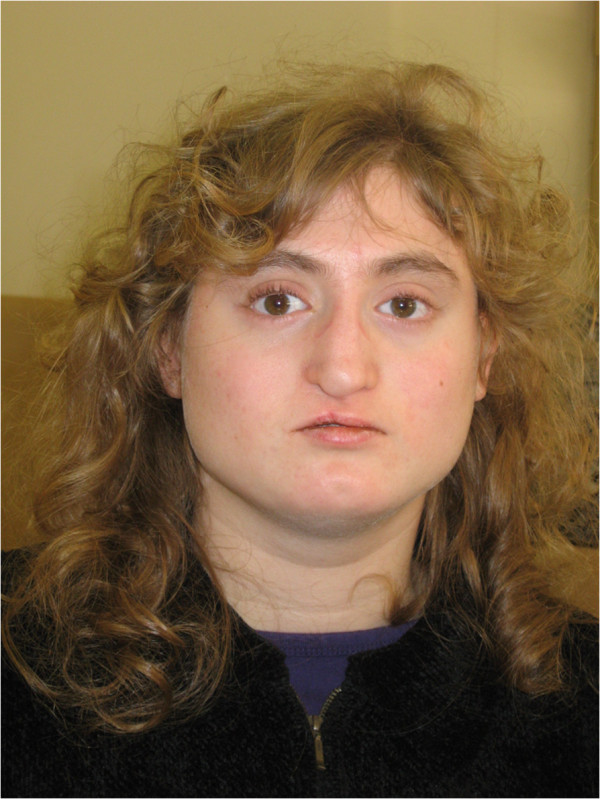
Aspecto facial de una paciente con deleción 22q11.2 atípica. Es de notar la cara ancha y cuadrada; hipotelorismo; base nasal estrecha y puente nasal ancho; punta nasal sobresaliente; punta nasal desviada (estado posterior a la reparación del labio leporino); surco nasolabial corto; boca estrecha hoyuelo en la barbilla; y cuello ancho.
Imagen: “Facial appearance of Patient VC901” por Elena Michaelovsky et al. Licencia: CC BY 2.0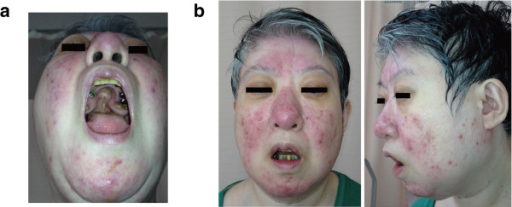
Características de la deleción 22q11.2 en una mujer de 48 años.
(a) Paladar hendido; tuvo una cirugía previa
(b) Rasgos faciales dismórficos leves, que incluyen una línea del cabello anterior baja, párpados hinchados, planitud malar, nariz con una punta nasal bulbosa, alas nasales hipoplásicas y una raíz nasal cuadrada y plana, boca pequeña y un labio superior delgado
Los signos del síndrome de DiGeorge se pueden resumir utilizando el mnemónico CATCH-22 (en inglés):
Establecer un diagnóstico es difícil debido a la variabilidad de los fenotipos. El diagnóstico de DiGeorge se determina al demostrar una disminución de las células T CD3+, además de los hallazgos clínicos característicos y los estudios genéticos que demuestran la deleción en el área cromosómica 22q11.2.
El tratamiento tiene como objetivo tratar las características asociadas de la enfermedad. La intervención temprana y la evaluación del desarrollo son fundamentales.
No existe cura para el síndrome de DiGeorge. La esperanza de vida depende en gran medida del grado de defectos cardíacos (factor más importante) y la inmunodeficiencia.