El síndrome de Cushing o hipercortisolismo es un trastorno caracterizado por los rasgos resultantes de la exposición crónica a un exceso de glucocorticoides. El síndrome de Cushing puede ser exógeno, debido a la ingesta crónica de glucocorticoides, o endógeno, debido a un aumento de la secreción suprarrenal de cortisol o de la producción de la hormona adrenocorticotrópa (ACTH, por sus siglas en inglés) desde la hipófisis o fuentes ectópicas. El hipercortisolismo exógeno o iatrogénico es la causa más común. Las características clínicas típicas del hipercortisolismo incluyen la obesidad central, la piel delgada y amoratada, las estrías abdominales, la hipertensión secundaria, la hiperglucemia y la debilidad muscular proximal. El enfoque diagnóstico inicial es establecer el hipercortisolismo mediante pruebas de cortisol urinario y salival junto con una prueba de supresión de dexametasona a dosis bajas. Una vez confirmados los niveles elevados de cortisol, la etiología se determina en función de los niveles de ACTH, las pruebas bioquímicas confirmatorias y los estudios de imagen posteriores. Las opciones de tratamiento dependen de la causa, e incluyen cirugía y terapia médica.
Última actualización: Feb 18, 2022
El síndrome de Cushing o hipercortisolismo es un trastorno caracterizado por los rasgos resultantes de la exposición crónica a un exceso de glucocorticoides.
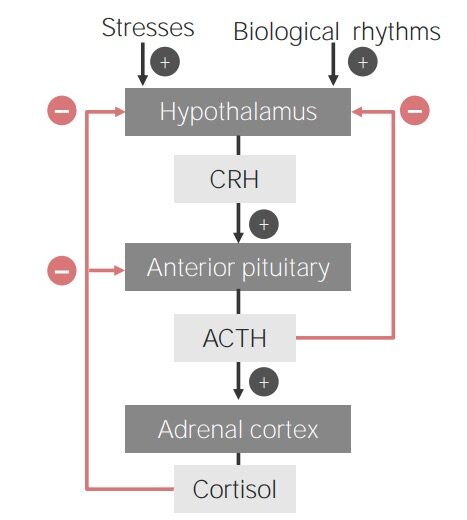
Diagrama de flujo del eje hipotálamo-hipófisis-corteza suprarrenal
Imagen por Lecturio.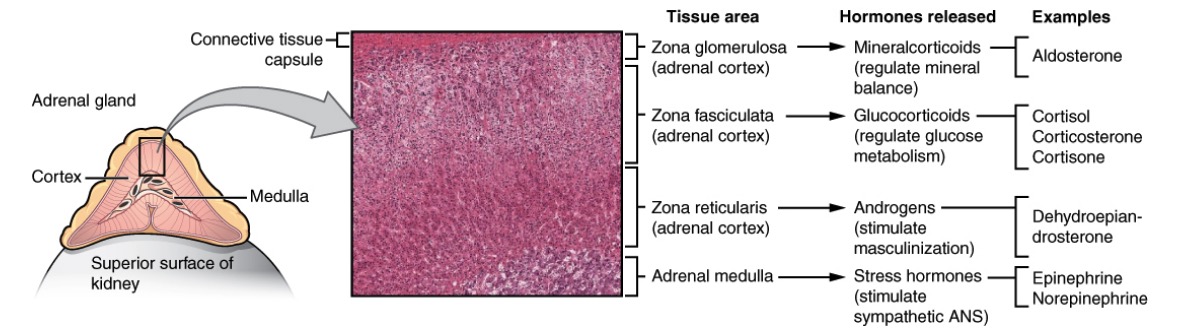
Anatomía, histología y fisiología de las diferentes zonas de la glándula suprarrenal:
La corteza tiene una zona glomerulosa que produce mineralocorticoides («sal»), una zona fasciculada que produce glucocorticoides («azúcar») y una zona reticular que produce andrógenos («sexo»). La médula suprarrenal produce epinefrina y norepinefrina («estrés»).
| Piel |
|
|---|---|
| Grasa corporal | Facies lunar, obesidad central, joroba de búfalo (almohadilla de grasa dorsocervical) |
| Hueso | Baja estatura (disminución del crecimiento lineal en niños), osteopenia, osteoporosis, ↑ riesgo de necrosis avascular |
| Músculo | Miopatía proximal, debilidad |
| Metabolismo | Glucosa/diabetes elevada, dislipidemia |
| Reproductivas | Amenorrea en las mujeres, disminución de la libido |
| Cardiovasculares | Aterosclerosis, hipertensión, edema |
| Gastrointestinales | Úlceras |
| Neuropsiquiátricas | Irritabilidad, depresión, labilidad emocional, trastornos del sueño, psicosis |
| Oftalmológico | Cataratas (los esteroides afectan a la transcripción genética de las células epiteliales del cristalino) |
| Sistema inmunitario | Aumento del recuento de leucocitos, mayor susceptibilidad a la infección |
Para recordar las características clínicas más comunes del síndrome de Cushing, recuerde «CUSHINGOID«:
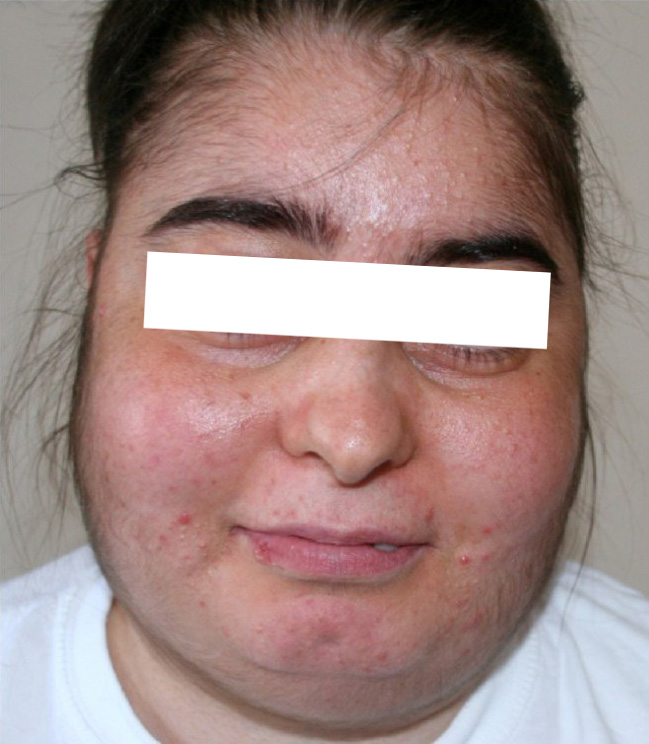
Características del síndrome de Cushing: mujer que presenta hirsutismo, acné y facies lunar
Imagen: “Patient’s facial appearance” por Ozlem Celik et al. Licencia: CC BY 2.5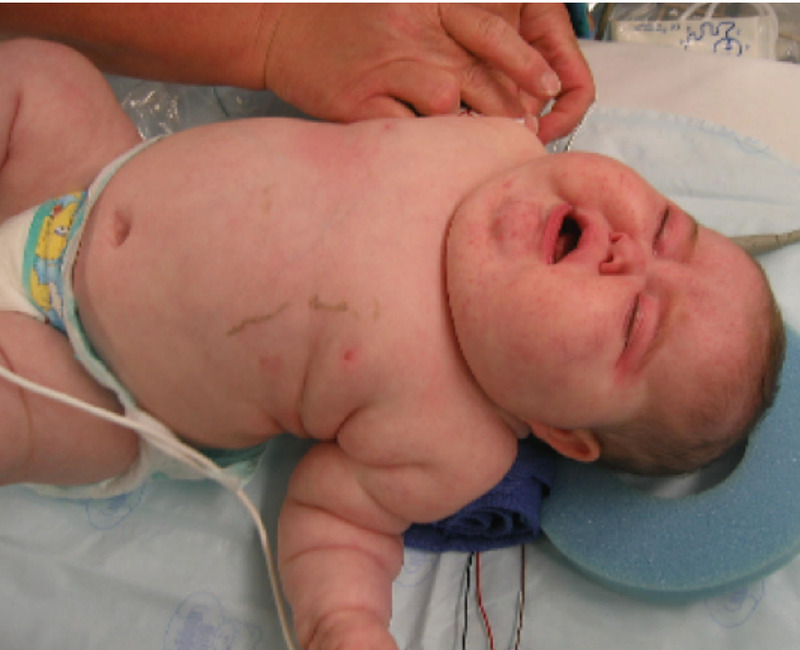
Bebé con síndrome de Cushing:
Los rasgos que se observan son la facies lunar, la plétora, el acné, la obesidad central y el escaso tono muscular.
Las características clínicas aumentan la sospecha del diagnóstico:
Excluir el uso de glucocorticoides exógenos:
Pruebas iniciales de hipercortisolismo:
Los resultados anormales conllevan a una evaluación adicional:
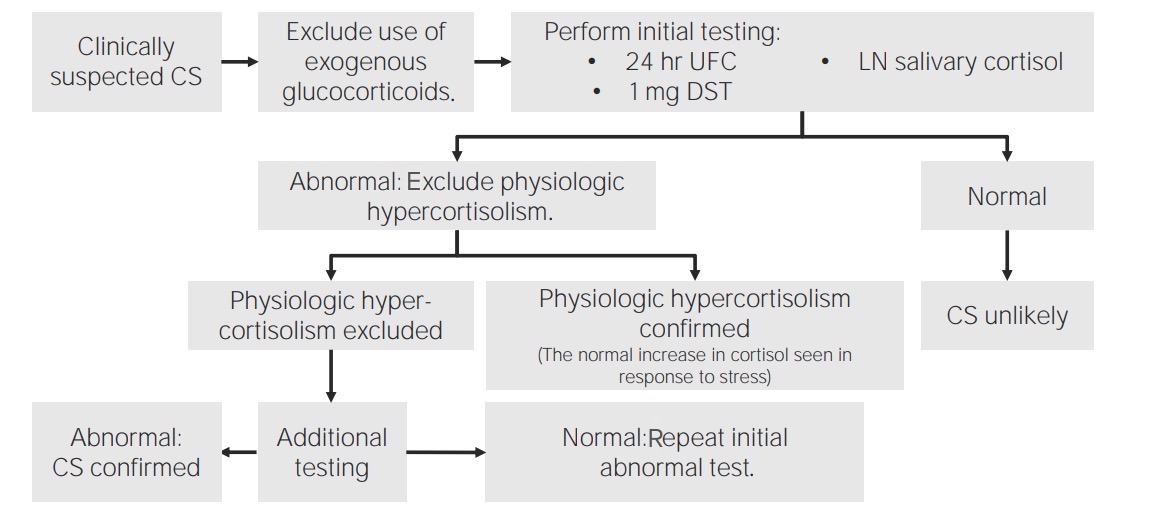
Algoritmo para diagnosticar el hipercortisolismo o síndrome de Cushing (SC):
En los pacientes con sospecha clínica de SC, el primer paso es descartar el uso exógeno de glucocorticoides. Una vez excluido, las pruebas iniciales para comprobar los niveles elevados de cortisol incluyen el cortisol salival nocturno, el cortisol libre urinario de 24 horas (UFC) y la prueba de supresión de dexametasona de 1 mg (DST). Una vez que se confirman los niveles elevados de cortisol, se debe evaluar si la elevación es por hipercortisolismo fisiológico. Ya excluidas las causas fisiológicas, se procede a realizar pruebas adicionales para identificar la etiología (que puede ser primaria o secundaria).
Tras confirmar los niveles elevados de cortisol, la determinación de la etiología comienza con la ACTH.
| Nivel de ACTH | Etiología y pruebas adicionales | Identificar la causa |
|---|---|---|
| ↓ ACTH: Independiente de la ACTH | Glándula suprarrenal (posible adenoma, carcinoma, hiperplasia) | Obtenga un TC/RM de la glándula suprarrenal. |
| ACTH↑ o intermedio: probablemente dependiente de ACTH | Enfermedad de Cushing:
|
Obtenga una RM de la hipófisis. |
Síndrome de ACTH ectópico (como cáncer de pulmón, carcinoide):
|
Estudio de malignidad:
|