El síndrome de Cowden, también conocido como síndrome de hamartoma múltiple, es una condición hereditaria autosómica dominante que se presenta con múltiples crecimientos no cancerosos en varias partes del cuerpo. El síndrome se clasifica como un síndrome de tumor hamartoma homólogo de la fosfatasa y tensina (PTEN, por sus siglas en inglés) causado por mutaciones en el gen PTEN. Los pacientes suelen tener macrocefalia, triquilemomas (tumores del folículo piloso) y pápulas papilomatosas en la boca. El síndrome de Cowden se asocia con un mayor riesgo de desarrollar cáncer de mama, tiroides, colon y endometrio. El tratamiento incluye vigilancia de tumores asociados y cirugías profilácticas.
Última actualización: Abr 15, 2025
El síndrome de Cowden es una genodermatosis autosómica dominante causada por una mutación en el gen PTEN y se caracteriza por múltiples hamartomas benignos en cualquier localización del cuerpo, lesiones mucocutáneas y macrocefalia.
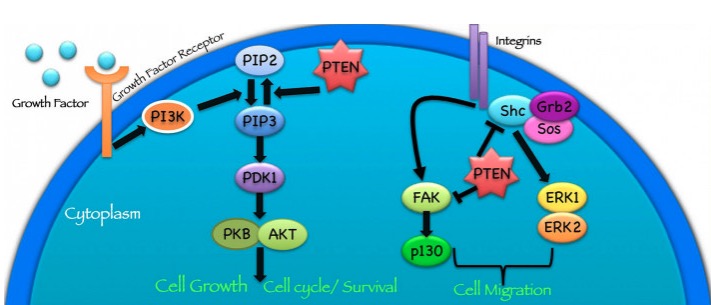
Función de la proteína PTEN:
La proteína PTEN funciona de diferentes maneras para suprimir la formación y propagación de tumores.
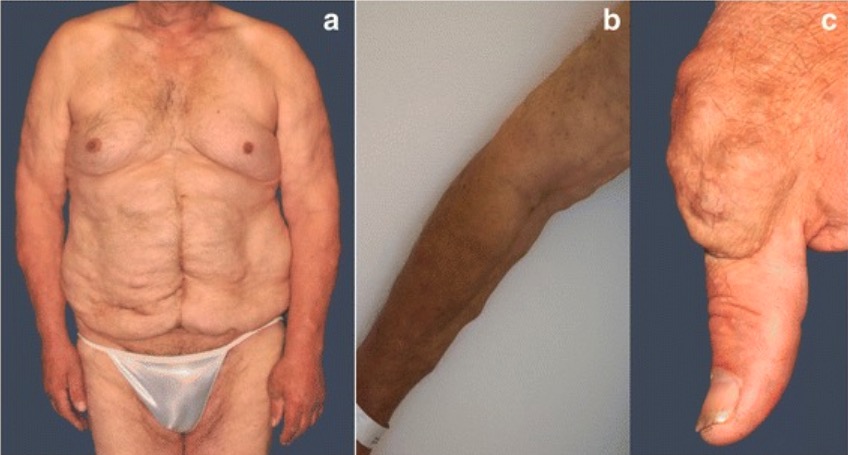
Múltiples tumores de tejidos blandos en (a) el torso, (b) extremidades, y (c) la articulación de la base del pulgar izquierdo
Imagen: “Fig. 2” por Steffen Pistorius et al. Licencia: CC BY 4.0
Macrocefalia y tiroides difusamente agrandada en un paciente pediátrico con síndrome de Cowden
Imagen: “Diffusely enlarged thyroid gland” por Cláudia Patraquim et al. Licencia: CC BY 2.0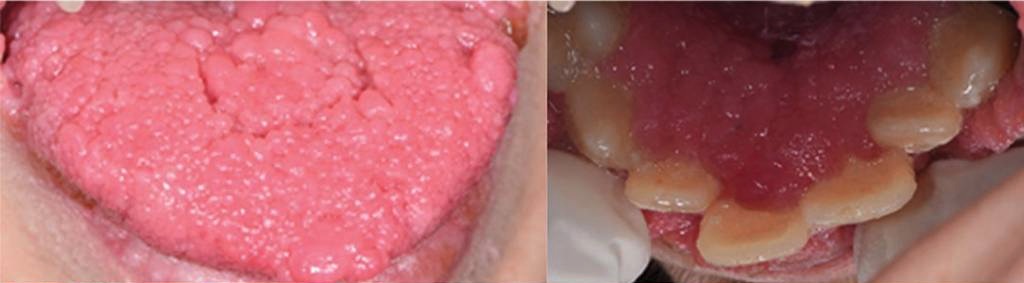
Izquierda: múltiples lesiones papilomatosas en la lengua
Derecha: múltiples lesiones papilomatosas coalescentes que cubren el área cervical de los dientes
Triquilemomas en el hueso malar derecho de un paciente con enfermedad de hamartoma múltiple
Imagen: “Trichilemmomas on the right malar bone” por Prashanthi Chippagiri et al. Licencia: CC BY 3.0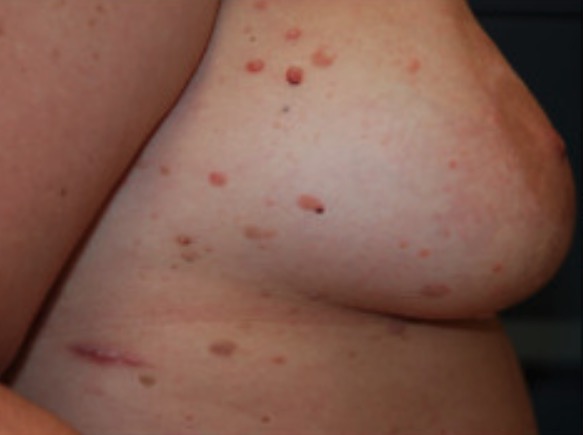
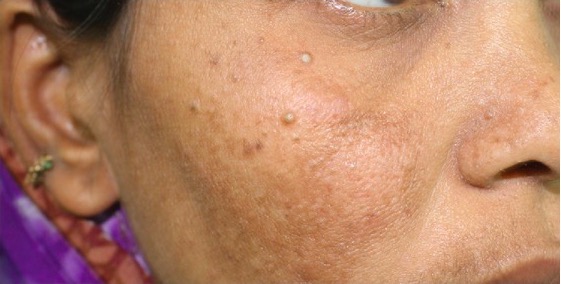
Múltiples queratosis seborreicas en una paciente con cáncer de mama bilateral de inicio precoz
Imagen: “Cutaneous findings of our case” por Laura Maria Pradella et al. Licencia: CC BY 2.0, recortada por Lecturio.Las pruebas de laboratorio están dirigidas por la presentación clínica, y el síndrome de Cowden puede presentarse con anemia (por pérdidas gastrointestinales), enfermedad renal, enfermedad tiroidea y lesiones cutáneas.
Basado en el motivo de consulta, los estudios de imagen pueden incluir:
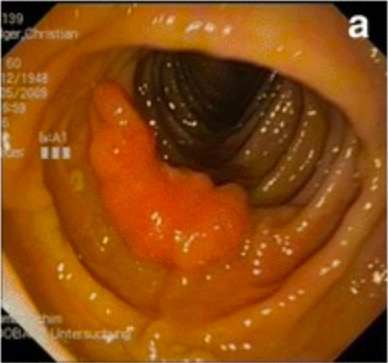
Hamartoma de colon descendente en paciente con síndrome de Cowden
Imagen: “Preoperative colonoscopic views” por Pistorius et al. Licencia: CC BY 4.0, recortada por Lecturio.Tratamiento