La inmunidad a los patógenos se divide en respuestas inmunitarias innatas y adaptativas. La respuesta inmune innata es la 1ra línea de defensa contra una variedad de patógenos, incluyendo bacterias, hongos, virus y parásitos. Esencialmente de la misma forma, el tipo innato de inmunidad está presente en todos los organismos multicelulares. La respuesta inmunitaria innata se activa de minutos a horas después de la exposición a una infección, lo que reduce la invasión de microbios en las etapas iniciales. El patógeno tiene componentes específicos reconocidos por receptores de reconocimiento de patrones. Después de la identificación de una invasión microbiana, los componentes no celulares (incluido el sistema del complemento y las citoquinas) actúan en conjunto con los elementos celulares para lograr el reclutamiento celular, la destrucción microbiana directa o la inducción de fagocitosis. Todos los pasos apuntan a eliminar el patógeno. Los mecanismos antimicrobianos en la fagocitosis incluyen la acidificación y el estallido respiratorio/oxidativo. El proceso termina con la destrucción de la amenaza mientras se mantiene la homeostasis inmunológica. La defensa también es importante en la activación del sistema inmunológico adaptativo.
Última actualización: Mar 21, 2023
El sistema inmunitario brinda defensa (inmunidad) contra patógenos invasores que van desde virus hasta parásitos; Los componentes están interconectados por la circulación sanguínea y linfática.
Dos líneas de defensa superpuestas:
| Inmunidad innata | Inmunidad adaptativa | |
|---|---|---|
| Genética | Línea germinal codificada | Reordenamientos genéticos implicados en el desarrollo de linfocitos |
| Respuesta inmune | No específica | Altamente específica |
| Tiempo de respuesta | Inmediato (minutos a horas) | Se desarrolla durante un período de tiempo más largo |
| Respuesta de memoria | Ninguna | Responde rápidamente al reconocimiento del antígeno con respuesta de memoria |
| Reconocimiento del patógeno | Los receptores de reconocimiento de patrones, como los receptores tipo toll, reconocen patrones moleculares asociados a patógenos |
|
| Componentes |
|
|
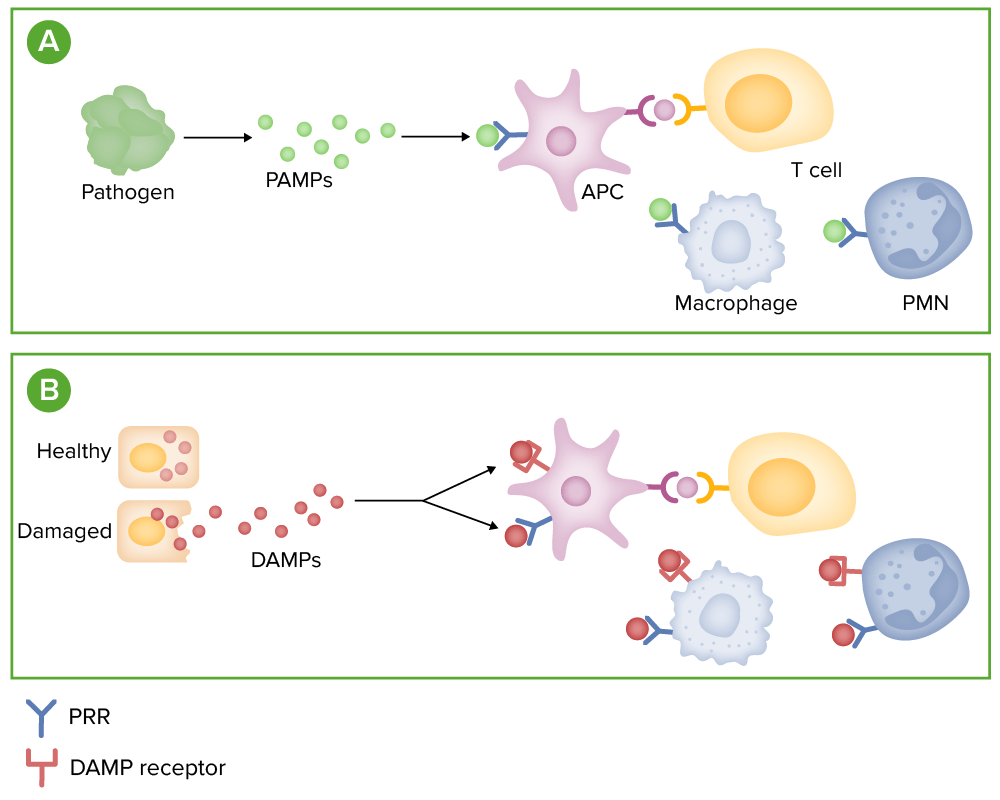
Detección de microbios:
(A) Los microbios liberan patrones moleculares asociados a patógenos (PAMP), que pueden unirse a los receptores de reconocimiento de patrones (PRR), como los receptores tipo Toll, en las células inmunitarias.
(B) Las células estresadas o dañadas liberan moléculas, denominadas patrones moleculares asociados a daños (DAMP). Estas moléculas se unen tanto a los PRR como a los receptores DAMP especializados de las células inmunitarias.
La unión de estos receptores promueve la liberación de mediadores inflamatorios, como citoquinas, quimiocinas y complemento.
PMN: polimorfonuclear (neutrófilo)
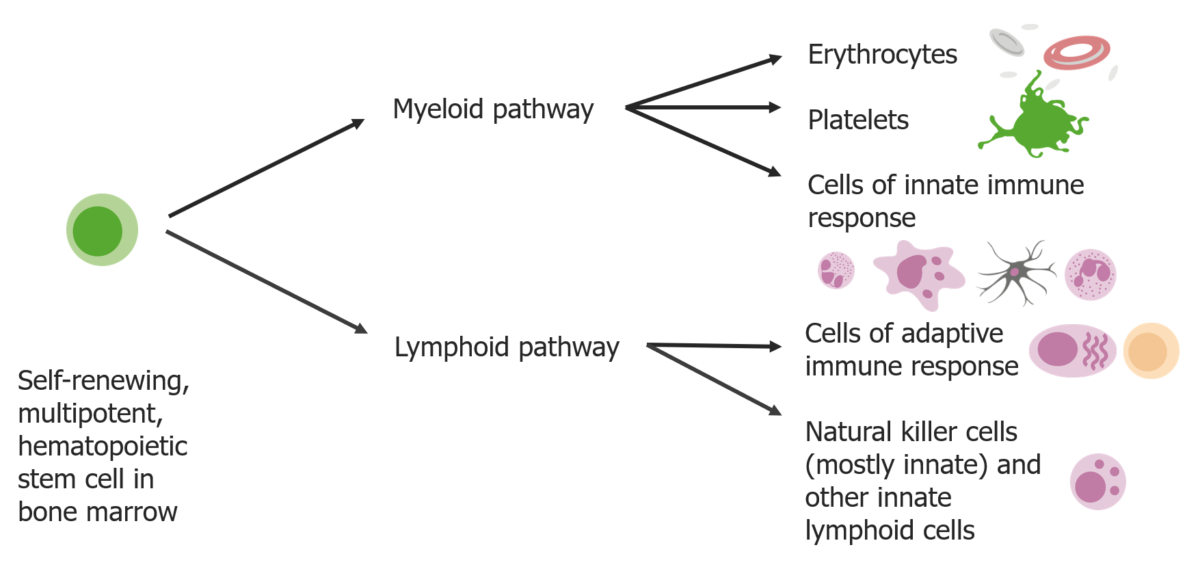
Las células madre se diferencian en 2 vías:
Las vías mieloides producen eritrocitos, plaquetas y células de la respuesta inmune innata. Las vías linfoides producen las células de respuesta adaptativa y las células asesinas naturales.
Las células epiteliales recubren las superficies corporales y están muy expuestas a los antígenos.
Incluye:
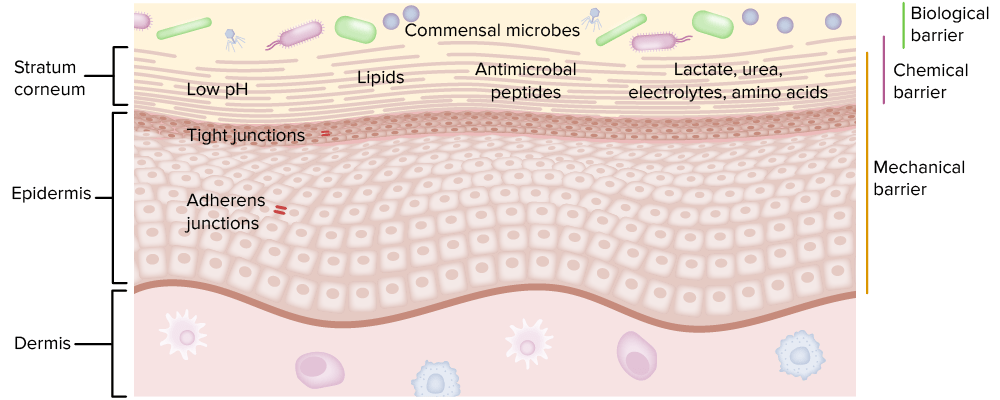
Los 3 tipos diferentes de barreras son una parte importante de la inmunidad innata.
Imagen por Lecturio.Los receptores de reconocimiento de patrones asociados a células se expresan en diversas células inmunitarias y pueden ser intracelulares (endolisosomal/citoplasmático) o transmembrana.
| Receptor tipo toll | Localización | Ligando | Origen del ligando |
|---|---|---|---|
| TLR1 | Membrana plasmática | Triacil lipoproteína | Bacterias |
| TLR2 | Lipoproteína | Bacterias, virus, parásitos | |
| TLR3 | Endolisosoma | ARNds | Virus |
| TLR4 | Membrana plasmática | LPS | Bacterias, virus |
| TLR5 | Flagelina | Bacterias | |
| TLR6 | Lipoproteína de diacil | Bacterias, virus | |
| TLR7, TLR8 | Endolisosoma | ARNss | Virus, bacterias |
| TLR9 | CpG-ADN | Virus, bacterias, protozoos | |
| TLR10 | Desconocido | Virus de la influenza, Listeria monocytogenes |
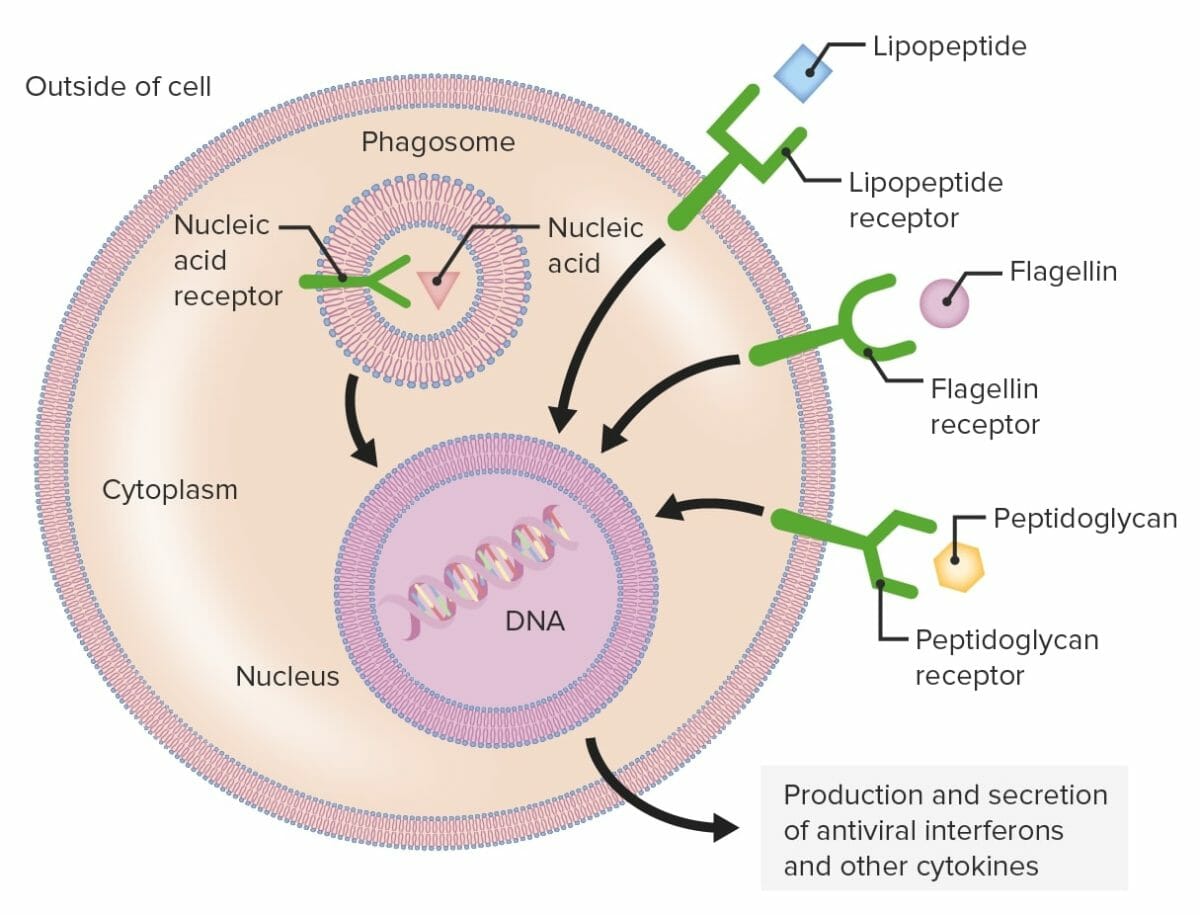
Receptores de reconocimiento de patrones:
Las células fagocíticas contienen receptores de reconocimiento de patrones capaces de reconocer varios patrones moleculares asociados a patógenos. Los receptores tipo Toll (mostrados como estructuras verdes), que son un grupo de receptores de reconocimiento de patrones, reconocen diferentes componentes microbianos, incluidos lipopéptidos, flagelina o peptidoglicano. Los receptores de reconocimiento de patrones se pueden encontrar en la membrana plasmática o intracelularmente.
Cuando un receptor de reconocimiento de patrones reconoce un patrón molecular asociado a patógenos, se envía una señal al núcleo que activa los genes implicados en la fagocitosis, proliferación celular, destrucción intracelular mejorada y la producción y secreción de interferones antivirales y citoquinas proinflamatorias.
Los receptores de reconocimiento de patrones secretados y circulantes incluyen muchas proteínas (e.g., péptidos antimicrobianos, lectinas, colectinas).
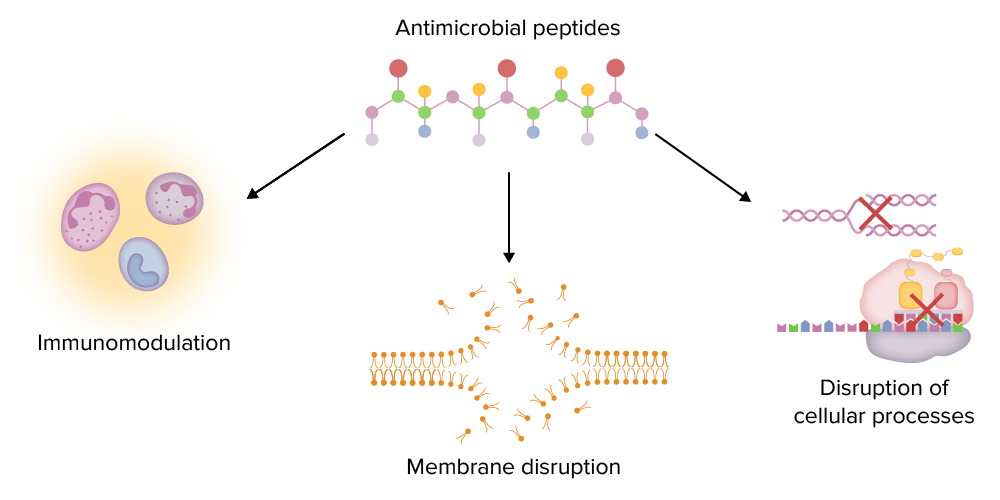
Principales funciones de los péptidos antimicrobianos (AMP):
Los AMPs pueden modular el sistema inmunitario (por ejemplo, estimulando la quimiotaxis, regulando la producción de citoquinas), alterar las membranas microbianas e interrumpir importantes procesos intracelulares (e.g., la síntesis de ADN y proteínas).
Las respuestas inmunitarias siguen al reconocimiento de moléculas patógenas. El sistema del complemento es 1 respuesta activada en forma de cascada para destruir los microbios.
La activación del complemento se realiza a través de vías distintivas (todas comienzan con una molécula iniciadora diferente), pero todas producen C3b (la molécula central de la cascada del complemento):
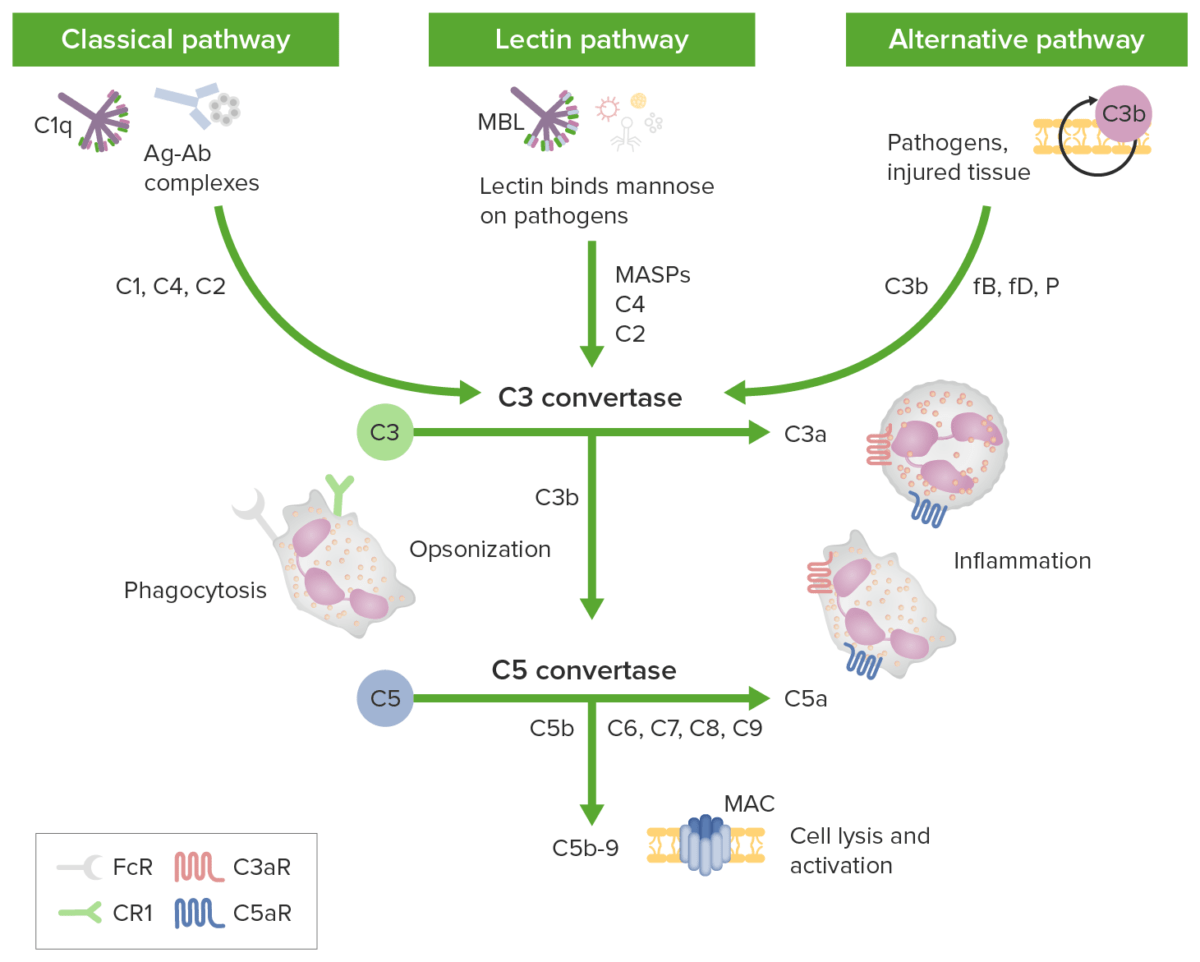
Las vías de iniciación del complemento conducen a una vía terminal común: Los recuadros verdes identifican las vías de iniciación; los componentes del complemento se identifican a lo largo de las flechas. La vía clásica es activada por complejos antígeno-anticuerpo (complejos Ag-Ab) reconocidos por C1q en complejo con C1r y C1s. Las proteasas C1r y C1s escinden C4 y C2 para generar la vía clásica C3 convertasa C4b2b. La vía de la lectina se activa por la unión de la lectina de unión a manosa (MBL) o las ficolinas a los carbohidratos en la membrana diana. Las serina proteasas asociadas a MBL (MASP) luego escinden C4 y C2 generando la convertasa C3 C4b2b. La vía alternativa se activa cuando los niveles bajos de proteína C3b se unen directamente a un microbio, material extraño o tejido dañado. Cuando C3b se une con el factor B, se forma C3bB. El factor B es escindido por el factor D para formar una vía alternativa C3-convertasa (C3bBb). La convertasa es estabilizada por la properdina. C3b opsoniza objetivos para fagocitosis y activación de células B. Las 3 vías de iniciación convergen en C3 con distintas convertasas C3 que escinden C3 para generar anafilatoxina C3a y más C3b para formar las convertasas C5 (C4b2a3b y C3bBb3b). La convertasa C5 luego escinde C5 en C5a y C5b. Las anafilatoxinas C3a, C4a y C5a pueden atraer/activar células inflamatorias y contraer el músculo liso a través de los receptores C3aR y C5aR. El complejo de ataque a membrana (MAC) se forma cuando C5b se une a C6, C7, C8 y múltiples copias de C9. Los poros complejos de ataque a membrana pueden causar la muerte celular por flujo osmótico.
Imagen por Lecturio.En última instancia, las vías del complemento tienen como objetivo eliminar los microbios y los desechos celulares/células apoptóticas:
Las citoquinas son proteínas solubles liberadas por diferentes células, que desempeñan funciones superpuestas en la inmunidad innata y adaptativa, como el sistema del complemento.
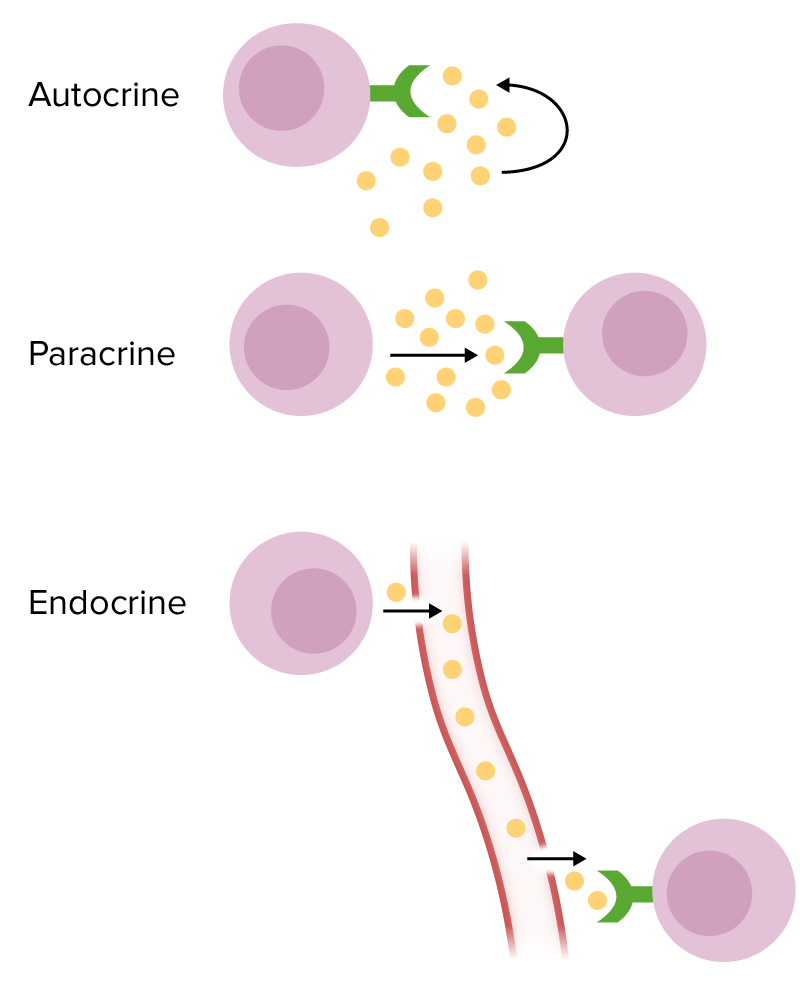
Formas de señalización química:
Autocrina: La célula diana es la misma que segrega citoquinas.
Paracrina: La célula diana de las citoquinas es una célula cercana.
Endocrina: Las citoquinas se secretan en la circulación para llegar a una célula diana lejana.
| Citoquinas | Fuente | Función y actividad |
|---|---|---|
| IL-1 | Monocitos, macrófagos, células B, fibroblastos, la mayoría de las células epiteliales |
|
| IL-2 | Células T |
|
| IL-3 | Células T, células NK, mastocitos | Estimulación de progenitores de hematopoyesis |
| IL-4 | Células T, mastocitos, basófilos |
|
| IL-5 | Células T, mastocitos, eosinófilos |
|
| IL-6 | Monocitos, macrófagos, células B, fibroblastos, la mayoría de las células epiteliales |
|
| IL-7 | Médula ósea, células epiteliales del timo | Diferenciación de células B, células T y células NK |
| IL-8 | Monocitos, macrófagos, células T, neutrófilos, fibroblastos, células endoteliales, células epiteliales |
|
| IL-9 | Células T |
|
| IL-10 | Monocitos, macrófagos, células T, células B, queratinocitos, mastocitos |
|
| IL-11 | Células del estroma de la médula ósea |
|
| IL-12 | Macrófagos activados, células dendríticas, neutrófilos |
|
| IFN-ɣ | Células T, células NK |
|
| TNF-ɑ | Monocitos, macrófagos, mastocitos, basófilos, eosinófilos, células NK, células B, células T, fibroblastos, células epiteliales tímicas |
|
| Factor de crecimiento transformador-β | La mayoría de las células | Antiinflamatorio |
Después del reconocimiento de patógenos y el reclutamiento de células inmunitarias (con la ayuda coordinada de complementos y citoquinas), se implementan estrategias para eliminar los microbios.
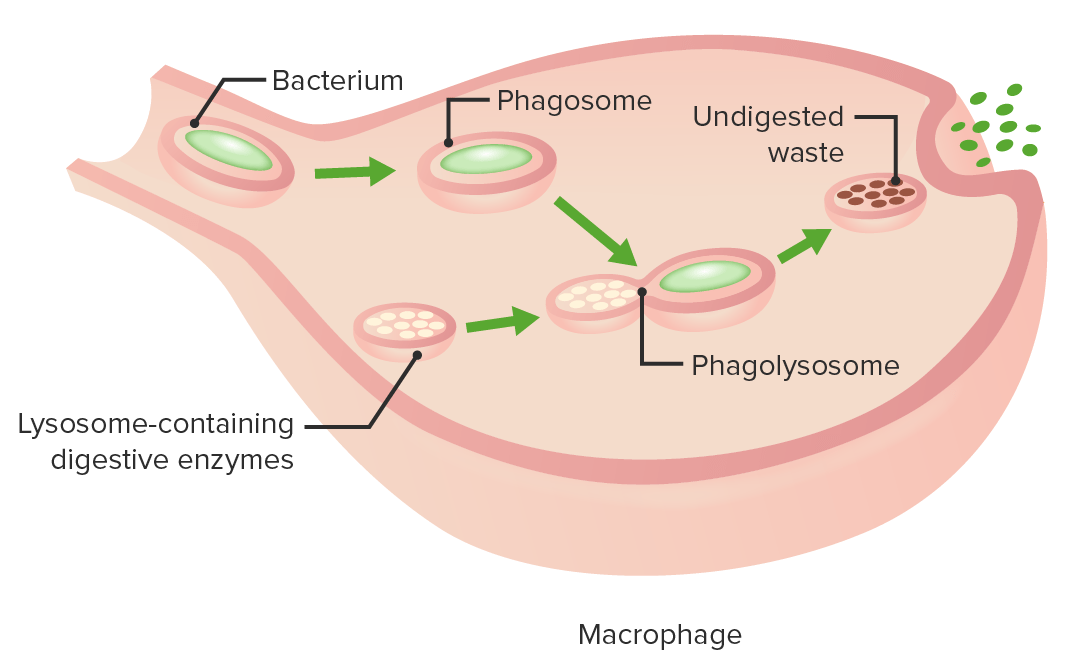
Las etapas de la fagocitosis:
Inmersión de un patógeno, formación de un fagosoma, digestión de la partícula patógena en el fagolisosoma, expulsión de materiales no digeridos de la célula
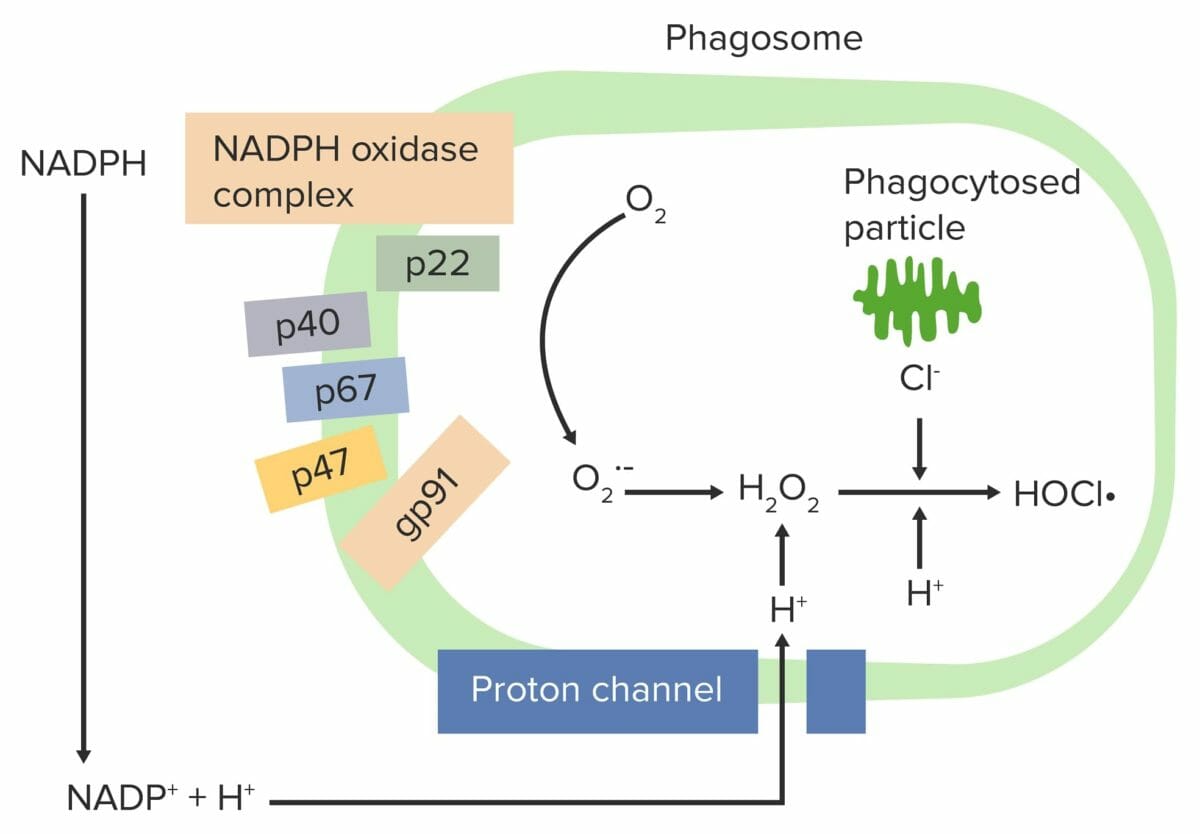
Estallido respiratorio iniciado por el complejo NADPH-oxidasa:
El complejo fagocitario NADPH-oxidasa se activa, reduciendo el O2 a un radical libre de oxígeno (anión superóxido (O2•–)) y luego a H2O2. Los neutrófilos y los monocitos (usando mieloperoxidasa) combinan H2O2 con Cl– para producir hipoclorito (HOCl•), que ayuda a destruir las bacterias.