Las miopatías mitocondriales son afecciones que surgen de la disfunción de las mitocondrias (los organelos productores de energía) y se caracterizan por síntomas musculares prominentes y se acompañan de varios síntomas causados por órganos con altos requerimientos de energía. Los órganos desproporcionadamente afectados incluyen los músculos esqueléticos, el cerebro y el corazón. Las miopatías mitocondriales son causadas por mutaciones en el ADN nuclear o en el ADN mitocondrial, que generalmente resultan en una producción reducida de la energía que necesitan las células. La presentación puede ser una miopatía aislada, encefalomiopatía, oftalmoplejías o una enfermedad multisistémica. El diagnóstico implica antecedentes médicos y familiares detallados, junto con estudios genéticos y de laboratorio. En la biopsia, existe proliferación subsarcolémica e intermiofibrilar de mitocondrias que se observan como “fibras rojas rasgadas”. Esta afección indica una respuesta compensatoria a la falta de energía. No existe un tratamiento definitivo. El tratamiento consiste en fisioterapia y un enfoque multidisciplinario para abordar los síntomas acompañantes.
Última actualización: Abr 24, 2025
Las miopatías mitocondriales son enfermedades que surgen de la disfunción mitocondrial (los organelos productores de energía). Estas enfermedades se caracterizan por síntomas musculares prominentes (como debilidad muscular) y se acompañan de varios síntomas causados por órganos con altos requerimientos de energía.
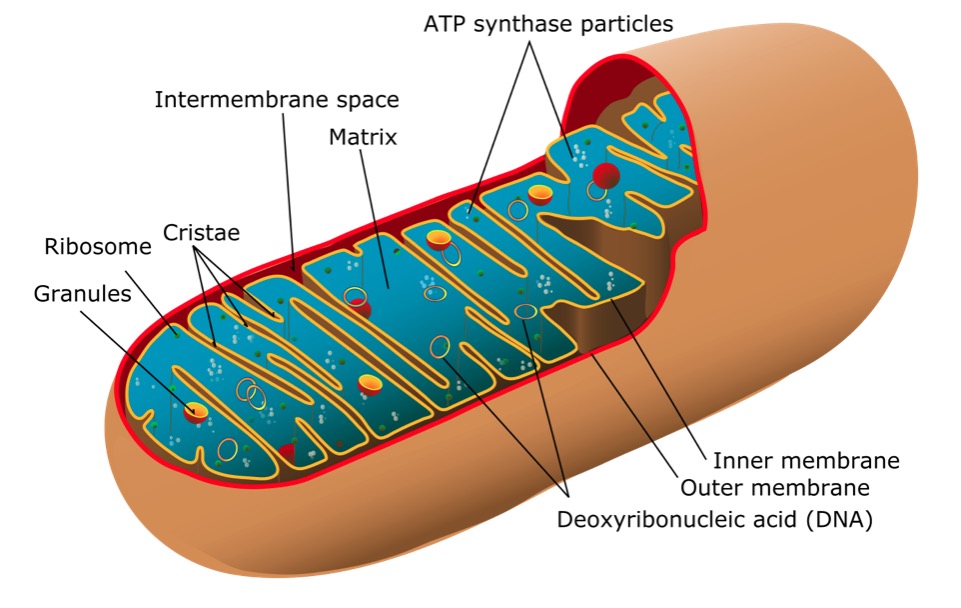
Estructura de una mitocondria
Imagen: “Mitochondrion of the eukaryotic cell” por Mariana Ruiz Villarreal. Licencia: Dominio PúblicoLos signos y síntomas se correlacionan con los órganos o tejidos afectados:

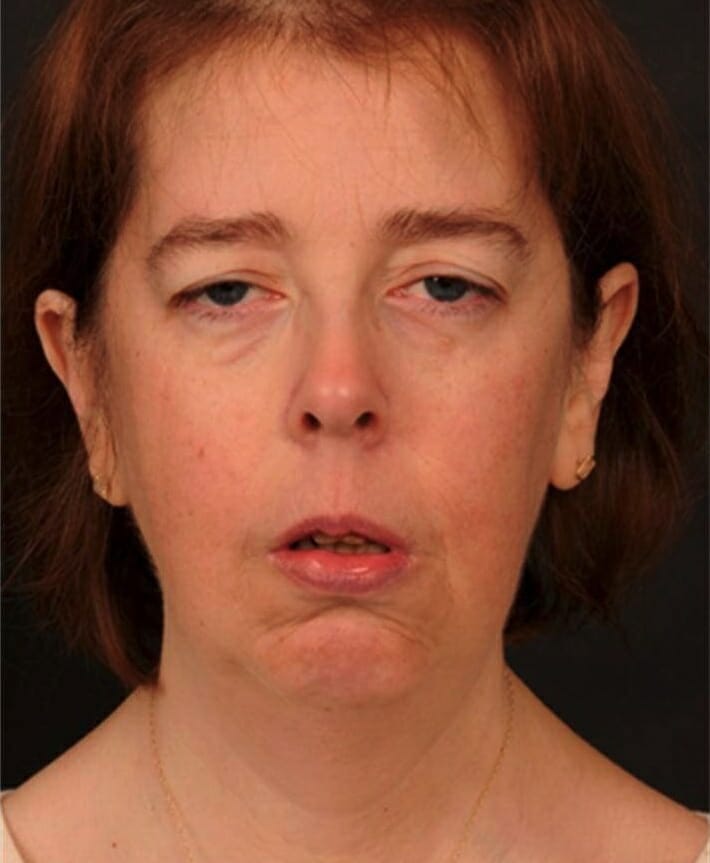
Síndrome de Kearns-Sayre:
Paciente con ptosis bilateral
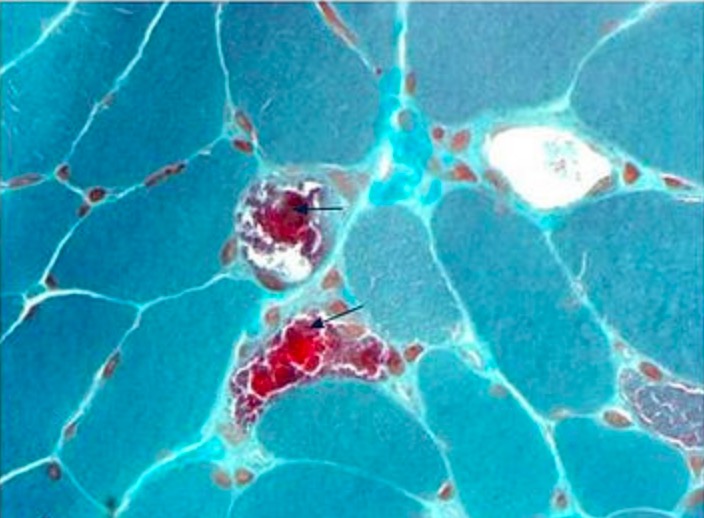
Biopsia muscular en un paciente con características típicas de encefalomiopatía mitocondrial, acidosis láctica y episodios similares a accidentes cerebrovasculares (MELAS):
Tinción tricrómica de Gomori modificada que muestra varias fibras rojas rasgadas (flechas)
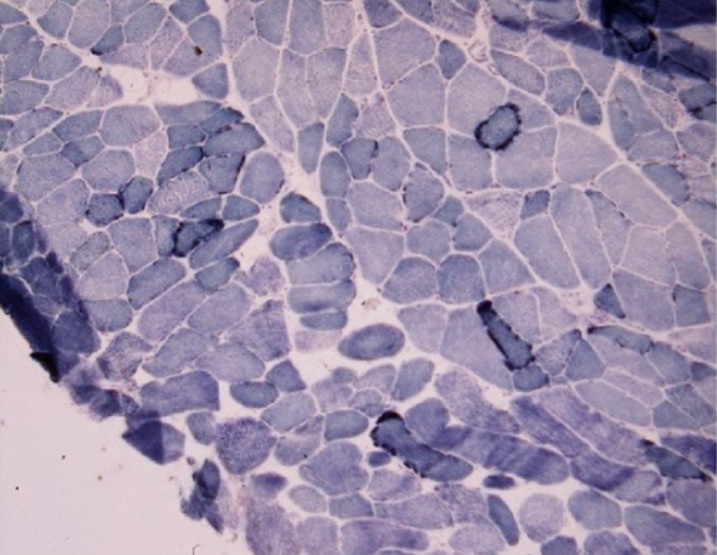
Biopsia muscular de un paciente con mioclonías y deterioro cognitivo progresivo:
Fibras azules rasgadas observadas en la preparación de succinato deshidrogenasa