La miocardiopatía hipertrófica (MCH) es la miocardiopatía hereditaria más frecuente, se caracteriza por un aumento asimétrico del grosor (hipertrofia) de la pared ventricular izquierda, disfunción diastólica y, a menudo, obstrucción del tracto de salida del ventrículo izquierdo. La miocardiopatía hipertrófica está causada por varias mutaciones genéticas que afectan a los componentes contráctiles del corazón, conocidos como sarcómeros. La herencia de la MCH suele ser autosómica dominante, aunque también se producen mutaciones esporádicas. Los pacientes pueden ser asintomáticos, también puede presentar disnea y dolor torácico o sufrir una muerte súbita cardíaca sin síntomas previos. El diagnóstico se realiza a partir del ECG, la ecocardiografía, la prueba de esfuerzo y la resonancia magnética cardíaca. La MCH sintomática suele tratarse con betabloqueadores como tratamiento de 1ra línea. El tratamiento adicional depende de la presencia de obstrucción del tracto de salida del ventrículo izquierdo.
Última actualización: Ene 16, 2024
Aproximadamente 60%–70% de los casos están causados por mutaciones que afectan a las proteínas del miofilamento grueso o fino de los sarcómeros (componentes contráctiles del corazón).
Muchos individuos afectados por la MCH son asintomáticos durante toda su vida. Para algunos, usualmente durante la adolescencia, la muerte súbita cardíaca es el 1er síntoma.
Síntomas:
Antecedentes familiares:
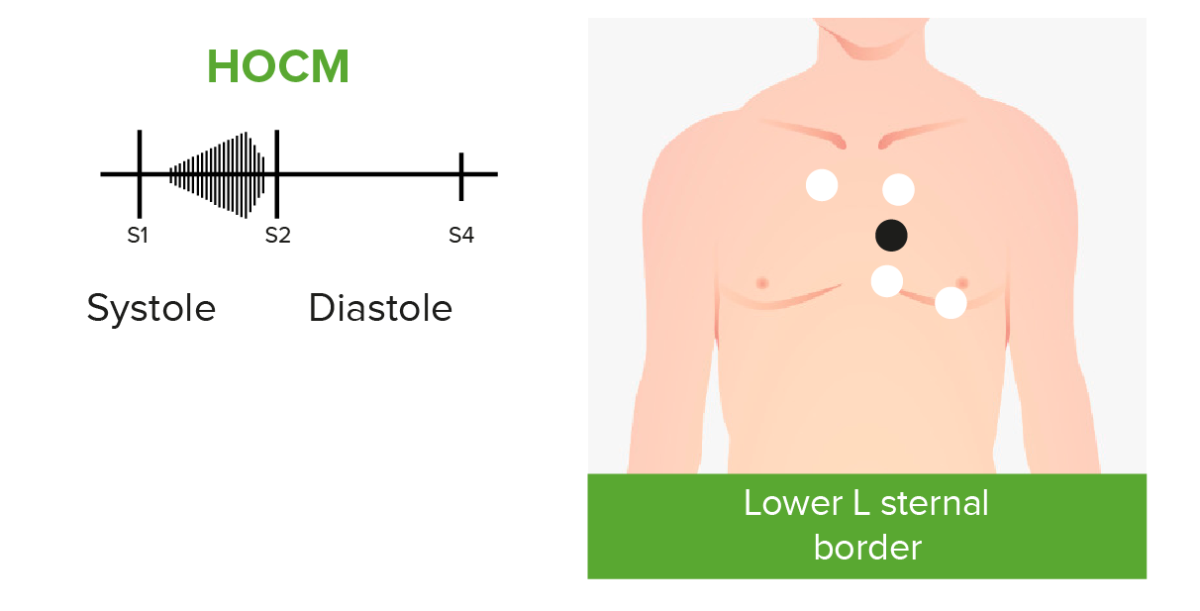
Fonocardiogramas de los ruidos cardíacos anormales causados por la miocardiopatía hipertrófica obstructiva (HOCM, por sus siglas en inglés):
Los pacientes con miocardiopatía hipertrófica obstructiva y obstrucción del tracto de salida del ventrículo izquierdo pueden presentar un soplo sistólico crescendo-decrescendo audible que se escucha mejor en el ápice y en el borde inferior izquierdo del esternón.
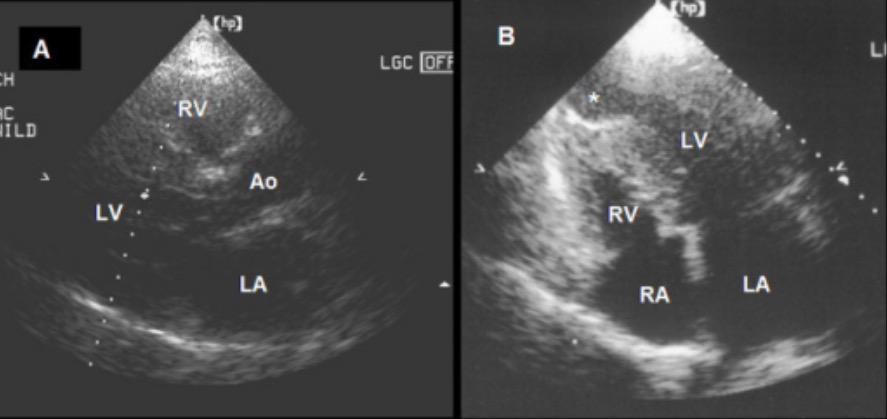
A: Vista de eje largo paraesternal que muestra una miocardiopatía hipertrófica septal asimétrica al final de la diástole
B: Vista de 4 cámaras que muestra una combinación de miocardiopatía hipertrófica basal y media ventricular y un aneurisma apical
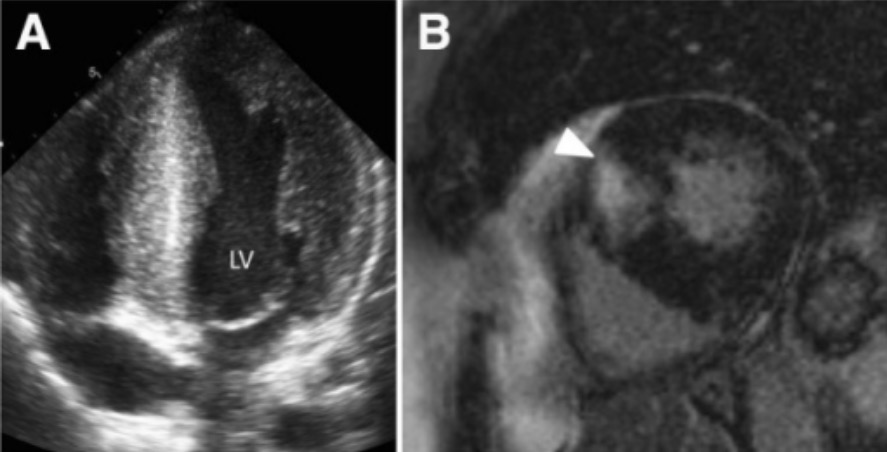
Miocardiopatía hipertrófica: hipertrofia del ventrículo izquierdo con espesor > de 15 mm de las paredes septal y lateral (panel A)
Imagen: “Hypertrophic cardiomyopathy” por Victoria Delgado et al. Licencia: CC BY 4.0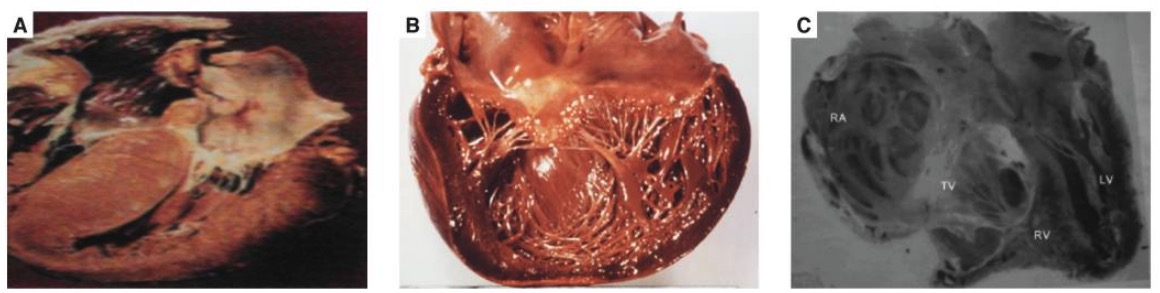
Miocardiopatía hipertrófica
B: Miocardiopatía dilatada
C: Fibrosis endomiocárdica
No se conoce ningún tratamiento con medicamentos que mejore el pronóstico.
Objetivos del tratamiento:
Casos asintomáticos:
En el marco de síntomas de insuficiencia cardíaca sin obstrucción del tracto de salida del ventrículo izquierdo:
En el marco de síntomas de insuficiencia cardíaca y obstrucción del tracto de salida del ventrículo izquierdo: