Los linfocitos T, también llamados células T, son componentes importantes del sistema inmunitario adaptativo. Su producción inicia en las células madre hematopoyéticas de la médula ósea, de las que surgen las células progenitoras de linfocitos T. Estas células migran al timo para seguir madurando. Un linfocito T maduro funcional se desarrolla a partir de un proceso pautado que crea un complejo de receptores de linfocitos T, seleccionando linfocitos T con la afinidad adecuada a los autoantígenos asociados a las principales moléculas de histocompatibilidad (selección positiva) y expresando CD4 o CD8. En este proceso, las células predispuestas a la autoinmunidad sufren apoptosis (selección negativa). Cuando se liberan del timo, los linfocitos T maduros vírgenes se desplazan a los órganos linfoides secundarios para su activación. Se requieren dos señales, una unión del antígeno específico del receptor de linfocitos T y la coestimulación, para que esté activado (listo para organizar una respuesta inmune). En el caso de los linfocitos T CD8+, es necesaria una estimulación adicional con citoquinas. Dependiendo de las citoquinas a las que se exponen durante la estimulación antigénica, los linfocitos T maduros indiferenciados (Th0, por sus siglas en inglés) se convierten en células con diferentes funciones: los CD4+ se convierten en linfocitos T colaboradores (Th, por sus siglas en inglés) y los CD8+ en linfocitos citotóxicos o citolíticos. Los linfocitos Th tienen otros subtipos; los más caracterizados son Th1, Th2, Th17, linfocitos Th foliculares y linfocitos T reguladores. Otros tipos son los linfocitos T asesinos naturales y los linfocitos T de memoria. Estos linfocitos T maduros y diferenciados garantizan una vigilancia efectiva y una respuesta inmediata a agentes patógenos, células tumorales y tejidos extraños, y proporcionan memoria inmunológica.
Última actualización: Ago 2, 2022
El proceso inicial tiene lugar en la corteza externa del timo, y las células se desplazan a la corteza más profunda a medida que maduran.
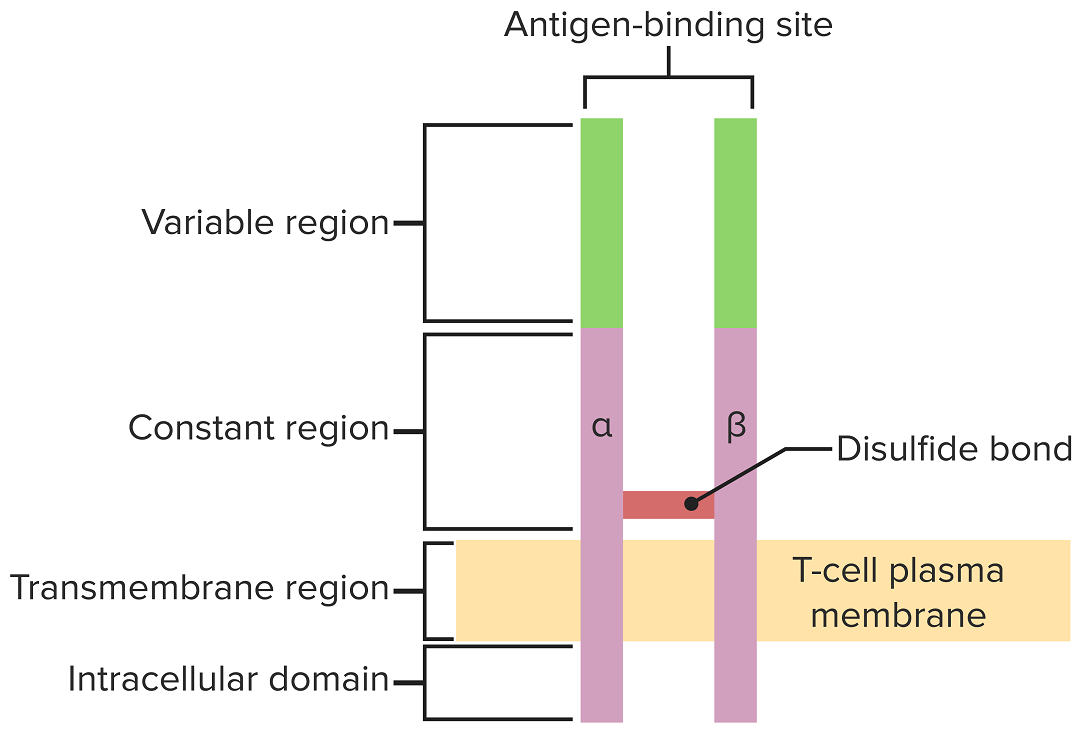
El receptor de linfocitos T se extiende por la membrana citoplasmática y proyecta regiones de unión variables en el espacio extracelular para unirse a antígenos procesados asociados a moléculas CMH I o CMH II.
Imagen por Lecturio.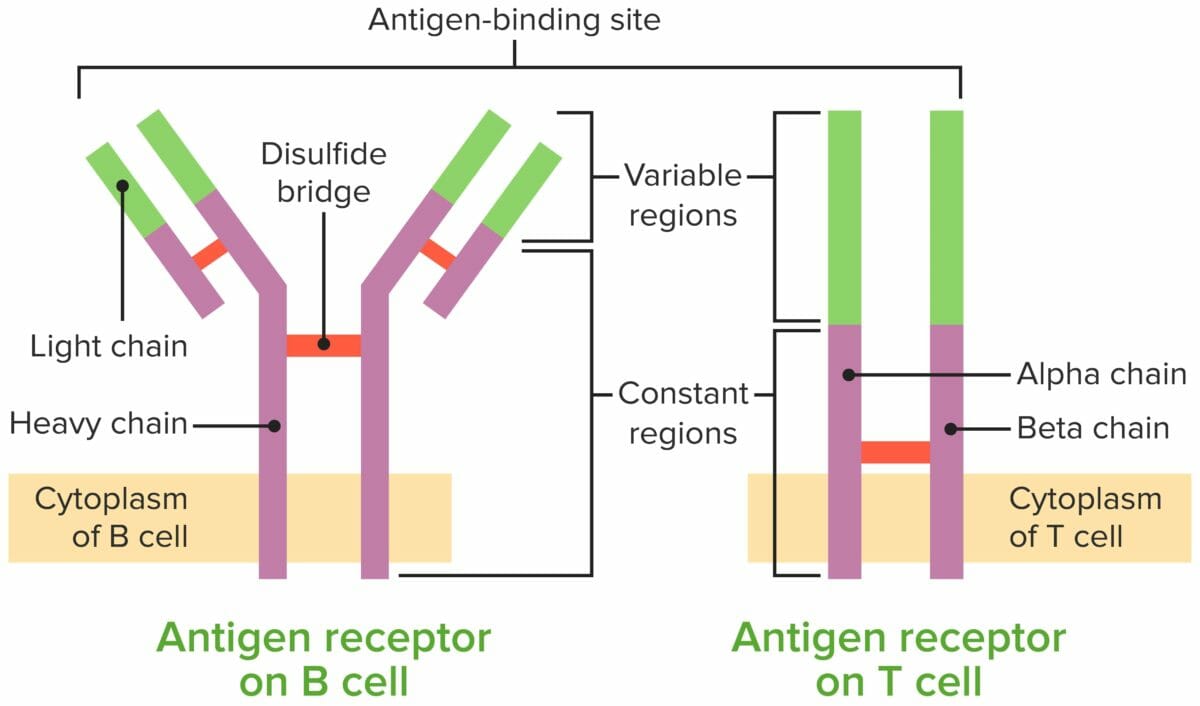
Comparación del receptor de linfocitos B y del receptor de linfocitos T
Imagen por Lecturio.Para alcanzar la funcionalidad, el linfocito T pasa por estadios, liberándose de la médula ósea como células progenitoras para continuar su desarrollo en el timo. El cuadro resume los principales pasos.
| Estadios de maduración | Receptor de linfocitos T | Eventos asociados |
|---|---|---|
| Célula progenitora | Ninguno |
|
| Células DN | Reordenamiento de la cadena β (pre-receptor de linfocitos T): la falta de reordenamiento conduce a apoptosis |
|
| Células DP | Reordenamiento de la cadena ɑ → las cadenas ɑ se ensamblan con las cadenas β → complejo de receptor de linfocitos T-CD3 ɑ-β completo (expresado en la superficie) |
|
| Linfocitos T simple positivos |
|
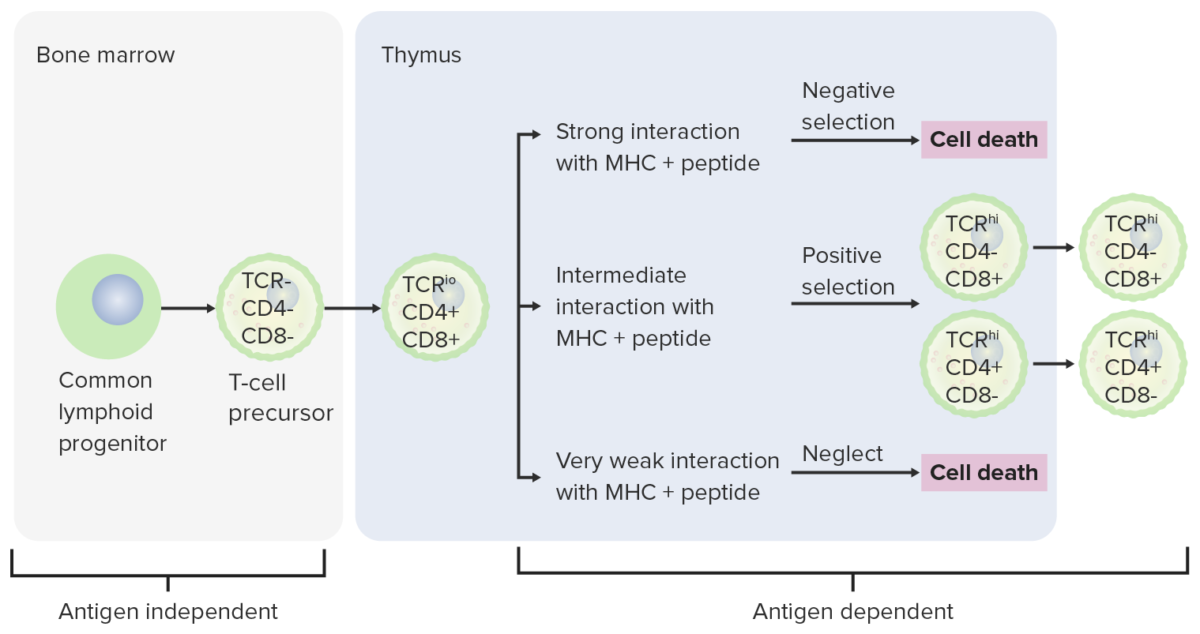
Estadios de diferenciación de los linfocitos T:
Desde la médula ósea, las células progenitoras pasan al timo para su posterior maduración. Las células DN (sin expresión de CD4/CD8 o CD4-/CD8-) no han desarrollado el receptor de linfocitos T. Las células DN experimentan un reordenamiento del gen del receptor de linfocitos T y se convierten en prolinfocitos T y luego en prelinfocitos T. A través del proceso, se expresan CD4 y CD8, y el receptor de linfocitos T se ensambla a través de reordenamientos genéticos (células DP). El timo presenta entonces moléculas CMH a los linfocitos T en desarrollo. Algunas células experimentan selección positiva (se produce una interacción intermedia entre el CMH y el receptor de linfocitos T) y producen células funcionales. Algunas células experimentan selección negativa (fuerte interacción entre el CMH y el receptor de linfocitos T), lo que provoca la muerte celular. Se evita la liberación de linfocitos T disfuncionales, que pueden activar la autoinmunidad. Algunos linfocitos T no logran interactuar, lo que conduce a la apoptosis. Los linfocitos T maduros expresan CD4 (linfocitos T colaboradores) o CD8 (linfocitos T citotóxicos), pero no ambos.
Recuerde la «regla del 8»:
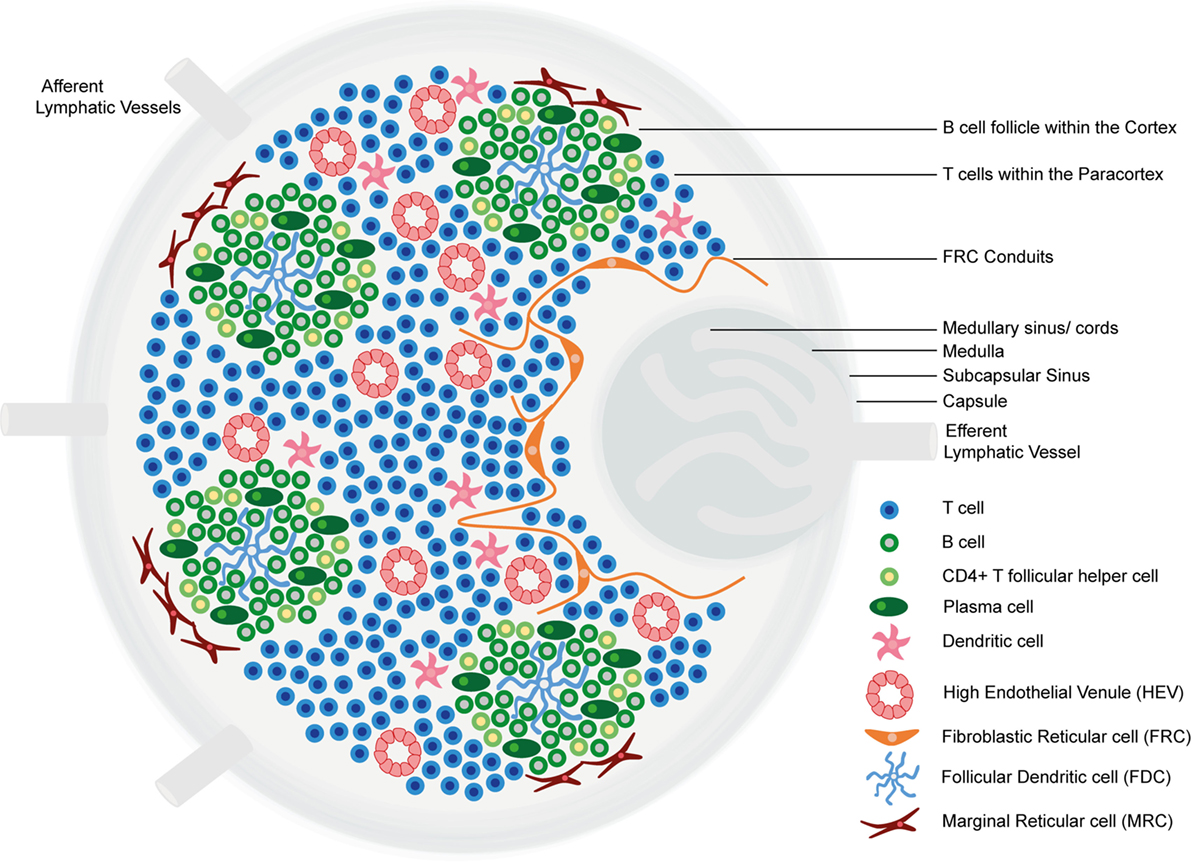
Estructura y regiones funcionales de un ganglio linfático que consta de una cápsula fibrosa rica en colágeno y un seno subcapsular subyacente.
Las células se segregan en (1) la corteza (que consiste en linfocitos B, linfocitos T colaboradores foliculares y células dendríticas foliculares dispuestas en folículos primarios, en los que los linfocitos B examinan los antígenos presentados en la red estromal de células dendríticas foliculares); y en (2) la paracorteza (que aloja a linfocitos T, células dendríticas y células reticulares fibroblásticas, que forman redes de células estromales y fibras reticulares).
La médula interna está compuesta por tejidos linfáticos (cordones medulares) separados por senos medulares compuestos por linfa.
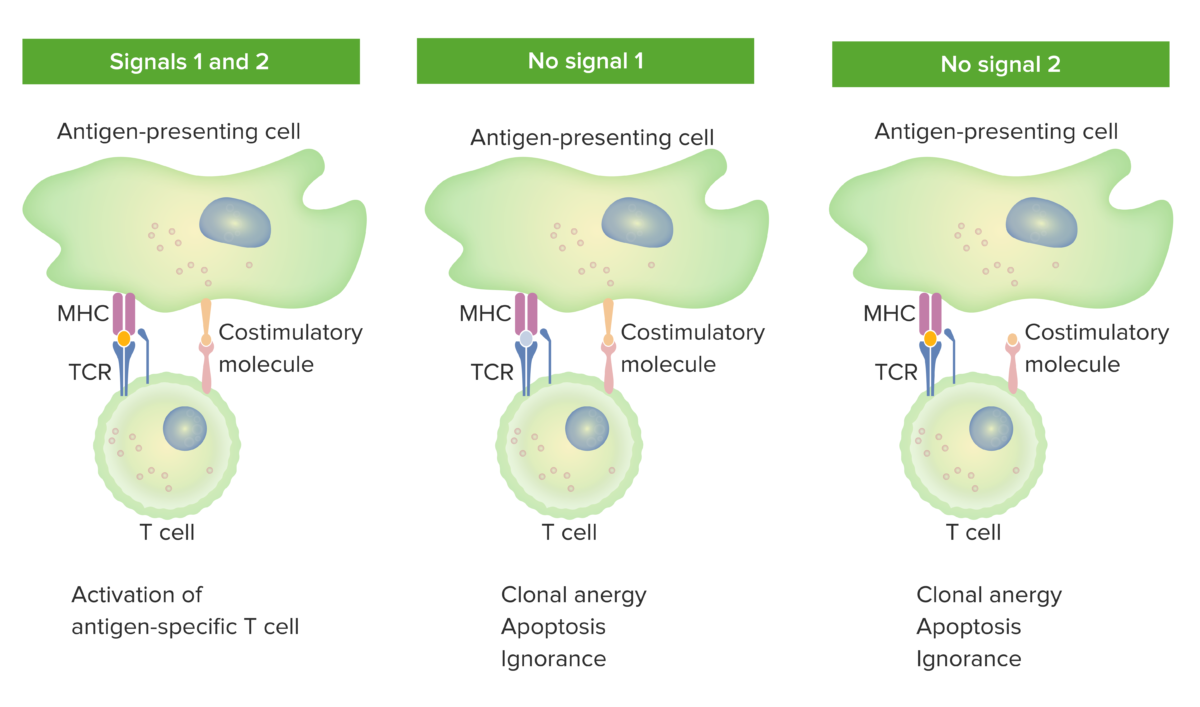
Modelo de 2 señales de la dependencia de los linfocitos T de la coestimulación:
Cuando están presentes tanto la señal 1 (unión del receptor de linfocitos T con el antígeno afín presentado por la molécula del CMH en la célula presentadora del antígeno) como la señal 2 (interacción de la molécula coestimuladora entre la célula presentadora del antígeno y el linfocito T), el linfocito T maduro está totalmente activado.
El punto naranja en el panel de la izquierda indica la unión adecuada entre el antígeno y el receptor de linfocitos T. Sin embargo, cuando falta la señal 1 (la imagen del medio muestra la ausencia de la unión entre el antígeno y el receptor de linfocitos T) o la señal 2 (la imagen de la derecha muestra la ausencia de coestimulación), el linfocito T no se activará completamente.
Los resultados serían anergia (falta de respuesta), apoptosis (muerte celular) o ignorancia (el linfocito T no se da cuenta o no se ve afectado por el antígeno).
Los linfocitos T colaboradores tienen diferentes perfiles de citoquinas y funciones en la respuesta inmune.
| Linfocitos T CD4+ | Diferenciación estimulada por | Funciones | Citoquinas producidas |
|---|---|---|---|
| Th1 |
|
|
|
| Th2 |
|
|
|
| Th17 |
|
Promover la inflamación neutrofílica |
|
| Tfh | IL-6 | Facilitar la activación y maduración de linfocitos B |
|
| Treg |
|
|
|
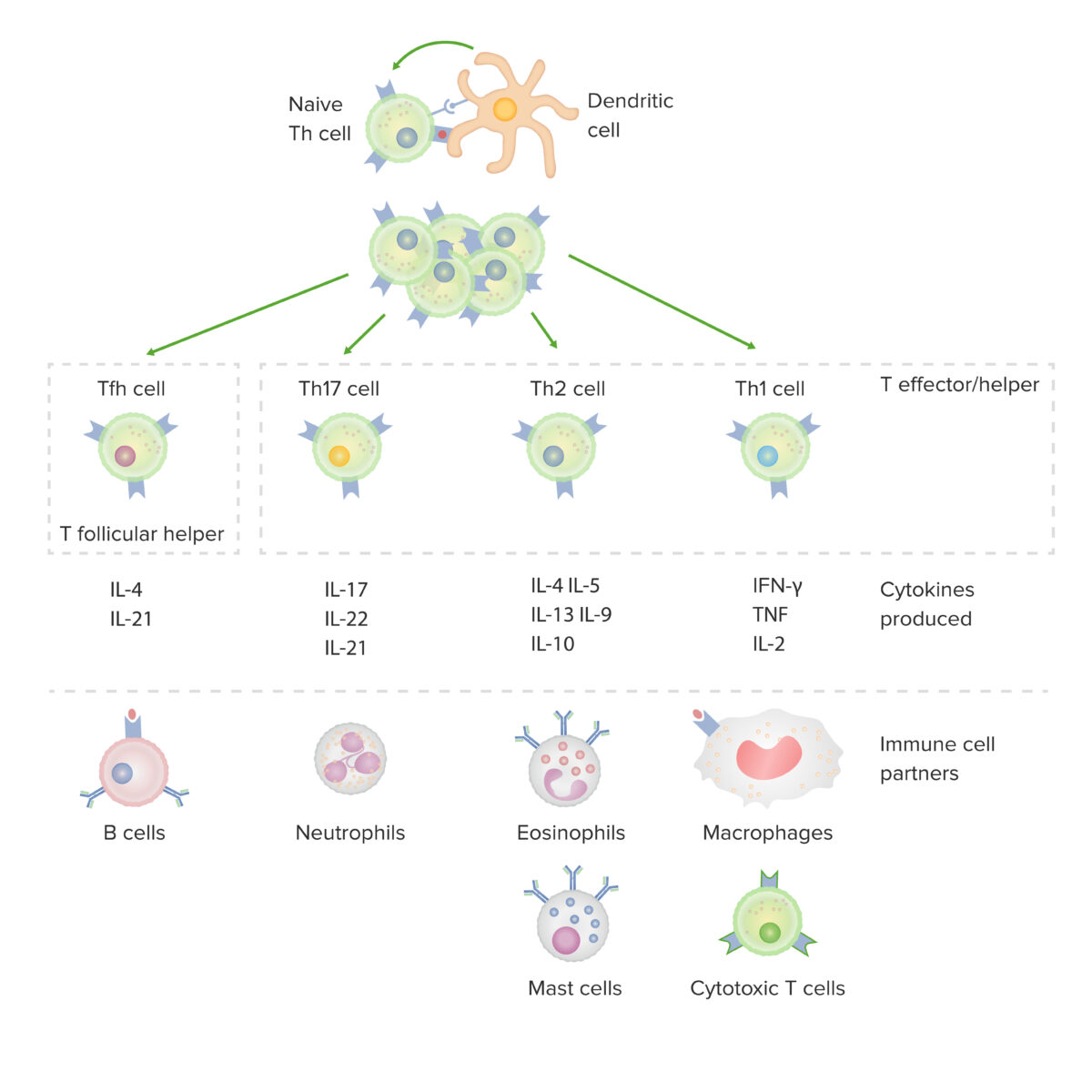
Subconjuntos de linfocitos T colaboradores CD4-positivos:
Tras la activación por parte de una célula dendrítica, en presencia de determinadas citoquinas, un linfocito T CD4-positivo virgen se divide y se diferencia en subconjuntos efector/colaborador (Th1, Th2 o Th17) o colaborador folicular (Tfh). Cada tipo de célula produce citoquinas que facilitan la activación de otras células inmunitarias.
IFN: interferón
TNF: factor de necrosis tumoral (en inglés)
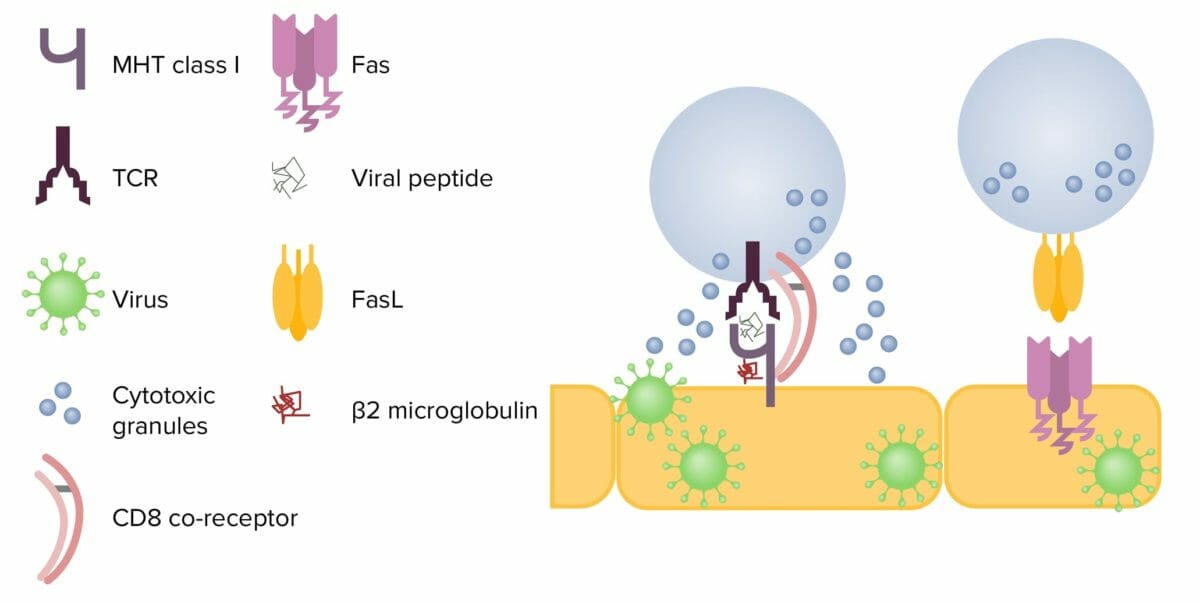
Mecanismos de citotoxicidad de las células T CD8+:
Izquierda: Tras entrar en contacto con una célula infectada, la célula T libera gránulos citotóxicos, perforina y granzimas. La perforina crea un poro en la membrana de la célula objetivo, permitiendo que las granzimas entren en la célula. Éstas escinden las proteínas dentro de la célula, lo que finalmente provoca la apoptosis.
A la derecha: Cuando FasL interactúa con Fas en una célula diana, se activa la cascada de caspasas y se produce la apoptosis.
FasL: ligando de Fas
TCR: receptor de células T
MHC: complejo mayor de histocompatibilidad
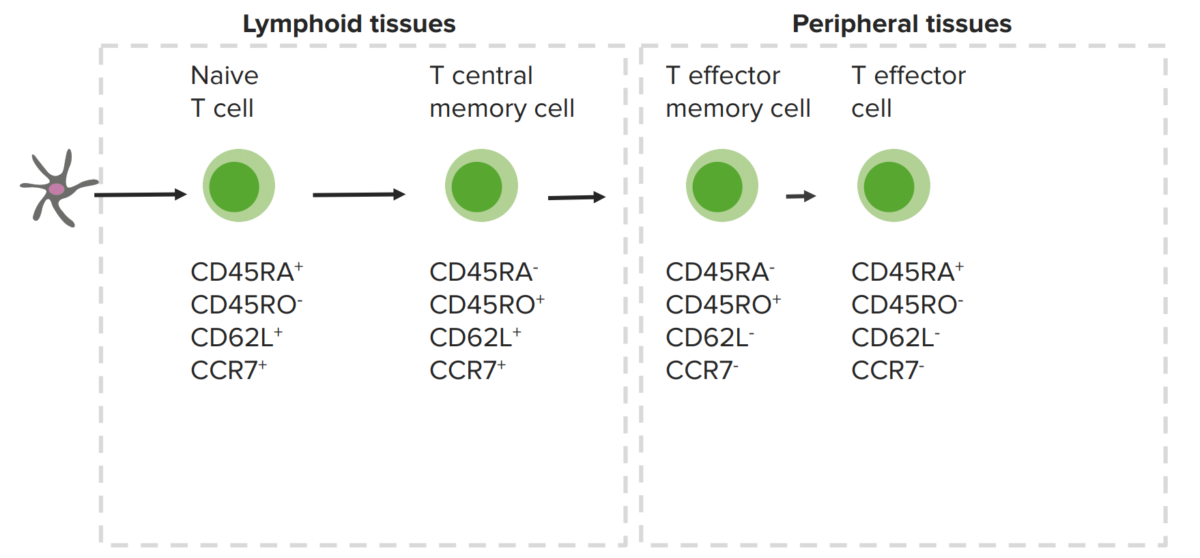
Linfocitos T de memoria y marcadores celulares expresados:
Los linfocitos T de memoria centrales están en los órganos linfoides, mientras que los linfocitos T de memoria periféricos están en los tejidos periféricos.