La leucemia/linfoma linfoblástico agudo son neoplasias malignas hematológicas caracterizadas por la proliferación descontrolada de células precursoras linfoides. La leucemia/linfoma linfoblástico agudo, son las formas más comunes de cáncer que afectan a los niños, muestran la presencia de un aumento de linfoblastos. En la leucemia/linfoma linfoblástico agudo, los linfoblastos reemplazan la médula ósea normal, eventualmente ingresan a la circulación e infiltran otros órganos. La presentación clínica incluye fatiga, hemorragia, fiebre e infecciones, todas ellas relacionadas con anemia, trombocitopenia y falta de leucocitos funcionales. La aparición de los síntomas tardan días o semanas. Los efectos de masa de la infiltración maligna (en hueso, hígado, bazo) son comunes; por tanto, se observan hepatoesplenomegalia y linfadenopatía. El diagnóstico se realiza mediante frotis de sangre periférica y biopsia de médula ósea, que muestran la presencia de linfoblastos. Los estudios de inmunofenotipificación, histoquímica y genética ayudan en la clasificación y orientación del tratamiento. El tratamiento es principalmente por quimioterapia, la cual se administra en fases (inducción, consolidación y mantenimiento). El pronóstico varía según la edad de aparición y el tipo de leucemia. La tasa de curación en niños es del 85%.
Última actualización: Abr 14, 2022
La leucemia/linfoma linfoblástico agudo son neoplasias malignas hematológicas caracterizadas por la proliferación patológica de células precursoras linfoides (principalmente los linajes de células B y T)
en la médula ósea, con el desplazamiento posterior de otros precursores de células sanguíneas.
Sistema de la World Health Organization (WHO) 2016 (reemplaza la clasificación franco-estadounidense-británica):
La hematopoyesis comienza con una célula madre hematopoyética, que se incita a dividirse y diferenciarse con estímulos químicos apropiados (factores de crecimiento hematopoyéticos).
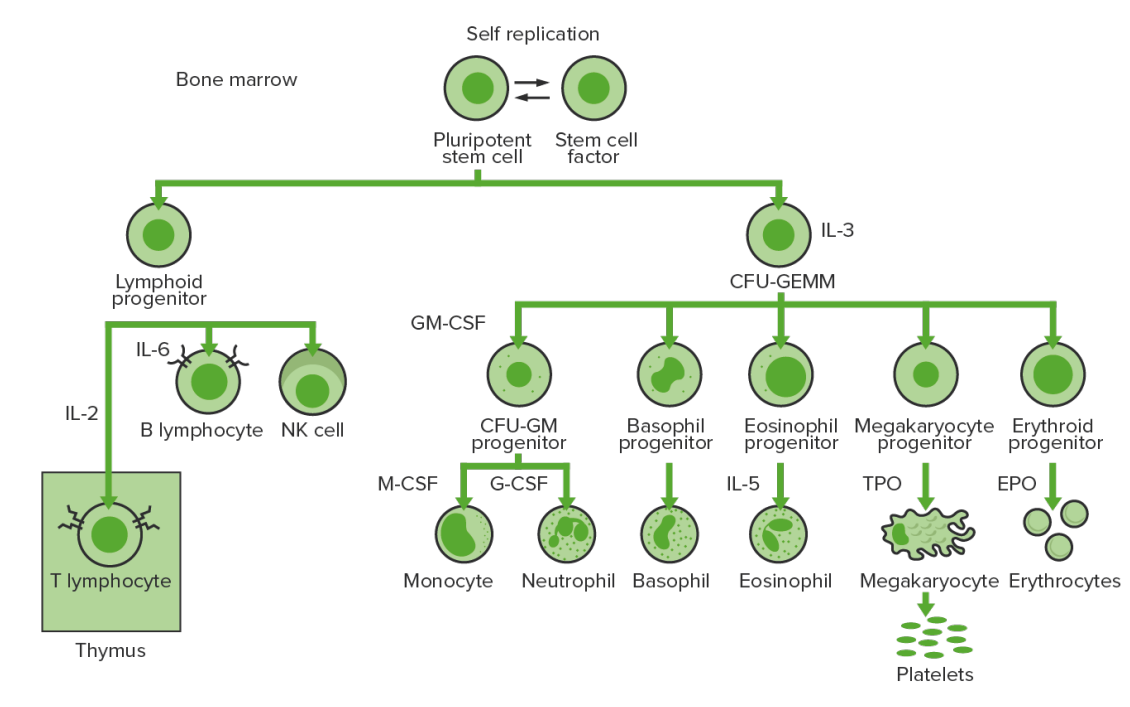
Hematopoyesis de la médula ósea:
Proliferación y diferenciación de los elementos formes de la sangre:
En la leucemia mieloide crónica, existe una proliferación sostenida de células en la línea granulocítica (mieloblastos → neutrófilos, basófilos, eosinófilos). Se ven tanto células en proceso de maduración como céulas maduras; por lo tanto, hay células que son solo parcialmente efectivas.
CFU-GEMM: unidad formadora de colonias de granulocitos, eritrocitos, monocitos, megacariocitos
CFU-GM: unidad formadora de colonias de macrófagos y granulocitos
GM-CSF: factor estimulante de colonias de granulocitos y macrófagos
M-CSF: factor estimulante de colonias de macrófagos
G-CSF: factor estimulante de colonias de granulocitos
NK: células asesinas naturales
TPO: trombopoyetina
| Características | Leucemia linfoblástica aguda | Leucemia mieloide aguda |
|---|---|---|
| Población | Más común en niños | Más común en adultos |
| Características comunes |
|
|
| Hallazgos clínicos |
|
|
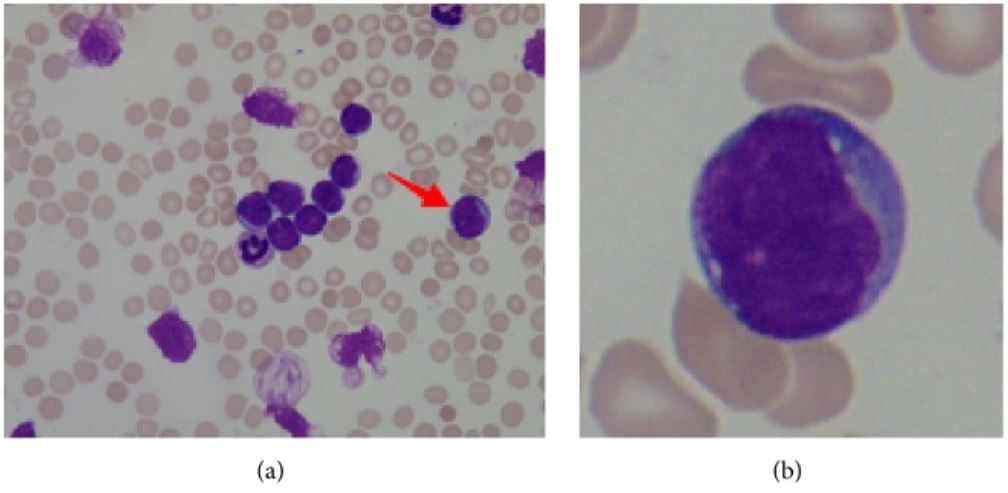
a: frotis de médula ósea de un paciente con leucemia linfoblástica aguda, flecha que apunta a linfoblasto
b: linfoblasto: núcleo grande, citoplasma escaso
| Características | Leucemia linfoblástica aguda | Leucemia mieloide aguda |
|---|---|---|
| Hallazgos de laboratorio | Anemia, trombocitopenia, variación en los leucocitos | |
| Frotis periférico o examen de médula ósea (morfología) | Linfoblastos:
|
Mieloblastos:
|
| Citoquímica |
|
|
| Inmunofenotipificación |
|
CD13, CD33, CD117, HLA-DR |
La quimioterapia, que puede durar de 2–3 años, es muy eficaz en pacientes jóvenes.
| Tratamiento | Leucemia linfoblástica aguda | Leucemia mieloide aguda |
|---|---|---|
| Inducción |
|
|
| Consolidación | Opciones:
|
Quimioterapia adicional (citarabina) |
| Mantenimiento |
|
Quimioterapia no mielosupresora y/o agente dirigido |
| Tratamiento adicional |
|
Leucemia promielocítica aguda:
|
| Trasplante de células hematopoyéticas | Para pacientes con mal pronóstico | |
| Pronóstico |
|
|