La hemoglobinuria paroxística nocturna (HPN) es una anemia hemolítica adquirida, rara, pero grave, con exacerbaciones periódicas. Esta anemia es causada por una expansión clonal no maligna de ≥ 1 células madre hematopoyéticas que han adquirido una mutación somática del gen de la subunidad A de la fosfatidilinositol N-acetilglucosaminiltransferasa (PIG-A). La expansión clonal de las células madre afectadas son deficientes en proteínas ancladas a glicosilfosfatidilinositol. La deficiencia de las proteínas ancladas a glucosilfosfatidilinositol, CD55 y CD59, que regulan el complemento, provocan hemólisis intravascular. La tríada clásica de la HPN es anemia hemolítica, insuficiencia medular y trombofilia. Los pacientes pueden ser tratados con el anticuerpo monoclonal eculizumab o con un trasplante de células madre, además de ser tratados por las complicaciones asociadas.
Última actualización: Abr 13, 2022
Hemoglobinuria paroxística nocturna (HPN) clásica:
HPN en el marco de un trastorno específico de la médula ósea:
HPN subclínica:
Gen PIG-A (fisiología normal):
Gen PIG-A (mutación):
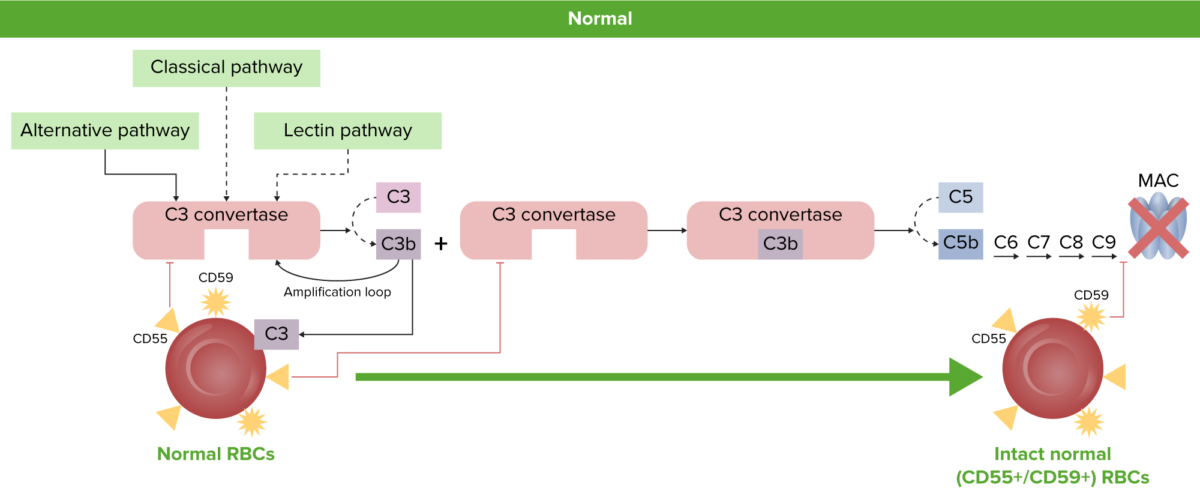
Fisiología normal de los eritrocitos:
Los eritrocitos normales están protegidos de la activación del complemento y de la hemólisis por las proteínas reguladoras del complemento ancladas a GPI, CD55 y CD59.
GPI: glucosilfosfatidilinositol
MAC: complejo de ataque a la membrana
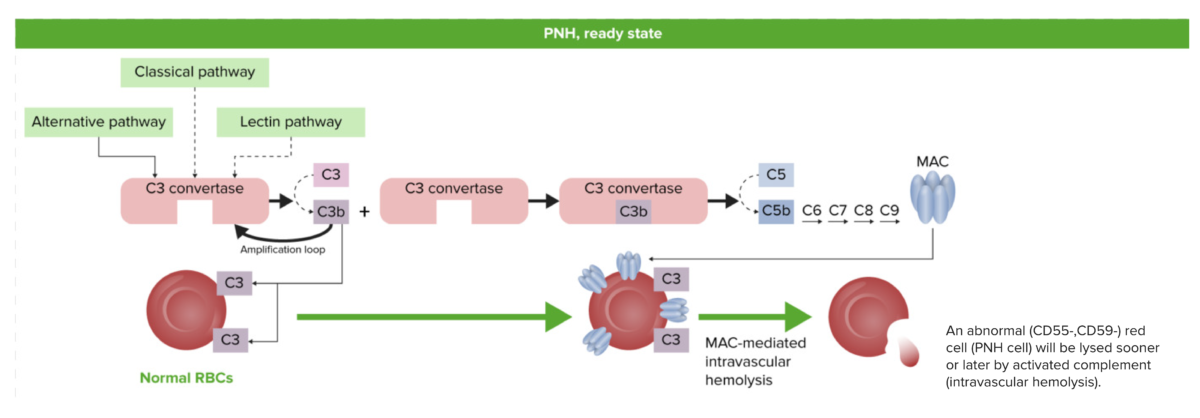
Fisiología de la hemoglobinuria paroxística nocturna (HPN) en estado estacionario:
Incluso en ausencia de inflamación, infección u otro desencadenante, los eritrocitos con GPI reducido o inexistente en su superficie, son susceptibles de ser atacados por el complemento mediante la activación espontánea del mismo a partir de una cantidad trivial, pero constantemente presente de C3 activado (el “ralentí de C3”). La hemólisis intravascular se produce debido a la formación de un complejo de ataque a la membrana (MAC, por sus siglas en inglés), que provoca una alteración focal y agujeros en la membrana. Si se activa complemento adicional a través de la vía clásica antígeno-anticuerpo, (por ejemplo, por una infección), la hemólisis aumentará; esto corresponde a exacerbación paroxística de la enfermedad.
GPI: glucosilfosfatidilinositol

Muestra de orina de un paciente con HPN (izquierda) y de un control sano (derecha).
La orina del paciente es roja debido a la hemólisis intravascular con hemoglobinuria. La hemólisis se produce durante todo el día, no solo por la noche.
Los neutrófilos también presentan una deficiencia de proteínas ancladas a glucosilfosfatidilinositol:
Los factores mediados por plaquetas incluyen:
La trombosis en sitios inusuales (venas hepáticas, mesentéricas, cerebrales, cutáneas) es típica de la HPN.
La insuficiencia renal es progresiva y multifactorial.
Las exacerbaciones de la hemólisis pueden deberse a:
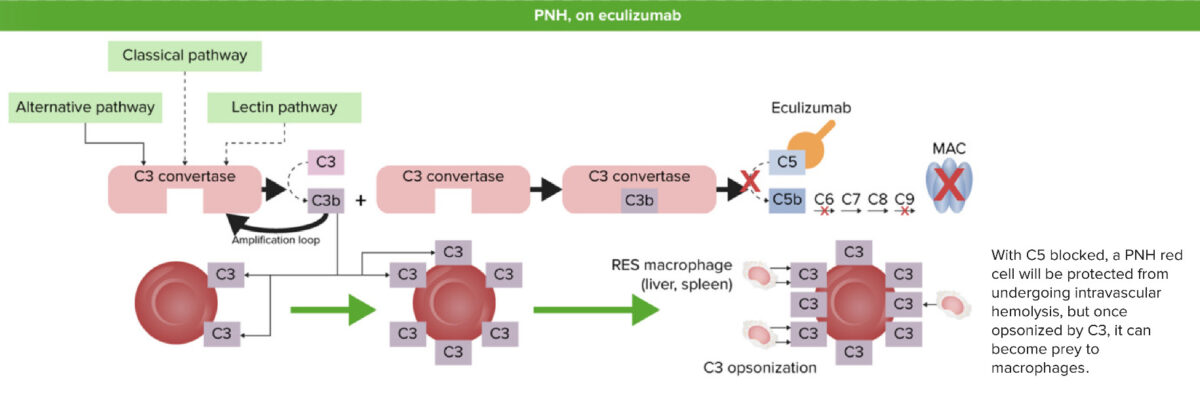
Hemoglobinuria paroxística nocturna tras recibir eculizumab:
Cuando C5 está bloqueado (inhibido) por el eculizumab, la convertasa C5 no puede formar C5b a partir de la escisión de C5. No se forma el complejo de ataque a la membrana (MAC) y no se produce hemólisis intravascular. Sin embargo, los fragmentos de C3 liberados anteriormente en el proceso de activación recubrirán los eritrocitos desprotegidos y provocarán hemólisis extravascular por parte del sistema reticuloendotelial en el hígado y el bazo.
Estos síntomas se deben a la disminución del NO circulante: