Las hemofilias son un grupo de trastornos hereditarios, o a veces adquiridos, de la hemostasia secundaria debido a deficiencia de factores de coagulación específicos. La hemofilia A es una deficiencia del factor VIII, la hemofilia B una deficiencia del factor IX, y la hemofilia C una deficiencia del factor XI. Los pacientes presentan eventos hemorrágicos que pueden ser espontáneos o estar asociados a un traumatismo menor o mayor. El tratamiento se centra principalmente en tratar los eventos hemorrágicos agudos y en la prevención de los eventos hemorrágicos mediante la sustitución de los factores deficientes.
Última actualización: Ene 21, 2023
Las hemofilias son un grupo de trastornos de la hemostasia secundaria debidos a la deficiencia de factores de coagulación específicos.
En Estados Unidos nacen unos 400 niños al año con hemofilia.
Se han descrito 3 tipos diferentes:
Mutación genética que resulta en una deficiencia de factores de coagulación:
Hemofilia adquirida:
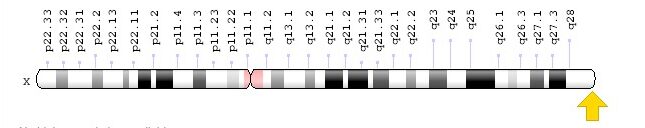
Localización del gen F8 para el factor VIII de coagulación: Xq28, que da lugar a la hemofilia A
Imagen: “F8 gene location” por Genome Decoration Page/NCBI. Licencia: Dominio Público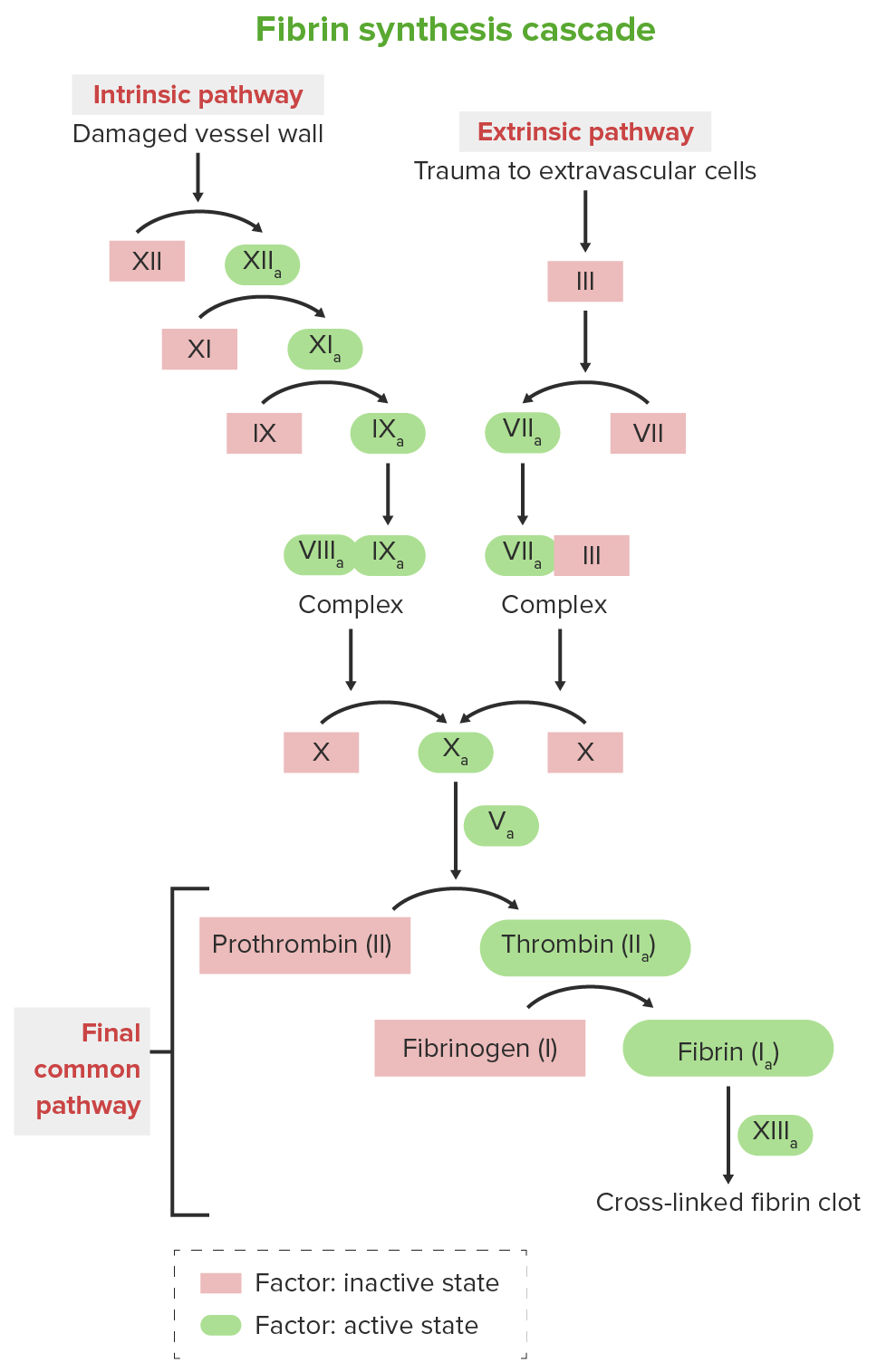
Cascada de la coagulación
Imagen por Lecturio.La presentación se basa principalmente en la gravedad de la deficiencia del factor.
Deficiencia leve a moderada:
Deficiencia más severa:
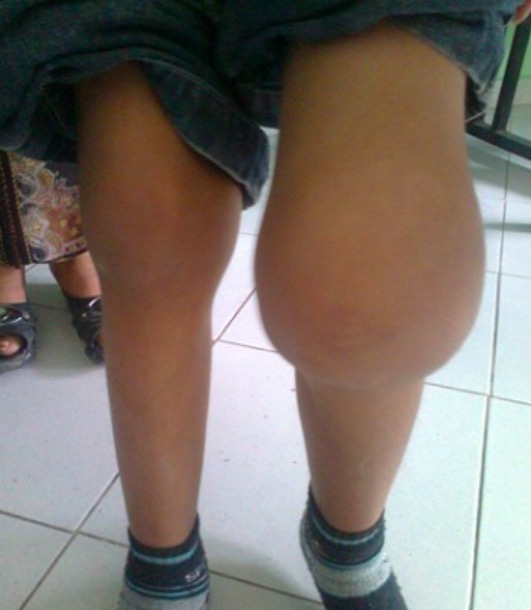
Hemartrosis en un niño de 6 años
Imagen: “ Hémarthrose” por Service de Pédiatrie, Hôpital Al Farabi, CHU Mohamed VI, Université Mohamed I, Oujda, Maroc. Licencia: CC BY 2.0
Hematoma/equimosis subcutánea extensa de las extremidades, el tórax y el abdomen en un paciente con hemofilia
Imagen: “Extensive subcutaneous ecchymoses” por Arthur Bloom Hemophilia Centre, School of Medicine, Cardiff University, University Hospital of Wales, Cardiff, CF14 4XN, UK. Licencia: CC BY 2.0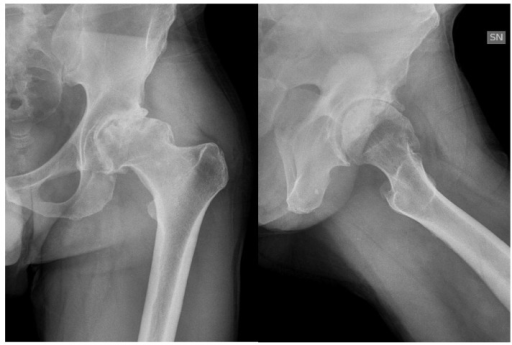
Artropatía de la cadera en la hemofilia: artropatía sintomática de la cadera izquierda secundaria a un pinzamiento femoroacetabular en un individuo de 46 años afectado por hemofilia A grave con inhibidores
Imagen: “jcm-06-00044-f001” por Christian Carulli, Anna Rosa Rizzo, Massimo Innocenti. Licencia: CC BY 4.0El diagnóstico de la hemofilia se hace sobre la base de la sospecha clínica (generalmente debido a un evento hemorrágico) seguida de la demostración de niveles deficientes de un factor (< 40%).