Las estatinas son inhibidores competitivos de la HMG-CoA reductasa en el hígado. La HMG-CoA reductasa es el paso limitante en la síntesis de colesterol. La inhibición da como resultado una menor formación de colesterol intrahepatocítico, lo que da como resultado una regulación positiva de los receptores de lipoproteína de baja densidad (LDL, por sus siglas en inglés) y, en última instancia, una disminución de los niveles séricos de LDL y triglicéridos. Las estatinas pueden reducir el LDL en un 20%–60% (dependiendo de su intensidad) y tienen beneficios que son independientes del colesterol (e.g., reducción de la inflamación vascular y estabilización de la placa aterosclerótica). Las indicaciones para la prescripción de estatinas incluyen la prevención de enfermedades cardiovasculares primarias o secundarias en pacientes con dislipidemia. Los principales efectos secundarios son la transaminitis y la toxicidad muscular.
Última actualización: Mar 27, 2025
Las estatinas son inhibidores competitivos de la enzima HMG-CoA reductasa, la cual es el paso limitante de la biosíntesis de colesterol en el hígado.
Las estatinas son análogos estructurales de la HMG-CoA.
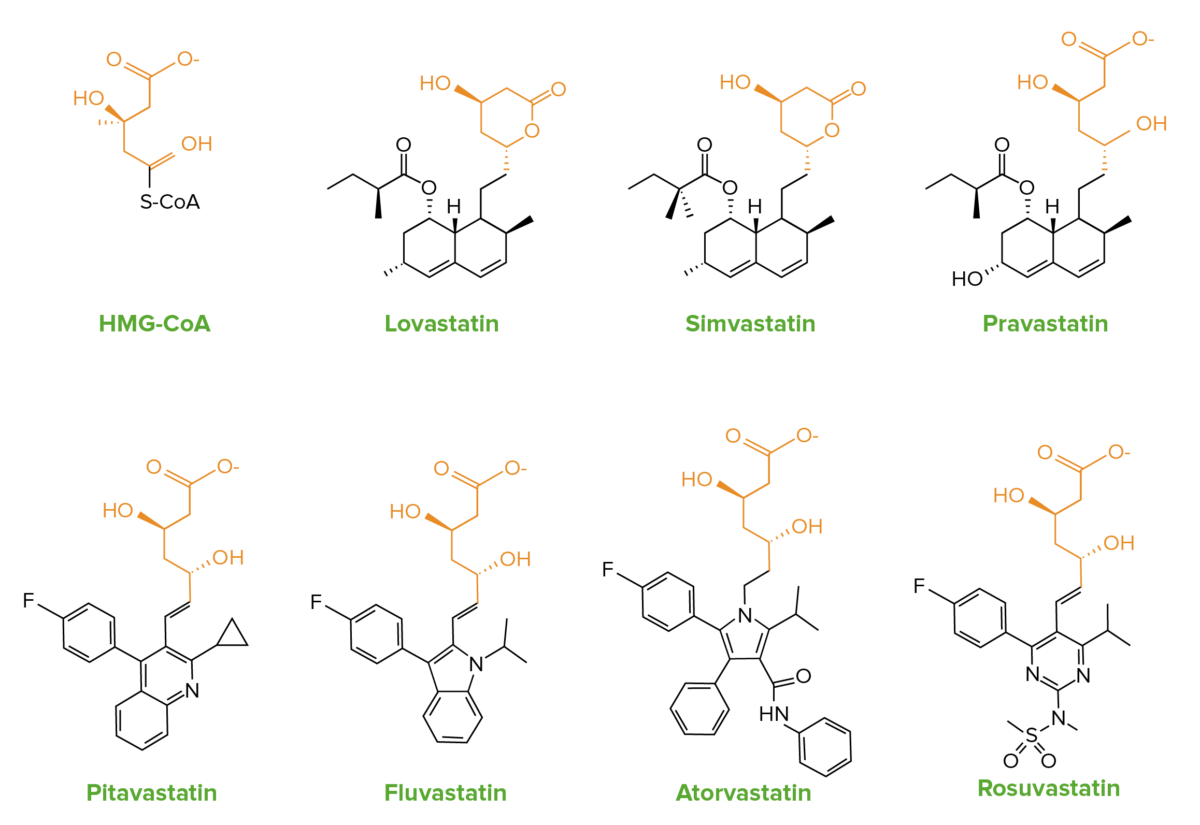
Las similitudes en la estructura química de las estatinas con la HMG-CoA:
La lovastatina y la simvastatina contienen un anillo de lactona inactivo, que se hidrolizan en el cuerpo a la forma activa.
Fisiología normal:
Estatinas:
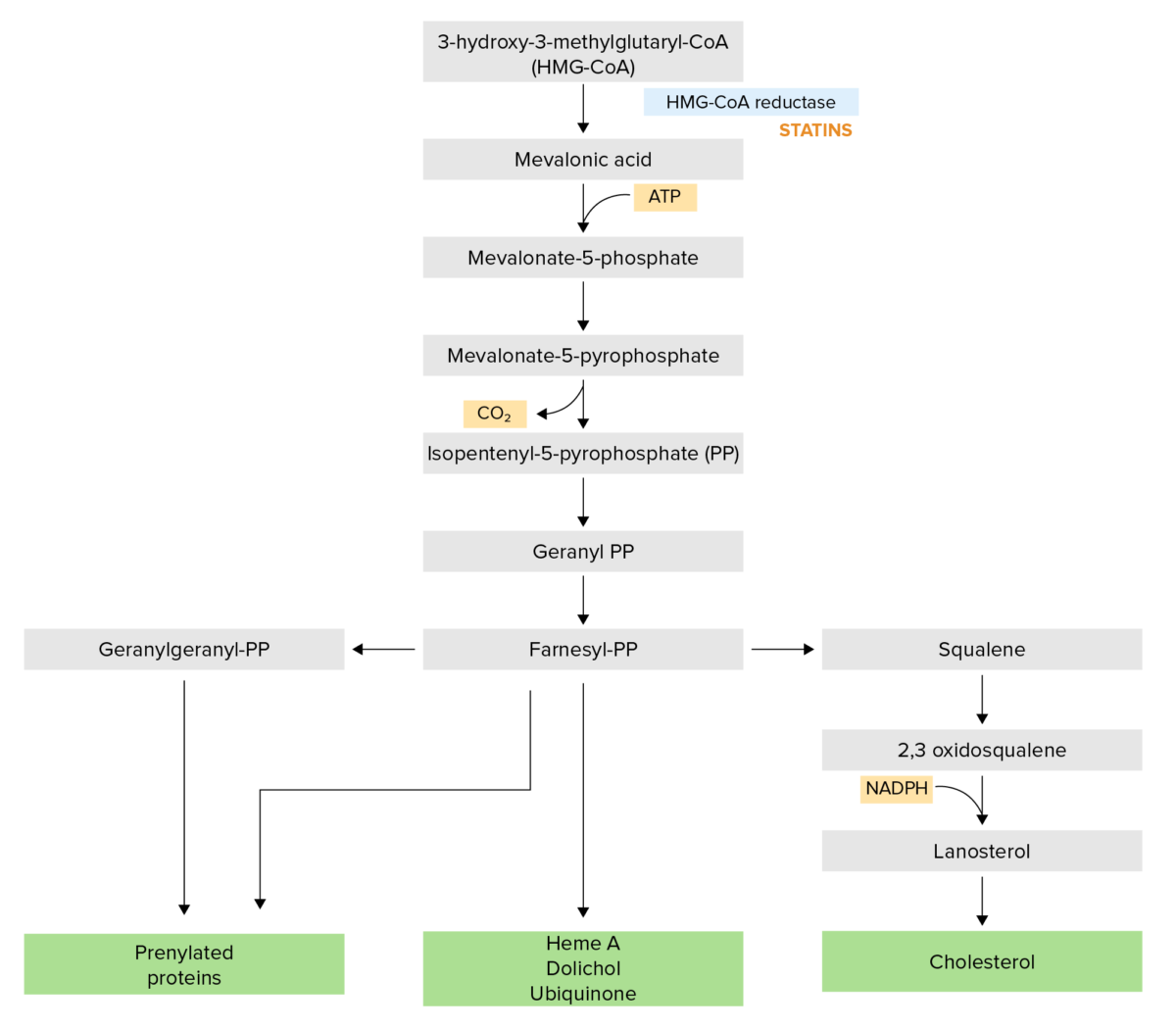
La vía de síntesis del colesterol:
Las estatinas inhiben competitivamente la HMG-CoA reductasa, el cual es un paso limitante en la vía de síntesis.
NADPH: nicotinamida adenina dinucleótido fosfato
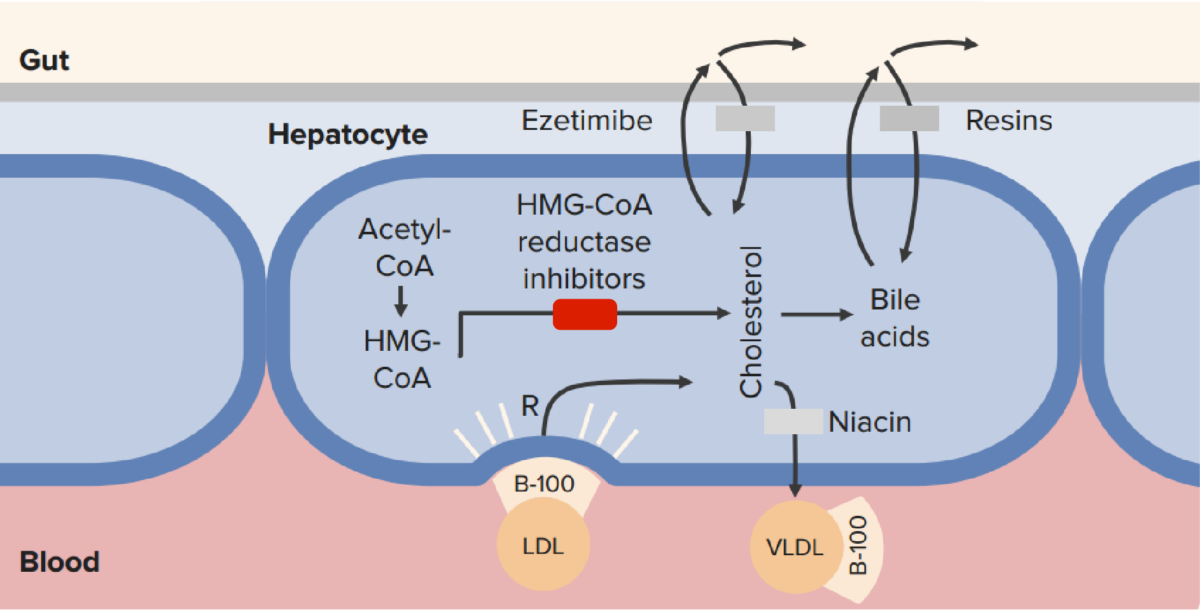
El mecanismo de acción de las estatinas (inhibidores de la HMG-CoA reductasa) en comparación con otras terapias hipolipemiantes:
Las estatinas bloquean la síntesis de colesterol intrahepatocitario, lo que da como resultado una regulación positiva de los receptores de LDL y una reducción de la LDL sérica.
CoA: coenzima A
Las estatinas se clasifican según su porcentaje de reducción de LDL y la dosificación:
Las estatinas están indicadas para tratar las dislipidemias con la intención de reducir los eventos cardiovasculares secundarios mayores:
La siguiente tabla compara y contrasta los miembros de los medicamentos de la clase estatinas. Los medicamentos se enumeran en orden descendente de potencia.
| Estatina | Solubilidad | Metabolismo | Vida media plasmática | Tiempo óptimo de dosificación |
|---|---|---|---|---|
| Pitavastatina | Lipofílico | CYP2C9 | 12 horas | Cualquier momento |
| Rosuvastatina | Hidrofílico | CYP2C9 | 19 horas | Cualquier momento |
| Atorvastatina | Lipofílico | CYP3A4 | 14 horas | Cualquier momento |
| Lovastatina | Lipofílico | CYP3A4 | 2‒3 horas | Noche |
| Simvastatina | Lipofílico | CYP3A4 | 2‒3 horas | Noche |
| Pravastatina | Hidrofílico | Sulfatación | 1‒3 horas | Cualquier momento |
| Fluvastatina | Lipofílico | CYP2C9 | 1‒3 horas | Noche |